蓝莓叶斑病病原菌鉴定及其生物学特性
杨秀梅, 王丽花, 张艺萍, 吴学尉, 周旭红
1. 云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心/云南省花卉育种重点实验室, 昆明 650205;2. 云南大学 农学院, 昆明 650504; 3. 云南中医药大学 科技处科技实验中心, 昆明 650500
蓝莓(Vaccinium)为杜鹃花科(Ericaceae)越橘属(Vaccinium)蓝果类型植物, 又名蓝浆果, 是新兴的小浆果类树种. 蓝莓果实营养价值高, 除一般的果糖、 维生素外还富含抗氧化剂、 花青素和类黄酮, 其独特的保健价值越来越被人们关注[1-2]. 我国从2000年开始规模化种植蓝莓, 截至2020年底, 国内有超过20个省(区、 市)开展产业化种植, 栽培面积达6.64万hm2, 总产量34.72万t, 我国已成为全球蓝莓主产国之一[3-4]. 云南省具有海拔高、 紫外线强、 光照充足的特点, 蓝莓果实成熟期较早, 甜度高, 耐贮运, 产区优势明显, 目前已在玉溪、 丽江、 曲靖、 大理等地建立了规模化的蓝莓种植区. 近年来, 随着蓝莓栽培面积的不断扩大, 病害也随之传播蔓延并逐年加重, 成为制约蓝莓产业健康发展的主要因素.
叶斑病是为害蓝莓较严重的病害之一, 主要发生在蓝莓的营养生长期, 大部分病原菌会造成果实病害, 影响蓝莓的产量和质量. 国外报道蓝莓叶斑病主要有两种类型, 由Septoriaalbopunctata引起的壳针孢型, 以及由Gloeosporiumminus引起的炭疽型, 它们都会使花芽减少, 进而降低果实产量[5]. 国内蓝莓叶部病害的病原鉴定结果各地不一致. 徐成楠等[6]对辽宁省部分地区疑似炭疽病的蓝莓枝条及叶片进行病原分离和鉴定, 明确是由尖孢炭疽菌(Colletotrichumacutatum)和胶孢炭疽菌(Colletotrichumgloeosporioides)复合侵染所致. 余磊等[7]报道云南蓝莓叶斑病普遍发病率为15%~20%, 严重果园可达75%以上, 其病原菌为细极链格孢菌(Alternariatenuissima). 贵州省黔东南州台江县蓝莓种植地发生的叶斑病, 经鉴定病原菌为巨腔茎点霉(Phomamacrostoma)[8]. 石凌波[9]研究发现拟盘多毛孢(Pestalotiopsistrachicarpicola)是引起广西桂林蓝莓叶斑病的病原菌. 薛德胜等[10]报道, 山东半岛蓝莓种植基地发现的蓝莓叶斑病的病原菌为棒状拟盘多毛孢(Pestalotiopsisclavispora). 蓝莓叶部病害的症状相似度很高, 病原菌种类复杂多样, 其为害在国内蓝莓种植基地有加重趋势, 应引起足够重视.
2019年8月, 云南玉溪蓝莓种苗繁育基地首次发现蓝莓叶斑病, 发病初期叶面或叶缘出现红褐色的小圆斑, 随着病害的发展叶斑面积不断扩大, 形成大面积的红褐色病斑, 继而叶片枯萎凋落, 植株枯萎死亡. 据调查, “绿宝石”发病最为严重, 发病率30%以上, 有些地块甚至成片死亡, 严重影响蓝莓种苗的质量. 为明确该病的病原菌种类及生物学特性, 本研究采用形态学特征和多基因系统发育分析对病原菌进行鉴定, 通过活体叶片接种测定病原菌的致病性, 同时研究病原菌的生物学特性, 为蓝莓叶斑病的发生流行规律研究和综合防治提供理论依据.
1 材料与方法
1.1 材料
2019年8月在云南玉溪蓝莓种苗繁育基地采集发病植株, 带回实验室并于4 ℃冰箱保存, 病株样品及致病性测定试验所用蓝莓品种均为“绿宝石”.
1.2 方法
1.2.1 蓝莓叶斑病病原菌的分离与形态学鉴定
选取具有典型症状的蓝莓病叶, 采用组织分离法[11]从病健交界处切取5 mm×5 mm的叶片, 在75%乙醇中浸泡3~5 s, 然后置于0.1%升汞中浸泡1~2 min, 用无菌水冲洗3次, 将其接种至马铃薯葡萄糖琼脂(potato dextrose agar, PDA)平板培养基上, 置于25 ℃恒温培养箱中培养5 d, 挑取菌落边缘的少量菌丝体进行转接培养. 7 d后挑取菌丝镜检, 观察到分生孢子产生后, 用无菌水配制成1×105个/mL的孢子悬浮液母液, 将母液稀释1×104倍并充分混匀. 取0.1 mL孢子悬浮液均匀涂布在4%的水琼脂平板培养基上, 将培养基切成0.4 cm×0.4 cm的小块, 逐个镜检后挑取带有单个分生孢子的琼脂块置于新的PDA平板上, 25 ℃条件下培养, 再接种至PDA斜面培养基上, 4 ℃保存备用.
病原菌的形态学鉴定参照Lombard等[12]的方法, 挑取菌丝置于麦芽汁琼脂(malt extract agar, MEA)培养基上, 于25 ℃培养7 d, 观察菌落特征. 挑取菌丝置于香石竹叶片培养基上, 于25 ℃条件下培养, 待产孢后于光学显微镜下观察分生孢子梗及囊泡的形状. 随机选取20个分生孢子, 观察其形态、 隔膜数, 测量孢子大小.
1.2.2 蓝莓叶斑病病原菌的分子生物学鉴定
按照生工生物工程(上海)股份有限公司的真菌基因组DNA提取试剂盒提供的方法提取菌株DNA. 参照Carbone等[13]的方法, 选取肌动蛋白(actin)、 组蛋白H3(histone H3)、 翻译延伸因子-1α(translation elongation factor 1-alpha)和β-微管蛋白(β-tubulin)4个基因进行PCR扩增, 扩增所用引物序列见表1. PCR反应体系: 2×TaqPCR Green Mix 12.5 μL, 10 μmol/L上游引物和下游引物各1 μL, DNA模板2 μL, ddH2O 8.5 μL, 总体积25 μL. PCR扩增程序: 94 ℃预变性3 min; 94 ℃变性30 s、 50 ℃退火30 s、 72 ℃延伸1 min, 35个循环; 最后72 ℃延伸10 min. 将PCR扩增产物送至宝生物工程(大连)有限公司测序, 获得的序列在NCBI网站上进行同源性比对, 并提交序列至GenBank. 从GenBank下载相似度高的Act,H3,EF-1α和β-tub基因序列作为参考序列(表1), 通过MEGA7.0自举法(Bootstrap)1 000次重复检验, 邻位相接法(Neighhor-Joining)构建系统发育树并进行聚类分析.
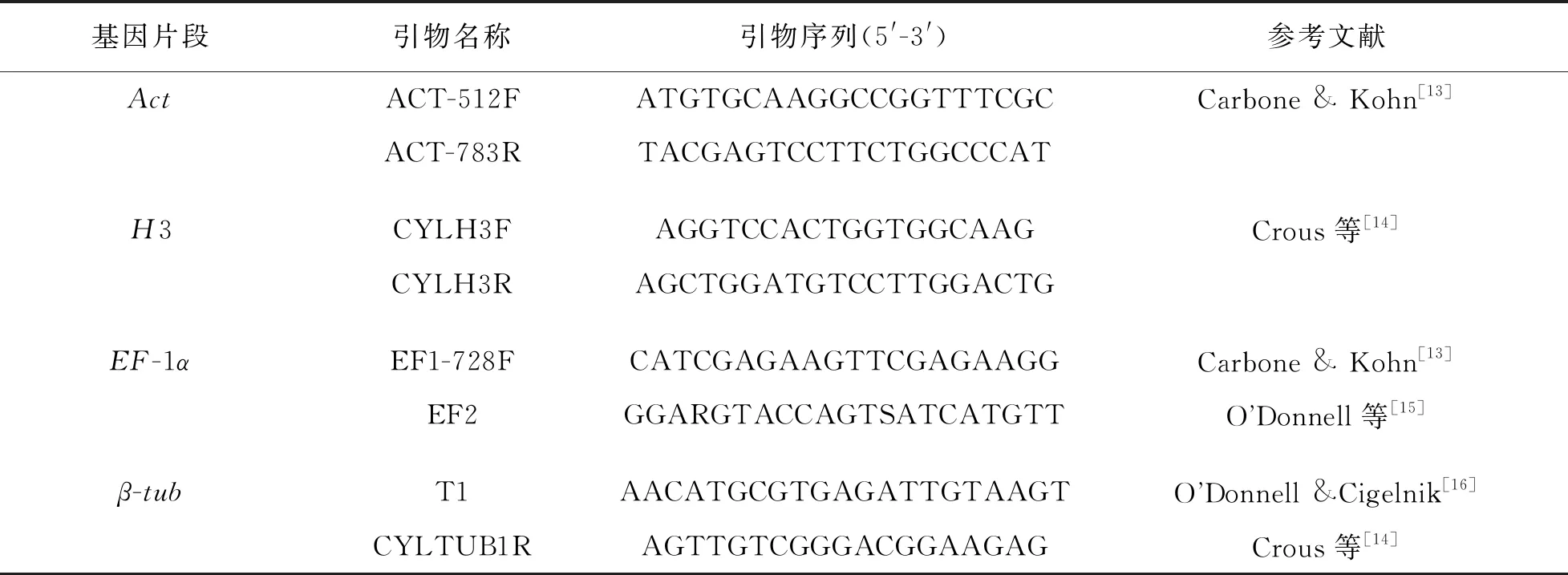
表1 多位点基因所用引物序列
1.2.3 蓝莓叶斑病病原菌的致病性测定
采用涂抹接种法[11]进行病原菌的致病性测定. 将供试菌株转接至MEA培养基, 25 ℃培养10 d后挑取菌丝镜检, 观察到分生孢子产生后, 用无菌水配制成1×106个/mL的孢子悬浮液. 用毛笔将悬浮液涂抹至一年生盆栽蓝莓植株叶片上, 套袋保湿48 h, 去袋后植株在25 ℃、 12 h光照、 12 h黑暗的条件下培养, 观察叶片发病情况. 以无菌水涂抹叶片为对照, 每处理5株. 待叶片发病后, 根据柯赫氏法则, 对病叶进行病原分离, 观察分离菌与原接种菌的形态学特征是否一致.
1.2.4 蓝莓叶斑病病原菌的生物学特性测定
碳、 氮源对病原菌菌丝生长的影响: 以Czapek培养基为基础培养基, 采用葡萄糖、 蔗糖、 麦芽糖、 果糖、 可溶性淀粉为碳源, 硝酸钠、 甘氨酸、 尿素、 蛋白胨、 硫酸铵为氮源; 用直径为5 mm的打孔器在活化7 d后的菌落边缘打取菌饼, 分别接种至含有不同碳源和氮源的培养基上, 25 ℃培养, 7 d后采用十字交叉法测量菌落直径, 每处理重复4次.
温度对病原菌菌丝生长的影响: 取直径5 mm的菌饼转接至PDA平板培养基上, 分别置于5,10,15,20,25,30,35 ℃温度下培养, 7 d后采用十字交叉法测量菌落直径, 每处理重复4次.
pH值对病原菌菌丝生长的影响: 用1 mol/L HCl和1 mol/L NaOH将PDA培养基的pH值分别调至4,5,6,7,8,9,10, 用直径5 mm的打孔器在活化7 d后的菌落边缘打取菌饼, 接种于不同pH值的PDA平板中央, 置于25 ℃下恒温培养, 7 d后采用十字交叉法测量菌落直径, 每处理重复4次.
1.3 数据分析
采用SPSS 2.0进行数据统计分析, 应用Duncan氏新复极差法进行显著性检验.
2 结果与分析
2.1 蓝莓叶斑病的症状
发病初期叶面或叶缘出现红褐色的斑点(图1a), 随着病害的发展, 病斑面积不断扩大, 形成连片的红褐色病斑(图1b), 最终叶片枯萎凋落, 植株枯萎死亡.

图1 蓝莓叶斑病症状
2.2 蓝莓叶斑病病原菌的分离和形态学鉴定
从发病蓝莓叶片上分离获得3个菌株, 各菌株的菌落形态及培养特性一致. 以菌株LC-1为供试菌株进行研究. 菌株在MEA培养基上25 ℃培养2 d即可长出白色至浅红棕色的丝绒状菌落(图2a). 菌落平伏, 边缘不整齐, 后期产生褐色至深褐色的色素渗入至培养基内部. 大分子孢子无色, 圆柱形, 两端半圆形, 有1~3个隔膜, 大小为(48~82) μm×(4~7) μm(图2b). 大型分生孢子梗无色, 有分枝, 长303~410 μm, 顶端囊泡棍棒状, 大小为(12~30) μm×(2~5) μm(图2c). 分生孢子梗分枝末端产生2~4个瓶梗, 顶端为产孢细胞, 瓶状, 分生孢子从产孢细胞内生出(图2d). 根据形态学特征, 将该病原菌初步鉴定为丽赤壳菌(Calonectriaspp.).

图2 病原培养物及病原菌形态特征
2.3 蓝莓叶斑病病原菌的分子生物学鉴定
将菌株LC-1的Act,H3,EF-1α和β-tub基因序列提交至NCBI/GenBank(表2), 获得登录号MZ872640(Act), MZ872641(H3), MZ872642(EF-1α), MZ872643(β-tub). Blast比对结果表明, 供试菌株与柯氏丽赤壳菌(Ca.colhounii)的覆盖率、 相似度最高. 该菌株的Act,H3,EF-1α和β-tub序列与Ca.colhouniiCBS 293.79相关基因序列的同源性达99%以上. 基于4个基因序列构建的系统发育树表明, 菌株LC-1与Ca.colhounii聚在同一分支(图3), 结合菌株形态特征和基因序列分析, 将蓝莓叶斑病的病原菌鉴定为柯氏丽赤壳菌(Ca.colhounii).

图3 基于Act,H3,EF-1α和β-tub 4段基因建立的系统发育树

表2 系统发育分析引用的GenBank序列
2.4 蓝莓叶斑病病原菌的致病性测定
将供试菌株LC-1按柯赫氏法则接种, 2 d后叶片开始发病, 叶面产生红褐色的小圆斑(图4a). 5 d后病斑面积不断扩大, 形成连片的红褐色病斑, 叶片枯萎凋落(图4b), 对照植株叶片(图4c)未发病. 从发病叶片分离获得的病原菌与原接种菌性状一致, 表明Ca.colhounii为蓝莓叶斑病的病原菌.

图4 病原菌致病性测定
2.5 蓝莓叶斑病病原菌的生物学特性测定
2.5.1 病原菌对碳源和氮源的利用
供试菌株在5种碳源培养基上均能生长, 对可溶性淀粉的利用效果最好, 培养7 d时菌落直径为5.18 cm, 其次为葡萄糖, 两者对菌丝生长的影响差异无统计学意义(图5a). 在氮源利用试验中, 病原菌对甘氨酸和尿素的利用较好, 菌落直径分别为5.00 cm和4.76 cm, 两者对菌丝生长的影响差异无统计学意义(图5b).
2.5.2 不同温度、 pH值对菌丝生长的影响
供试菌株在10~30 ℃范围内均能生长, 最适宜温度为25 ℃, 菌落直径为7.90 cm; 温度为10~20 ℃时菌丝生长较缓慢, 温度为5 ℃和35 ℃时菌丝停止生长(图5c). 病原菌对酸碱度适应范围较广, 在pH值4~10范围内均能生长, 最适pH值为7(图5d).

数据为平均数±标准差, 小写字母不同表示处理间差异有统计学意义(p<0.05).
3 结论与讨论
丽赤壳属(Calonectria)真菌是一类重要的植物病原菌, 其寄主范围广泛, 可侵染桉树、 花生、 大豆等农作物以及绿巨人、 天南星、 睡莲等园艺植物, 引起叶斑及叶片焦枯、 茎干腐烂、 根系或地下果实腐烂等症状, 造成巨大的经济损失[17-20]. 丽赤壳属真菌形态学分类的重要依据是囊泡的形状, 但是囊泡形状不易区分, 因此在确定菌株种群分类时还需进一步的分子生物学鉴定, 目前结合形态学和多基因系统学鉴定该属真菌已成为发展趋势[21-22]. Lombard等[12]根据形态学研究和多基因系统发育分析, 鉴定了世界范围内的68种丽赤壳属真菌, 建议对于未知的丽赤壳属真菌的鉴定, 可应用H3,EF-1α,β-tub3段基因联合建树,进行系统发育分析, 从而确定其分类地位. 本研究对云南省玉溪市蓝莓种苗繁育基地发生的叶部病害进行形态学特征及Act,H3,EF-1α和β-tub多基因系统发育分析, 确定其病原菌为柯氏丽赤壳菌(Ca.colhounii), 是国内首次报道. 细极链格孢菌(Alternariatenuissima)、 巨腔茎点霉(Phomamacrostoma)、 棒状拟盘多毛孢(Pestalotiopsisclavispora)等真菌均能侵染蓝莓引起叶斑病, 且引起的症状相似度很高, 但与丽赤壳属真菌的亲缘关系较远. 目前已发现丽赤壳属的另外2个种群也可侵染蓝莓引起病害, 费诺亚等[23-24]报道湖北随州蓝莓枝枯病的病原菌为加拿大丽赤壳菌(Ca.canadensis)、 云南曲靖蓝莓根腐病的病原菌为冬青丽赤壳菌(Ca.ilicicola). 该属真菌在国内蓝莓种植基地的种群分布及病害流行规律有待进一步研究.
病原菌的生物学特性与病害发生和流行规律有着密切的关系[25]. 盖云鹏等[26]研究结果表明, 引起花生黑腐病的冬青丽赤壳在10~30 ℃范围内均能生长, 温度低于5 ℃或高于35 ℃时菌丝停止生长, 菌丝最适生长温度为25~28 ℃; 费诺亚等[23]对加拿大丽赤壳的生物学特性研究结果表明, 菌丝生长的最适温度为25 ℃, 但在5 ℃与35 ℃条件下菌丝不能生长, 这与本研究结果一致. 生物学特性研究结果表明, 柯氏丽赤壳菌在pH值4~10范围内均能生长, 且对供试大部分碳、 氮源均可有效利用, 表明该菌有较强的环境适应性. 本研究对于蓝莓叶斑病的鉴定和防治具有指导意义, 为开展该病的田间流行规律研究及病害防治工作提供了理论依据.

