棉花GhVTC2基因促进烟草BY2悬浮细胞和拟南芥主根伸长
董祥雨, 陈丽华, 涂泽行, 曹爱萍,2,3, 王 斐,2,3, 李鸿彬,2,3
(1. 石河子大学生命科学学院, 石河子832003; 2. 绿洲城镇与山盆系统生态兵团重点实验室, 石河子832003; 3. 新疆植物药资源利用教育部重点实验室, 石河子832003)
抗坏血酸(AsA)是植物中含量最丰富的抗氧化小分子物质,与植物生长发育和逆境响应密切相关[1]。AsA能够调控植物种子萌发[2]、根系生长[3]、开花[4]、成熟[5]、衰老[6]、细胞延展和伸长[7]等过程。在植物细胞中,D-Man/L-Gal途径被认为是植物AsA合成的主要途径,该途径中的许多酶已经被鉴定。该途径一些基因的突变缺失导致AsA水平显著降低,一些基因的过量表达显著增加了AsA含量[8]。L-半乳糖磷酸化酶(又称为VTC2)是D-Man/L-Gal途径中的第二个关键酶,能够催化L-半乳糖(L-Gal)转化为L-半乳糖-1-磷酸(L-Gal-1-P)。拟南芥中编码GDP-L-半乳糖磷酸化酶的两个同源基因为VTC2和VTC5,vtc2/vtc5双突变体在没有外源AsA的情况下不能正常生长[9]。当对水稻幼苗外源施加L-半乳糖后,地上部分AsA含量增加了5倍[10]。
棉纤维是由胚珠表皮的单细胞毛状体发育而来,是纺织工业中的重要原材料,纤维长度和比强度是纤维品质的重要参数,决定着纤维品质的优劣及其在纺织工业中的利用价值[11]。我们前期的研究发现AsA的合成与代谢与纤维发育紧密相关。调控AsA生物合成的D-Man/L-Gal途径中的第一个关键基因VTC1基因[12]、参与AsA代谢的抗坏血酸过氧化物酶(APX)[13]、抗坏血酸氧化的抗坏血酸氧化酶(AO)[14]、抗坏血酸再生的单脱氢抗坏血酸还原酶(MDHAR)[15]均与纤维伸长发育密切相关。目前,D-Man/L-Gal途径中的VTC2基因及其调控的AsA生物合成在棉花纤维发育中的功能和作用机制仍不清楚。
本研究从陆地棉中克隆获得GhVTC2基因,研究其在棉花纤维发育及细胞伸长过程中的功能,实验结果为深入研究VTC2基因的表达调控及其参与细胞发育的生物学功能提供理论参考,为利用基因工程技术培育出高品质棉花奠定基础。
1 材料和方法
1.1 材料
在试验田中种植陆地棉徐州142(X142)及其无长绒无短绒突变体(Fuzzless-lintless,fl),按照开花后的不同时间收集纤维、胚珠等实验材料。烟草BY2悬浮细胞在含有30 g蔗糖、200 mg/L磷酸二氢钾、0.2 mg/L 2,4-D、100 mg/L肌醇、1 mg/L硫胺和1 mg/L甘氨酸的固体培养基中生长,固体培养基中添加7.5 g/L琼脂粉,pH值为5.8。将野生型拟南芥(哥伦比亚生态型)和转基因株系在22 ℃光/暗循环12 h的白色荧光灯下盆栽生长。
1.2 方法
1.2.1 基因克隆与植物过量表达载体构建
用CTAB法从棉花叶片中提取总RNA。设计引物克隆GhVTC2基因的CDS序列(表1)。将PCR产物连接到pMD-19T载体中,通过测序分析证实载体构建是否成功。双酶切pMD-19T-GhVTC2后,将CaMV35S启动子和NOS终止子调控的全长cDNA克隆到pCAMBIA2300载体上,构建35S:GhVTC2过量表达载体。

1.2.2 qRT-PCR表达分析
使用SYBR Green qPCR试剂盒(Takara)通过定量逆转录聚合酶链反应(qRT-PCR)对棉花基因表达模式进行检测。以GhUBQ7(GenBank登录号:XM_016855110)作为参考基因,采用2-ΔΔCt法对实验数据进行分析。
1.2.3烟草BY2转基因悬浮细胞及其检测
烟草BY2细胞悬浮液在改良的Linsmaier和Skoog(LS)培养基中培养生长,利用根癌农杆菌共培养进行细胞转化。将鉴定后的1mL BY2悬浮细胞置于1.5mL EP管中,加入8μL5mg/L氟代吲哚乙酸(FDA),避光染色10min,在荧光显微镜下进行细胞长度等表型观察统计。
1.2.4AsA含量的测定
烟草BY2悬浮细胞和拟南芥根组织样品在液氮中研磨成粉末,每次测定取约20mg样品,用0.1mol/L HCl和1mmol/L EDTA匀浆混匀,4℃下12000r/min离心5min,用联吡啶分光光度法在534nm处测定总AsA含量。
2 结果与分析
2.1 GhVTC2基因的表达分析
从陆地棉中克隆获得GhVTC2基因,该基因的开放读码框序列为1 350 bp,编码含有450个氨基酸残基的蛋白质,理论分子量为50.47 ku、理论等电点为5.14。采用qRT-PCR方法研究GhVTC2在不同组织和不同纤维发育时期的表达情况,分别收集X142棉花开花后0、3、5、10、15、20和25 d的纤维、10 d的无长绒无短绒fl突变体胚珠,以及根、茎、叶等材料,检测GhVTC2基因的表达水平。结果显示,在不同的纤维发育时期中,GhVTC2基因在10 d的纤维材料中表达量达到顶峰,暗示其在纤维快速伸长发育中的潜在重要作用。在不同组织中,GhVTC2基因在根中显著累积,表明其可能对根的发育具有重要作用(图1)。

采集0 d和3 d胚珠、5~25 d的纤维、10 d fl变体胚珠,以及棉花根、茎和叶进行qRT-PCR检测。将10 d fl突变体胚珠的qRT-PCR数据人工设为1,以棉花GhUBQ7为内参基因。图1 GhVTC2基因的表达分析Figure 1 Expression analysis of GhVTC2 gene
2.2 GhVTC2促进BY2悬浮细胞伸长
为研究GhVTC2对烟草BY2悬浮细胞发育的影响,扩增获得GhVTC2基因[图2(a)],并构建35S:GhVTC2载体[图2(b)],将经鉴定后的载体遗传转化烟草BY2悬浮细胞,将鉴定后的转基因株系和野生型细胞在荧光显微镜下进行观察分析[图3(a)]。结果显示:与野生型BY2悬浮细胞相比,过表达转GhVTC2基因烟草悬浮细胞的长度显著增加,野生型BY2悬浮细胞长度为(67.112±0.081)μm,过表达转GhVTC2基因烟草悬浮细胞的长度为(89.980±0.239)μm,长度增加了约34%[图3(b)]。进一步AsA含量测定结果显示,转基因烟草细胞中的AsA含量显著增加[图3(c)]。这些结果表明GhVTC2基因可能通过增加细胞内AsA的含量促进烟草细胞的伸长。
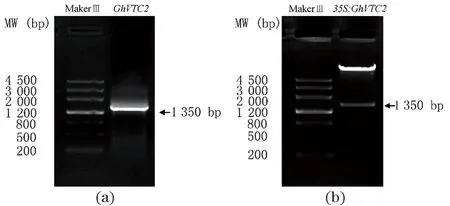
(a)GhVTC2基因PCR扩增;(b)35S:GhVTC2过量表达载体双酶切验证。图2 35S:GhVTC2过量表达载体构建Figure 2 Construction of overexpression vector 35S:GhVTC2
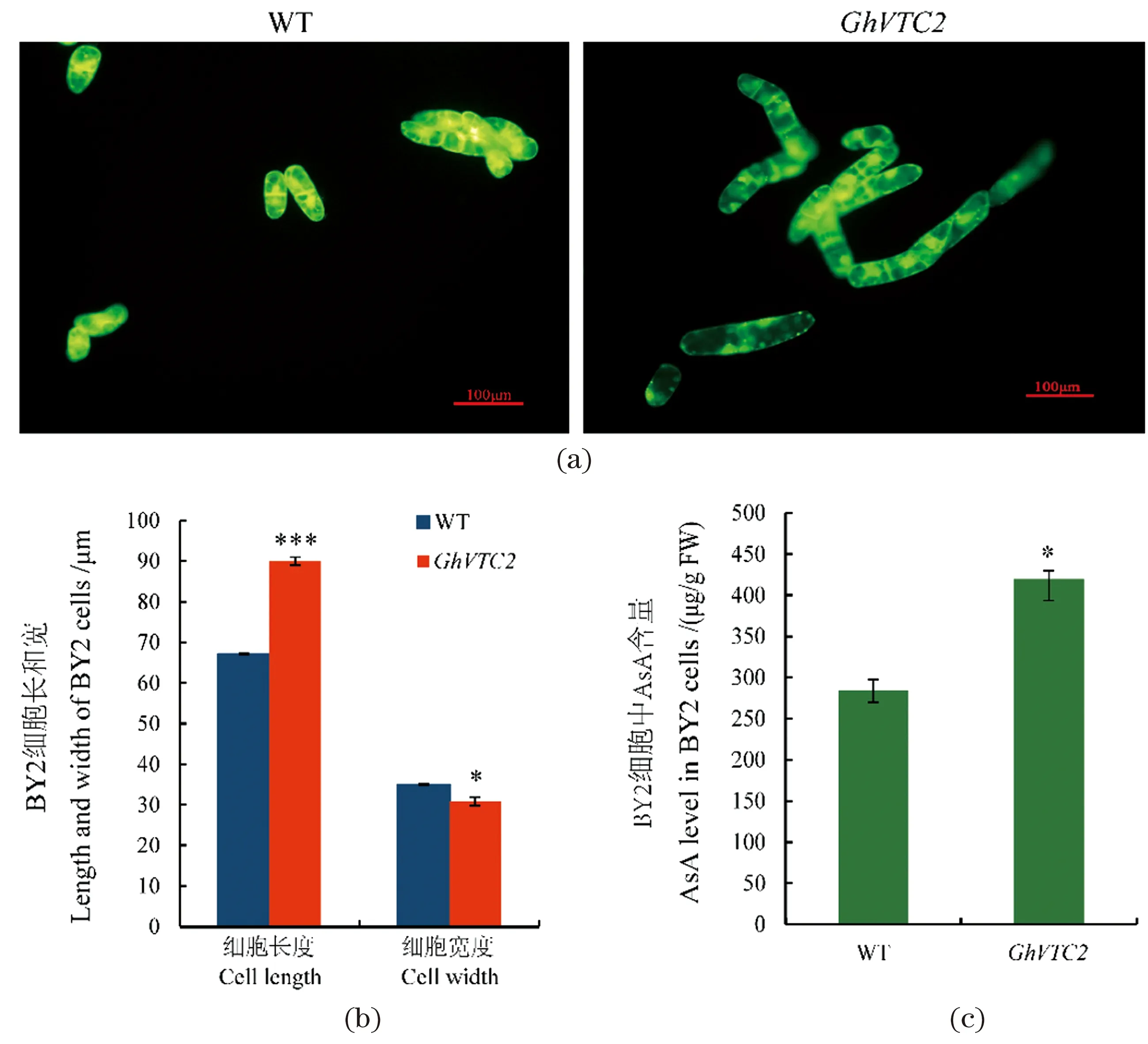
(a)野生型和转基因烟草BY2悬浮细胞的表型分析;(b)野生型和转基因烟草BY2悬浮细胞的测量与统计;(c)抗坏血酸含量测定。随机选取生长成熟的BY2细胞约500个,分别测量其长和宽,进行数据统计。* 表示P<0.05,*** 表示P<0.001。图3 过表达转GhVTC2基因烟草悬浮细胞的表型分析Figure 3 Phenotype analysis of transgenic tobacco BY2 cells overexpressing GhVTC2
2.3 GhVTC2促进拟南芥主根伸长发育
GhVTC2在快速伸长的纤维中显著累积,且在根组织中优势表达(图1),暗示其可能对植物根发育具有重要作用。将35S:GhVTC2遗传转化拟南芥研究其对植物根发育的重要功能。选择生长10 d的转基因拟南芥幼苗的根部进行表型观察,如图4(a)所示,转基因拟南芥的主根显著伸长。野生型拟南芥主根长为(3.23±0.035)cm,转基因拟南芥主根长度为(3.75±0.064)cm[图4(b)],表明GhVTC2的过量表达显著促进拟南芥主根的伸长发育。抗坏血酸含量检测结果显示,转基因拟南芥主根中的AsA含量显著增加[图4(c)]。结果表明,GhVTC2基因可能通过促进细胞内AsA的累积进而促进拟南芥主根的伸长发育。
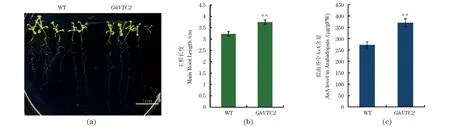
(a)野生型和转基因拟南芥的表型分析;(b)野生型和转基因拟南芥主根长度统计分析;(c)野生型和转基因拟南芥主根中的AsA含量测定。** 表示P<0.01。图4 过表达转GhVTC2基因拟南芥主根表型分析与统计Figure 4 Phenotype and statistics analysis of main roots of transgenic Arabidopsis plant lines overexpressing GhVTC2
2.4 GhVTC2启动子的克隆及其响应乙烯处理的表达活性分析
为了深入研究GhVTC2基因的调控机制,克隆获得该基因5′端上游2 461 bp的启动子序列PGhVTC2,该启动子包含多个顺式作用元件,尤其是乙烯响应元件ERE,暗示该基因的表达可能受到激素乙烯的调控。根据PGhVTC2所包含的ERE元件,按照图5 (a)所示的构建示意图,分别构建包含ERE元件的P1(-2 464~-1)、P2(-1 820~-1)、P3(-1 336~-1)3个载体,及不包含ERE元件的P4(-868~-1)、P5(-416~-1)2个载体。将不同载体瞬时转化烟草叶片并利用外源ACC处理,结果显示,与非转基因的对照相比,转化了含有ERE元件的启动子P-1336、P-1820、P-2464的转基因烟草叶片在ACC处理后,表现出显著增强的驱动GUS表达的活性[图5 (b)]。进一步将不同长度的5′端缺失载体瞬时转化烟草叶片,利用外源乙烯前体ACC处理分析不同启动子片段的活性。结果显示,不同5′端缺失的启动子表现出不同驱动GUS表达的活性,随着启动子序列长度变短其活性呈逐渐降低的趋势[图5 (c)]。结果表明,GhVTC2的功能发挥可能受激素乙烯的调控。
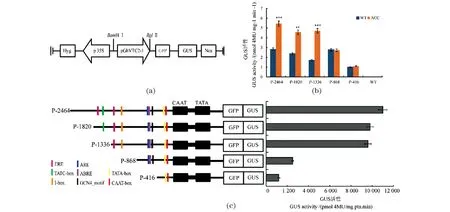
(a)含有不同长度启动子序列的5′端缺失载体构建示意图;(b)ACC处理下不同的5′端缺失载体的表达活性分析;(c)含有不同长度启动子序列的5′端缺失载体的表达活性分析,启动子所包含的不同元件用不同颜色的实心方框表示。** 表示P<0.01,*** 表示P<0.001。图5 GhVTC2的启动子活性分析Figure 5 Promoter activity analysis of GhVTC2
3 讨论与结论
AsA在植物生长发育、细胞分裂和增殖、响应逆境胁迫过程中发挥着重要作用。AsA的合成路径中,VTC2是重要的关键酶,目前已在拟南芥[8]、番茄[16]、烟草[17]、大豆[18]等多种植物中鉴定分离出VTC2基因。通过转基因研究表明在多个物种中过量表达VTC2基因可提高植物体内抗坏血酸的含量。研究表明在拟南芥突变体中敲除GDP-L-半乳糖磷酸化酶(GGPase)基因后AsA含量只有野生型的30%[19]。L-半乳糖途径是合成AsA的主要途径,VTC1和VTC2基因转录调控与AsA的积累量关系非常密切,如不施加外源AsA,vtc2/vtc5双突变体就不能正常生长[20]。此外,还有研究发现,植物在逆境条件下可以调节AsA的含量和相关基因的转录水平。在光照条件下,转基因西红柿叶片中AsA含量比遮阴条件下的AsA含量增加近2倍[18],当植物移至强光下,抗坏血酸合成相关基因VTC2的表达量和相对应的GGPase酶活性极具增强[21]。莱茵衣藻细胞在氧胁迫下GGP转录水平和AsA含量都有所增加[22]。本研究从陆地棉中克隆获得1个GhVTC2基因[图2(a)],其在纤维快速伸长发育时期优势表达,并在根组织中显著累积(图1),表明其可能与根发育及细胞伸长发育密切相关。
AsA可以通过一系列途径促进细胞的伸长发育。抗坏血酸氧化酶主要分布在植物细胞壁中,尤其在迅速生长的细胞中表达活性较高。细胞壁内的抗坏血酸和脱氢抗坏血酸(DHA)通过影响蛋白和多糖的交联互通从而使细胞壁疏松。脱氢抗坏血酸可以转变成细胞壁草酸盐,后者与Ca2+结合形成的结合体可间接调节细胞壁Ca2+的水平[23]。植物体内抗坏血酸和过氧化氢的平衡可以影响木质素单体的聚合作用进而调节细胞壁的木质化过程。AsA可以通过影响细胞周期和细胞伸长来影响植物的生长和发育,在细胞周期的G1期至S期参与细胞壁代谢和细胞膨大[24]。AsA在植物根端区代谢较活跃区域的积累量高,研究发现AsA可以通过抑制细胞壁木质化或增强根细胞的新陈代谢能力这两种方式来调节根系的生长[25]。另外,外源添加2 mmol/L AsA能降低丙二醛含量,增加可溶性蛋白含量,促使BY2烟草悬浮细胞的分裂和生长速度进一步增强[26],这些结果说明AsA在促进植物细胞的增殖和生长以及调控植物生长发育方面起着重要的作用。本研究中,过量表达GhVTC2基因显著促进烟草BY2悬浮细胞的伸长发育和拟南芥主根的伸长(图3、4),且转基因烟草悬浮细胞和转基因拟南芥根中的AsA显著增加,表明GhVTC2可能通过提升细胞内AsA的含量进一步促进细胞伸长发育。
AsA作为细胞内的抗氧化小分子物质,其功能的发挥受到多种植物激素的调控。乙烯与AsA的合成及代谢紧密相关。ABA不敏感4(ABI4)通过转录抑制拟南芥中的ACS介导AsA调节植物的生长和乙烯产生[27]。AsA是植物细胞中主要的氧化还原缓冲液。在两个独立的AsA缺失拟南芥突变体(vtc2-1和vtc2-4)中,AsA生物合成基因GDP-L-半乳糖磷酸化酶产生的乙烯量比野生型植物高。AsA缺乏改变植物的激素信号传导与乙烯氧化还原之间的相互作用,提供一个控制生物量积累的调节节点[28]。乙烯在盐胁迫反应中起着重要作用。越来越多的研究表明乙烯通过活性氧(ROS)稳态调节耐盐性。AsA是一种非酶抗氧化剂,有助ROS清除和耐盐性[29]。Ca2+信号作为第二信使,可由ROS和AsA介导的ROS平衡诱导,并参与AsA生物合成调节。乙烯对盐胁迫下ROS合成和清除的拮抗作用是由于ROS在不同发育阶段和不同组织中的作用不同[30]。另外研究发现乙烯生物合成抑制剂的应用导致了镉暴露的枸杞中GSH的低积累,并且在转基因烟草中过度表达其乙烯响应转录因子(ERF)基因增强GSH生物合成基因的表达并减少了ROS的产生,从而赋予镉耐受性[31]。GhVTC2基因的启动子中包含多个乙烯响应元件ERE,且包含有ERE的启动子显著受到外源乙烯前体的诱导表达 (图5),表明VTC2功能的发挥与乙烯之间的密切联系。VTC2与乙烯及ROS之间是否存在互作及可能的调控机制仍需要进一步的研究。
本研究克隆获得一个在纤维快速伸长发育时期优势表达的GhVTC2基因,该基因能够通过促进细胞内AsA的累积及响应乙烯信号进而促进烟草BY2悬浮细胞和拟南芥主根的伸长发育。研究结果为解析VTC2基因的功能及调控的分子机制奠定了基础。

