DRD2启动子低甲基化通过ERK通路调控乳腺癌细胞增殖
钟 明 袁 浩 钱丰源 朱红波 伍 雯 蒋晓飞 游庆华 李永平△
(1上海市浦东医院-复旦大学附属浦东医院乳腺外科,2病理科 上海 201399)
乳腺癌的治疗仍然具有挑战性[1]。部分肿瘤细胞具有较强的自我更新能力,可产生类似干细胞的异质性癌细胞[2],被定义为癌症干细胞(cancer stem cell,CSC)[3]。虽然对其表面标记物的分离和鉴定仍存在争议,但这些CSC样细胞是一种高度恶性的肿瘤细胞。实验证据表明,传统化疗药物对这些高度恶性的人类癌细胞无效[4]。因此,研究这类高度恶性癌细胞的作用机制,筛选靶向药物对乳腺癌的治疗具有重要意义[5-6]。
多巴胺受体(dopamine receptor,DR)是CSC样细胞的潜在生物标志物,表达于乳腺癌CSC样细胞而非造血干细胞。氟哌啶醇是一种DR拮抗剂,可以抑制癌症进展,但也有研究表明氟哌啶醇可显著刺激大鼠乳腺癌的生长[7]。这种矛盾的结果提示药物应该同时基于分子信号通路而不仅仅是替代的表型标记物[8]。
DRD2是DR家族中的一个亚型[9-10],其表达水平既受上游因子调控,也受启动子甲基化的调控。原发性乳腺肿瘤表现出多种异常的DNA甲基化模式,其中一些影响转录[11-12]。本研究旨在是探究DRD2甲基化水平对乳腺癌细胞增殖的影响,并通过体内外实验探索可能存在的信号通路。
材料和方法
研究对象收集2017年8月—2018年4月就诊于复旦大学附属浦东医院的7例原发浸润性乳腺癌患者的肿瘤组织和正常配对组织。纳入标准:乳腺癌患者术前未行化疗、放疗等其他治疗;术后病理证实为浸润性癌。排除标准:非浸润性乳腺癌;重要脏器功能不全;有疾病相关用药史。患者的临床特征见表1。本研究经过复旦大学附属浦东医院伦理委员会批准(批准号:QWJWXKJS-05),所有患者签署知情同意书。
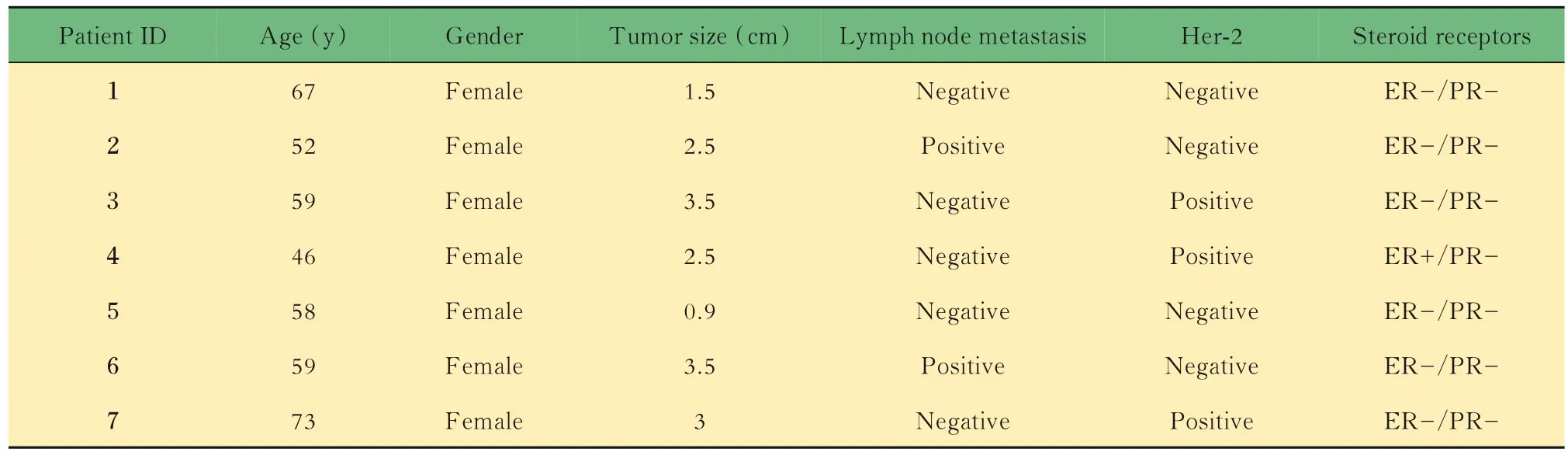
表1 入选Illumina 850K微珠芯片检测患者的临床特征Tab 1 Clinical characterizations of patients enrolled for Illumina 850K Beadchip detection
DNA甲基化实验与分析使用DNeasy血液和组织试剂盒从新鲜组织中提取DNA(德国Qiagen公司)。每个样品取500 ng DNA用EZ DNA甲基化试剂盒(美国Zymo Research公司)进行亚硫酸氢盐转化,将转化后的产品放入Illumina人类甲基化850K芯片中测序。
数据主要使用R软件和ChAMP软件包进行分析。DNA甲基化水平以每个CpG位点的β值和调整后的P值进行评估(adj.P),均采用Benjamini-Hochberg方法 计算。具 有 δ-β 的CpGs>0.20和adj.P<0.05作为差异甲基化区域CpGs(differential methylated CpGs,DMC)。
细胞培养人乳腺癌细胞系(MDA-MB231、MCF7、sk-BR3)和乳腺正常细胞(Hs 578Bst)购自中国科学院细胞库。细胞常规培养在含有10%胎牛血清的DMEM培养基和100 U/mL青霉素-链霉素溶液中,温度为37℃,浓度为5% CO2。
质粒的构建和病毒转染构建包含DRD2编码序列的慢病毒质粒(基因ID:1813),并将其转染到不表达DRD2的人乳腺癌细胞中。空白质粒载体pCDH-CMV-MCS-EF1-copGFP-T2A-Puro作为对照。对DRD2表达最多的人乳腺癌细胞进行DRD2特异性shRNA处理。以DRD2为靶点的shRNA序列(5’-3’)如下:shRNA1,GAATCTGTCCTGGTATGATGA(DRD2-homo-366);shRNA2,GCTGTACAATACGCGCTACAG(DRD2-homo-774),shRNA3,GCAAGCGAGTCAACACCAAAC(DRD2-homo-1013)。非靶标shRNA作为对照(shNC)。用聚乙烯亚胺(PEI,23966-1,美国Polysciences公司)将慢病毒包装在293T细胞中。病毒上清转染细胞,置于含5 g/mL聚胺的无血清培养基中(40804ES76,上海翊圣生物科技有限公司)。2 μg/mL嘌呤霉素(A1113802,美国Gibco公司)筛选获得稳定表达细胞。
Western blot分析在放射免疫沉淀法(RIPA)缓冲液(P0013C)中添加蛋白酶抑制剂(P1005)对细胞或组织进行裂解。分离的蛋白通过SDS-PAGE(P0015L)电泳,并电转移到聚偏二氟乙烯(PVDF)膜(IPVH00010,美国Millipore公司)。使用DRD2(SC-5303,美 国Santa公 司)、ERK(4695S,美 国CST公司)、p-ERK(4370S,美国CST公司)和αtublin(66031-1 ig,美国Proteintech公司)的抗体进行Western blot分析。
细胞增殖实验细胞增殖检测采用细胞计数试剂盒-8(CCK-8,C0038,上海碧云天生物技术有限公司)。重悬细胞密度5×104/mL,每孔接种100 μL于96孔板上。用微孔板阅读器(RT-6100,深圳雷杜生命科学股份有限公司)测定450 nm处的吸光度。
细胞体外迁移实验在细胞迁移试验中,将200 μL(5×104/mL)无血清细胞培养基(DMEM)稀释处理后的细胞加入小室的上腔(353097,美国Corning公 司),将500 μL含10%胎 牛 血 清 的DMEM加入下腔。培养48 h,PBS冲洗,4%多聚甲醛固定细胞30 min,0.1%甲酚紫染色5 min,水冲洗。用棉签除去上腔室中的细胞,利用相差显微镜对膜下的细胞进行成像。
动物模型将BALB/c-nu裸鼠(5周,雌性)分为MCF-7-NC组、MCF-7-OE组、MB231-shNC组、MB231-shRNA组 和MB231-shRNA+5-AzadC组,每组至少4只。各组小鼠左腋下乳腺脂肪垫皮下注射细胞(50~106个细胞,100 μL PBS)。两周后,MB231-shRNA+5-AzadC组腹腔注射DNA甲基化抑制剂5-aza-2-脱氧胞苷(5-aza-2-deoxycytidine,5-AzadC,5 mg/kg,A119533,上海阿拉丁生化科技股份有限公司),每周3次,连续3周。每周测量肿瘤体积,5周后处死动物。
免疫组织化学法动物模型组织标本采用4%多聚甲醛固定,石蜡包埋,切片。玻片以抗ki67(1∶1 000,27309-1-AP,美 国Proteintech公 司)和 抗CD31[1∶75,abs119772,爱必信(上海)生物科技有限公司]为主要抗体,非特异性免疫球蛋白IgGs作为阴性对照。
RNA提取和实时PCR使用Trizol试剂(美国Invitrogen公司)从培养的细胞中提取总RNA。第一链cDNA合成后,使用Hieff®qPCR SYBR Green Master Mix(Low Rox Plus)(上海翊圣生物科技有限公司)进行实时定量PCR。PCR扩增,循环参数为:95℃,5 min;95℃10 s,55℃20 s和72℃20 s,40个循环,最终在72℃下延长5 min。以β-actin为对照,用ΔΔCt方法计算基因表达量。DRD2基因的引物为5’-TCAGAGGTTCTTTGAGGGA-3’(正向)和5’-AAGGGAAACAGGAGAGAGG-3’(反向),β-actin基 因 的 引 物 为5’-CTGGAACGGTGAAG GTGACA-3’(正 向)和5’-CGGCCACATTGTGAACTTTG-3’(反向)。
统计学分析使用GraphPad Prism 8.0进行计算和绘图。Western blot、细胞增殖分析、细胞迁移分析、肿瘤重量和体积比较采用单因素方差分析法。P<0.05为差异有统计学意义。
结 果
乳腺癌DRD2启动子的低甲基化在癌组织中发 现DRD2启 动 子 区8个CpGs(包 括TSS上 游1500 nt和5个UTR)的甲基化水平与癌旁组织相比显著分化(adj.P<0.05)。所有这些DMCs在肿瘤组织 中 均 发 生 低 甲 基 化 ,δ-β 值 从-0.504 9降 至-0.242 6(图1)。

图1 乳腺癌组织DRD2启动子区(C1-C7)与癌旁组织(N1-N7)的DMCs识别Fig 1 DMCs identified in DRD2 promoter region of breast cancer tissues(C1-C7)to the paired adjacent tissues(N1-N7)
乳腺癌细胞株上调DRD2的表达采用qRTPCR和Western blot检测DRD2基因在乳腺癌细胞系MCF-7、SK-BR3和MB231中的表达水平。与正常乳腺细胞相比(Hs 578Bst),在3种乳腺癌细胞中,DRD2表达量最高的是MB231细胞,而DRD2在MCF-7细胞中的表达未见明显升高(图2A、B)。用MCF-7构建稳定的DRD2过表达细胞,用MB231构建稳定的DRD2下调细胞。
从MCF-7细胞中构建过表达DRD2的稳定克隆(图2C、D)。用3种不同的DRD2 shRNAs转染MB231细 胞,其中shRNA2对DRD2表 达的 下 调 作用最显著。最后,利用DRD2 shRNA2建立了稳定的DRD2下调的克隆(图2E、F)。

图2 DRD2在乳腺癌细胞中的表达水平Fig 2 Expression levels of DRD2 in breast cancer cells
DRD2促进乳腺癌细胞的增殖和迁移分别用CCK-8和迁徙实验检测细胞的增殖和迁移能力。
甲基化抑制剂5-AzadC的最佳浓度为10 μmol/L(图3A),用于CCK-8试验。DRD2过表达的MCF-7细胞的增殖率和迁移率均显著高于正常MCF-7细胞(图3 B-D)。同时,DRD2下调的MB231细胞的增殖率和迁移率均明显低于正常MB231细胞(图3E-G)。我们观察到5-AzadC可以部分逆转DRD2下调对乳腺癌细胞增殖和迁移的抑制作用(图3E、G)。

图3 DRD2促进乳腺癌细胞的增殖和迁移Fig 3 DRD2 promotes proliferation and migration of breast cancer cells
DRD2在体外调节ERK磷酸化水平Western blot法检测DRD2过表达或低表达对ERK磷酸化水平(p-ERK)的影响。我们发现p-ERK的表达水平与DRD2的表达水平同步变化(图4)。甲基化抑制剂(5-AzadC)可以部分逆转DRD2下调引起p-ERK的抑制(图4F-H)。

图4 DRD2通过ERK信号通路促进肿瘤发生Fig 4 DRD2 promotes cancer through ERK signaling pathway
DRD2在体内调控乳腺癌进展通过体内分析发现,DRD2过表达促进了小鼠模型肿瘤组织的生长,并促进了Ki67和CD31的表达(图5A~C)。同样,下调DRD2的表达抑制了肿瘤的生长,也抑制了小鼠模型肿瘤组织中Ki67和CD31的表达;腹腔注射5-AzadC可部分逆转DRD2下调引起的肿瘤生长抑制(图5D-F)。
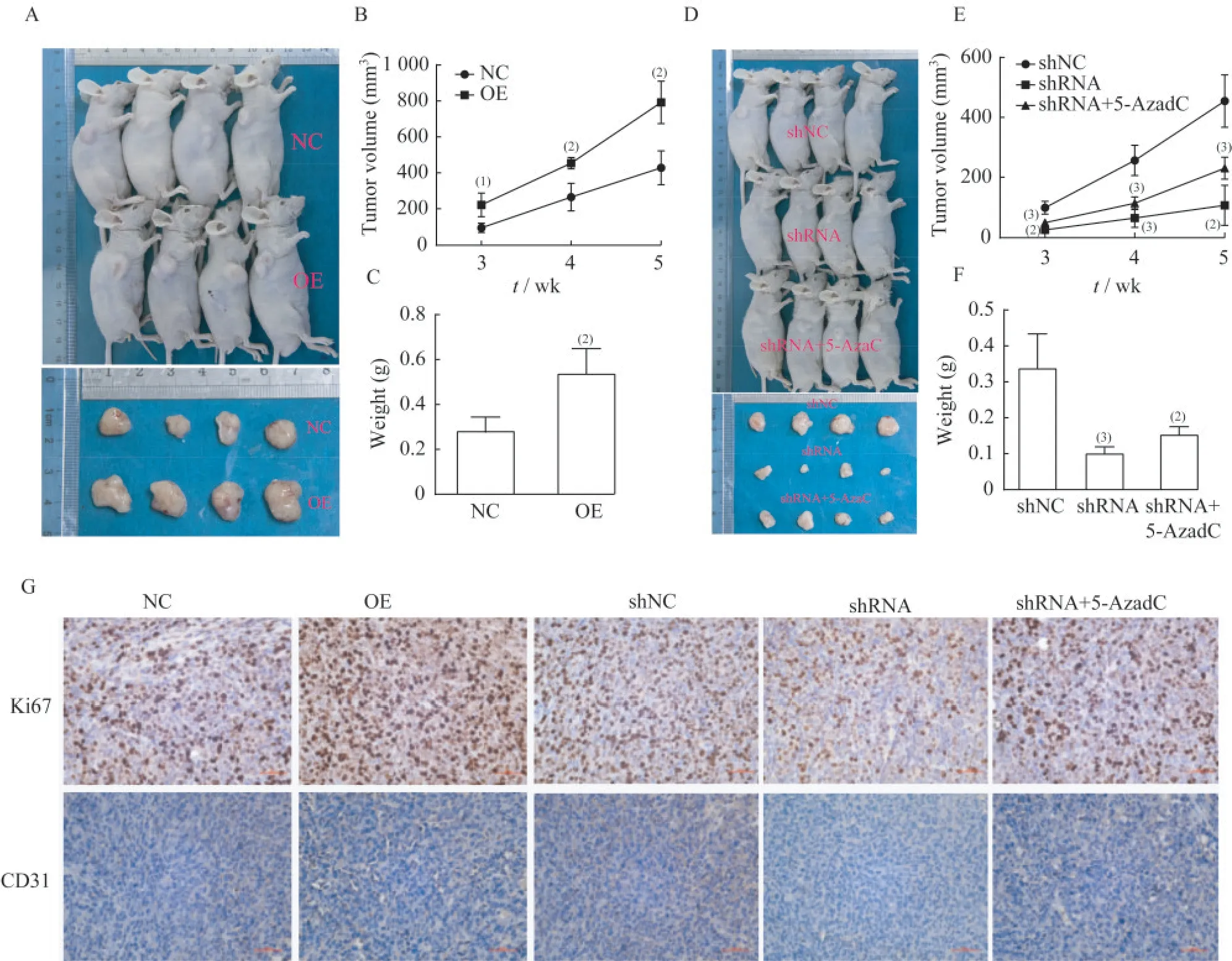
图5 DRD2在小鼠体内的表达调控肿瘤的生长Fig 5 Expression of DRD2 in mice regulated tumor growth
从皮下肿瘤组织中提取蛋白,检测ERK信号通路中蛋白的表达,结果与体外实验相似,DRD2和p-ERK的表达水平也呈现相同的趋势(图6)。添加甲基化抑制剂(5-AzadC)部分逆转了DRD2表达下调的抑制作用(图6C、D)。

图6 DRD2在小鼠体内通过ERK信号通路促进肿瘤发生Fig 6 DRD2 promotes cancer through ERK signaling pathway in mice
讨 论
DRD2在多种癌症中均有上调,其拮抗剂在细胞培养和动物模型中均有抗癌作用[8,13]。本研究发现,上调DRD2的表达可以提高肿瘤细胞的增殖能力和侵袭能力,而下调DRD2的表达具有抑制作用。体外实验也表明DRD2过表达促进了肿瘤组织的生长及Ki67和CD31的表达,提示DRD2在促进肿瘤细胞增殖和迁移中起到了一定的作用,DRD2是乳腺癌潜在的驱动基因。此前有报道称DRD2与多种信号通路相关(如ERK通路),而ERK通路对癌症至关重要[13-14]。本研究表明DRD2在ERK信号通路中发挥作用,这意味着DRD2配体可能是一种新的癌症治疗方向。
基因表达水平还受基因启动子甲基化状态的影 响[15]。 有 研 究 表 明 ,DNA甲 基 转 移 酶1(DNA methyltransferase 1,DNMT1)在乳腺肿瘤中表达上调,缺失DNMT1对小鼠乳腺肿瘤具有保护作用[16]。本研究发现,乳腺癌组织中DRD2启动子发生低甲基化,可能导致DRD2基因表达增加。体内和体外的实验表明,5-AzadC可以部分逆转DRD2敲减对细胞增殖和迁移的抑制作用。因此,在治疗DRD2过表达乳腺癌的过程中,除了直接针对靶向基因表达外,我们还可以通过调控癌细胞的DNA甲基化状态来实现。
DRD2同样受上游通路影响,比如DRD2的表达水平可能受到肌动蛋白结合蛋白丝蛋白A(filamin A,FLNA)的调控[17]。最初认为FLNA是与乳腺癌发展有关的致癌蛋白[18],FLNA可能通过FLNA-DRD2-ERK信 号 通 路 促 进 肿 瘤 的 发 生[17]。因此,FLNA促进乳腺癌发展是否与DNA甲基化相关,是否存在潜在靶向DRD2或ERK通路,值得今后进一步探索。本研究样本量较少,发现在三阴性和Her-2阳性乳腺癌中,DRD2启动子去甲基化更加明显。后期可以通过大样本量来细分不同分子亚型的甲基化模式对乳腺癌增值和迁徙的影响。
综上所述,研究发现DRD2通过ERK信号通路参与乳腺癌细胞的增殖和迁移。除了之前报道的上游因子外,DRD2的表达水平还取决于其启动子区的甲基化水平。我们的研究结果提示,治疗不但要关注DRD2的抑制或激活,更应该将DRD2启动子的甲基化状态及其在ERK信号通路中的作用作为重要考量的因素。
作者贡献声明钟明,袁浩 实验设计和执行,数据采集和分析,论文撰写和修订。钱丰源,伍雯,蒋晓飞 数据采集和分析,可行性分析。朱红波,游庆华 实验设计,图表绘制。李永平 研究指导,论文修正。
利益冲突声明所有作者均声明不存在利益冲突。

