屠宰场沙门氏菌耐药性分析和毒力基因检测
靳浩展,李 亮,魏琦麟,韩依辛,徐志宏,康桦华,向 蓉,4
(1.广东省农业科学院动物卫生研究所,广东省畜禽疫病防治研究重点实验室,农业农村部兽用药物 与诊断技术广东科学观测实验站,广州 510640;2.佛山科学技术学院,佛山 528231;3.广东省农业 技术推广中心,广州 510520;4.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000)
沙门氏菌(Salmonella)是一种全球危害严重的食源性致病菌[1],目前已经有2 600多种血清型被确认,其主要通过污染肉、蛋、奶等食物和水源传染给人类,通过毒力岛等机制对机体造成损害进而导致胃肠炎、副伤寒和伤寒等疾病[2-6],严重危害人类的生命健康安全。据统计,全球超过1亿人感染沙门氏菌,在国际公共卫生安全问题中占前两位,美国每年感染沙门氏菌的人数超过100万,欧洲沙门氏菌引起的疾病在食源性疾病中约占1/3,而中国细菌性疾病中由沙门氏菌引起的占70%以上[7-9]。在过去的几十年中,由于抗生素在养殖业中的过度使用,沙门氏菌的耐药情况越来越严重[10],且多重耐药情况已经普遍存在。屠宰场是从养殖到餐桌的关键环节,在屠宰过程中最易受到沙门氏菌的污染,而生猪及其制品是其主要的污染对象之一[11-12]。在屠宰过程中,猪胴体容易被肠道中的沙门氏菌污染,沙门氏菌随着污染的猪肉及其制品传给人类,同时也可能将其耐药性带给人类[13-14],导致人类利用抗生素治疗细菌病收效甚微甚至无效,对人类生命健康造成严重的威胁。本研究通过对广东省茂名地区生猪屠宰场猪肉中沙门氏菌的耐药性、耐药基因和毒力基因的携带情况进行检测,分析该地区屠宰场猪肉中沙门氏菌的耐药表型以及耐药基因、毒力基因的流行情况,以期为该地区沙门氏菌的危害评估和防控措施制定提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2020―2021年从广东省茂名地区生猪屠宰场屠宰过程中的猪肉、肝脏和脾脏等250份样本中分离鉴定的19株沙门氏菌,由广东省农业科学院动物卫生研究所兽药研究室保存。
1.1.2 主要试剂 DHL培养基、LB肉汤、MH肉汤、MH琼脂培养基均购自广东环凯微生物科技有限公司;甘油、琼脂糖、TAE缓冲液、2×TaqPCR MasterMix、DL2000 DNA Marker、Gene Red核酸染料均购自广州顺锋生物科技有限公司;β-内酰胺类(头孢氨苄(CL)、头孢哌酮(CFP))、氟喹诺酮类(氧氟沙星(OFL)、环丙沙星(CIP)、恩诺沙星(ENR))、氨基糖苷类(庆大霉素(GEN)、阿米卡星(AK)、大观霉素(SPT))、四环素类(四环素(TET)、多西环素(DC))、酰胺醇类(氯霉素(CMP)、氟苯尼考(FFC))和磺胺类(复方新诺明(SXT)、磺胺异噁唑(SIZ))共14种抗菌药物药敏纸片均购自杭州微生物试剂有限公司。
1.2 引物设计及合成
参考相关文献[15-20]合成17种耐药基因引物(表1)和10种毒力基因引物(表2),引物均由生工生物工程(上海)股份有限公司完成。

表1 17种耐药基因检测引物Table 1 Detection primers of 17 resistance genes

表2 10种毒力基因检测引物Table 2 Detection primers of 10 virulence genes
1.3 菌株复苏
将冻存的19株沙门氏菌进行编号(SE-1~SE-19),分别在DHL培养基上四区划线,置于37 ℃恒温培养箱培养24 h,挑取有单个圆形、光滑和中心黑色或全部黑色或粉红色的不透明菌落接种于LB营养肉汤,37 ℃恒温摇床培养24 h,连续传代3次。
1.4 药物敏感性试验
采用K-B纸片法对19株沙门氏菌进行14种抗菌药物的药物敏感性试验,具体操作步骤和结果判定参照美国临床和实验室标准协会(CLSI)[21]药物敏感性试验标准执行。
1.5 菌株DNA提取
参考钟巧贤等[22],利用煮沸法提取19株沙门氏菌的总DNA。取培养好的菌液3 mL,8 000 r/min离心10 min收集沉淀;加入200 μL ddH2O重悬,煮沸10 min;急冻10 min,10 000 r/min离心10 min收集上清即得到总DNA。
1.6 PCR检测
以提取的沙门氏菌总DNA为模板,PCR检测19株沙门氏菌对17种耐药基因和10种毒力基因的携带情况。PCR反应体系25 μL:2×TaqPCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR反应程序:95 ℃预变性10 min;95 ℃变性30 s,退火(退火温度见表1、2)40 s,72 ℃延伸40 s,共35个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,将疑似阳性菌株的PCR产物送生工生物工程(上海)股份有限公司测序,测序结果在NCBI数据库中进行BLAST比对。
2 结 果
2.1 药物敏感性试验
19株沙门氏菌对14种抗菌药物存在不同程度的耐药,其中对四环素、多西环素、氯霉素、氟苯尼考和磺胺异噁唑的耐药率均>50%,耐药率最高为四环素、多西环素和氯霉素,耐药率均为89.5%,最低为阿米卡星,耐药率为0;按照药物类型,四环素类药物和酰胺醇类氯霉素的耐药率较高,在80%以上,而氨基糖苷类和氟喹诺酮类药物的耐药率较低,均在10%左右(表3)。对沙门氏菌耐药谱分析发现,最低对0种抗菌药物耐药,最高对11种抗菌药物耐药,多重耐药率在90%左右,对5种及以上药物耐药率>50%(表4)。19株沙门氏菌共有12种耐药谱型,其中4耐(4株)、6耐(4株)分别有3、2种耐药谱型,3耐(3株)和5耐(2株)只有1个耐药谱型,7耐(2株)耐药谱型各不相同(表4)。说明该地区屠宰场猪肉中沙门氏菌的多重耐药情况严重,且具有复杂的耐药谱型。

表3 19株沙门氏菌的药物敏感性试验结果Table 3 Drug susceptibility test results of 19 Salmonella strains %
2.2 沙门氏菌的耐药基因检测结果
17种耐药基因检测统计结果显示,除blaSHV、qnrB、rmtB3种耐药基因未检出外,其他14种耐药基因均有检出,其中blaTEM耐药基因检出率最高为84.2%,其余耐药基因的检出率在15.8%~73.7%之间,有8种耐药基因的检出率>50%(图1)。blaTEM耐药基因PCR检测结果见图2。对沙门氏菌耐药基因共存情况分析发现,沙门氏菌最低携带2种耐药基因,最高携带12种耐药基因,其中携带7个及以上耐药基因的沙门氏菌>50%;19株沙门氏菌具有16种耐药基因组合类型,除了携带2、4、8种耐药基因的沙门氏菌外,其余沙门氏菌的耐药基因组合类型均不相同(表5)。表明该地区屠宰场猪肉中沙门氏菌携带多个耐药基因,且具有复杂的耐药基因组合类型。

1~19,19株沙门氏菌blaTEM基因PCR产物;M,DL2000 DNA Marker;20,阴性对照 1-19,PCR products of blaTEM gene of 19 Salmonella strains;M,DL2000 DNA Marker;20,Negative control图2 blaTEM耐药基因PCR检测结果Fig.2 PCR detection results of blaTEM resistance gene

表5 19株沙门氏菌携带耐药基因谱Table 5 Resistance gene profiles of 19 Salmonella strains
2.3 沙门氏菌的毒力基因检测结果
10种毒力基因PCR检测结果显示,mogA、mgtC、bcfA、araB基因都有检出,其余6种毒力基因均未检出,其中mogA基因的检出率最高(100%),其次是mgtC和bcfA基因,检出率均为89.5%,araB基因的检出率为73.7%(图3)。mogA毒力基因PCR检测结果见图4。对沙门氏菌毒力基因共存情况分析发现,mogA、mgtC、bcfA和araB4种毒力基因同时被检出的菌株数最多,占73.7%(14/19)(表6)。说明该地区屠宰场猪肉中沙门氏菌主要携带mogA、mgtC、bcfA和araB4种毒力基因。
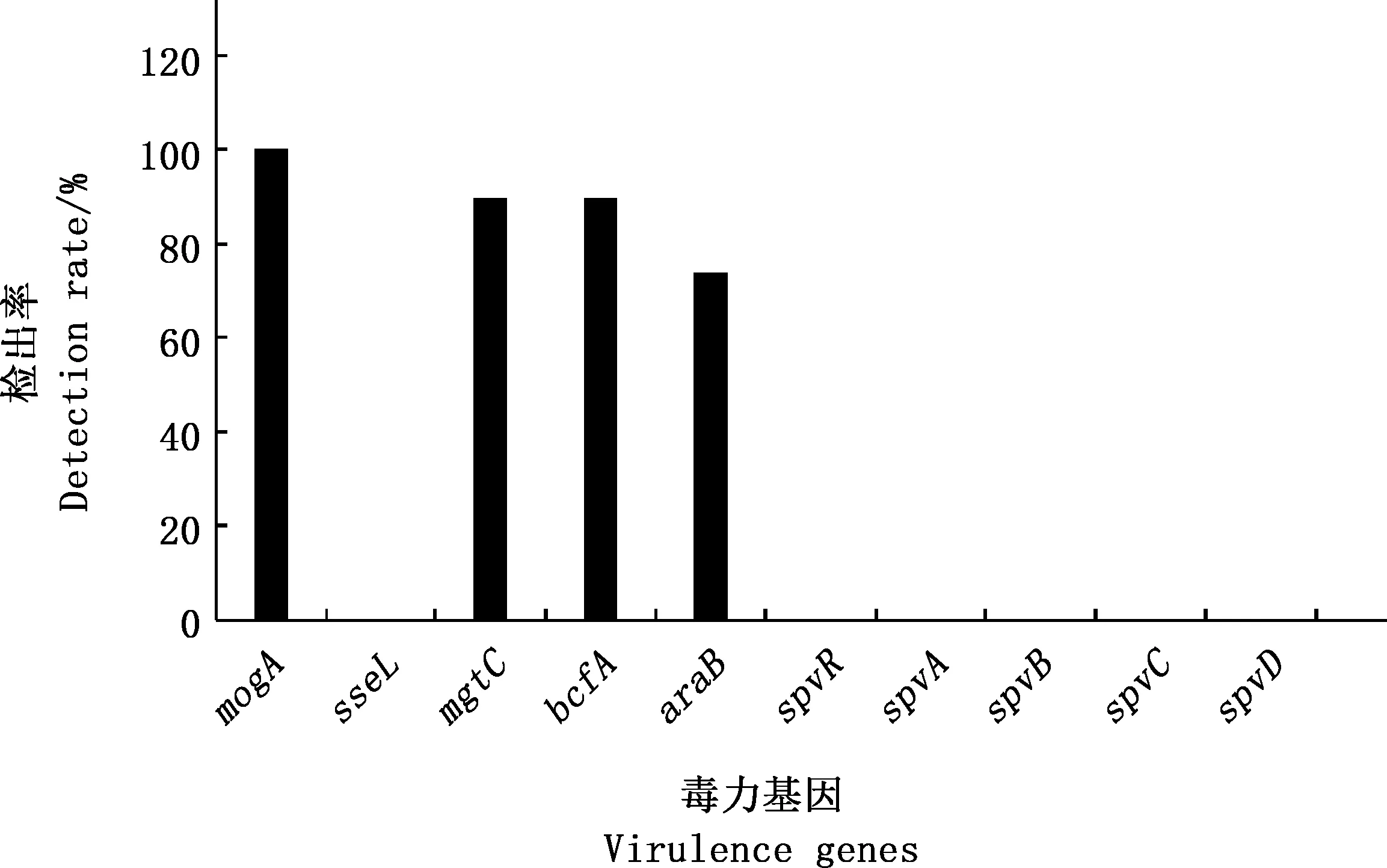
图3 10种毒力基因在19株沙门氏菌中的检出率Fig.3 Detection rate of 10 virulence genes in 19 Salmonella strains

1~19,19株菌mogA基因PCR产物;M,DL2000 DNA Marker;20,阴性对照 1-19,PCR products of mogA gene of 19 Salmonella strains;M,DL2000 DNA Marker;20,Negative control图4 mogA毒力基因PCR检测结果Fig.4 PCR detection results of mogA virulence gene

表6 19株沙门氏菌携带毒力基因谱Table 6 Virulence gene profiles of 19 Salmonella strains
3 讨 论
屠宰作为衔接生猪养殖和肉品加工的中间环节,对其安全监管是保证肉品质量安全的第一防线。屠宰环节的微生物及其耐药性分析,不仅可为下游食品安全提供保障,而且能为上游养殖环节的抗菌药物合理应用提供依据。随着国家对生猪屠宰标准化的要求越来越高,对屠宰环节的微生物监测也越来越规范。吴荔琴等[14]对2014―2016年从广州生猪屠宰场猪盲肠分离的沙门氏菌进行耐药性调查,发现对四环素(80.13%)、多西环素(77.48%)、磺胺异噁唑(71.52%)、氨苄西林(62.25%)和大观霉素(60.93%)的耐药率较高,但对氟苯尼考(37.75%)的耐药率较低。贺恒旭等[12]从河南部分地区不同规模的生猪屠宰企业猪不同部位分离的沙门氏菌主要对多西环素(95.02%)、氨苄西林(85.06%)、新霉素(79.67%)、氟苯尼考(73.44%)和四环素(72.61%)耐药率较高。本研究中,19株沙门氏菌对6种抗菌药物的耐药率>50%,主要集中在对四环素类、酰胺醇类和磺胺类这3类抗菌药,其中对四环素(89.5%)、多西环素(89.5%)和氯霉素(89.5%)的耐药率最高,与吴荔琴等[14]检测结果类似,但对氨基糖苷类、β-内酰胺类及磺胺类抗菌药耐药情况略有差异;与贺恒旭等[12]检测结果相比,虽然都对四环素类耐药率较高,但对氟苯尼考耐药率偏低,可能与不同屠宰场生猪来源不同有关,但多重耐药情况普遍严重。
blaTEM基因是产超广谱β-内酰胺酶革兰阴性杆菌常携带的耐药基因,菌株通过基因表达合成β-内酰胺酶使该类药物失活,进而达到耐药的目的[23]。本研究中,blaTEM基因的检出率最高(84.2%),但分离株对β-内酰胺类抗生素的耐药率低于40%;aadA1和aac(6′)-Ⅰb基因的检出率次之(73.7%、68.4%),但对氨基糖苷类抗生素的耐药率低于15%;四环素类耐药率最高,但四环素类耐药基因少有检出;氟喹诺酮类部分耐药基因较高,但氟喹诺酮类药物耐药率较低;酰胺醇类、磺胺类耐药基因的检出率和相应药物耐药率具有一致性,可能具有一定的联系。本研究中耐药基因和耐药表型之间并不完全一致,可能是该类耐药基因呈隐性存在不表达[24];也可能是该类耐药基因表达产物失去了活性[25];还有可能是该菌株的耐药机制极其复杂受多种基因共同调控。由此可知,本研究沙门氏菌携带多种耐药基因,与其耐药表型之间存在着复杂的关系。
沙门氏菌的致病力由多种毒力因子相互作用共同产生[20],其中毒力岛(SPI)是染色体中含有大量与毒力相关基因的区域,mogA是SPI1中与侵袭相关的毒力基因[2],mgtC是SPI3中编码高亲和力镁转运系统(MgtS)的毒力基因,MgtS是沙门氏菌生存所必需的毒力因子,提供遗传代谢过程中Mg2+的转运[26],bcfA是SPI4核心蛋白基因,与菌毛的形成有关[27]。王鑫盛[28]对河南和陕西不同地区生猪屠宰场沙门氏菌毒力基因检测发现,mogA(100%)、sseL(100%)、bcfA(100%)、mgtC(99.3%)、araB(93.5%)基因的检出率较高。黄秀梅等[29]对山东不同地区生猪屠宰场沙门氏菌毒力基因调查发现,mgtC(100%)、bcfA(100%)、mogA(97.99%)、araB(97.99%)、sseL(67.11%)基因的检出率较高,spvR、spvA、spvB、spvC、spvD基因的检出率均低于3%。本研究中,19株沙门氏菌对mogA、mgtC、bcfA和araB4种毒力岛基因的检出率都在70%以上,其中对mogA基因的检出率高达100%,与王鑫盛[28]和黄秀梅等[29]的检测结果类似,但sseL基因检出率偏低,说明不同地区这4种毒力基因在沙门氏菌中携带率高,存在一定的风险。
4 结 论
19株沙门氏菌分离株多重耐药现象严重,对四环素、多西环素和氯霉素高度耐药,携带多种耐药基因和毒力基因,其中blaTEM、aadA1和aac(6′)-Ⅰb3种耐药基因携带率高,但与其耐药表型不完全一致,且具有复杂的耐药机制,mogA、mgtC、bcfA和araB4种毒力基因携带率高。本研究结果为广东省茂名地区沙门氏菌的监测和防治提供了数据支持。

