血小板与淋巴细胞比值在急性前壁心肌梗死后左室血栓形成中的临床价值
刘泽宇冯应君刘宣宣
1.广东省粤北人民医院物理诊断科,广东韶关 512026;2.广东省粤北人民医院心血管内科,广东韶关 512026
近年来,随着区域间胸痛中心的建设,介入诊疗技术、介入器械的发展,急性心肌梗死(acute myocardial infarction,AMI)患者得到了很大程度的救治。AMI早期实施再灌注治疗,使得其并发症逐渐下降。然而,在临床工作中笔者发现,即使进行了缺血再灌注治疗,左室血栓(left ventricular thrombus,LVT)的发生率仍然较高,特别是前壁心肌梗死患者,若血栓脱落可造成严重并发症,影响患者的预后,然而现有的生物标志物尚不能很好地预测LVT的发生。在AMI早期,预判是否会形成血栓,对于患者的治疗及预后有重要价值。因此,探究预测发生LVT的生物标志物,对于早期治疗具有重要意义。据报道,血小板与淋巴细胞比值(platelet/lymphocyte ratio,PLR)可以在一定程度上预测LVT发生,且临床工作中廉价易得,目前国内研究较少,故本研究拟探讨PLR在急性前壁心肌梗死后预测LVT的发生价值,进而指导临床治疗。
1 资料与方法
1.1 一般资料
回顾性选取2017年1月至2021年7月于粤北人民医院明确诊断为急性前壁心肌梗死的131例患者作为研究对象,根据是否发生LVT分为血栓组32例,对照组99例。纳入标准:符合第四版全球心肌梗死制定的诊断标准[血清心肌标志物(主要是肌钙蛋白)升高(至少超过99%参考值上限),心脏彩超或者超声造影提示LVT形成,并符合下列条件中的至少1项。①有缺血症状;②新出现ST段显著抬高或T波改变、新出现左束支传导阻滞;③心电图新出现病理性Q波;④影像学证据支持新的室壁节段运动不良;⑤冠脉造影发现冠状动脉内血栓]。排除标准:①拒绝介入治疗;②房颤患者需要口服利伐沙班或者华法林抗凝;③介入术后需要机械辅助装置;④心源性休克或恶性心律失常;⑥合并血液系统疾病;⑦发热、严重肝肾功能不全。本研究经粤北人民医院医学伦理委员会批准(批件号:KY-2022-012),研究对象均知情同意。
1.2 方法
收集患者的一般临床资料,包括性别、年龄、吸烟史、室壁瘤;收集患者实验室检查指标,包括白细胞计数(white blood cells,WBC)、血小板计数(platelet,PLT)、中性粒细胞计数(neutrophils,NEU)、淋巴细胞计数(lymphocyte,LYM)、单核细胞(monocytes,MYO)、血肌酐(creatinine,Cr)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、白蛋白(albumin,Alb)、左室射血分数(left ventricular ejection fraction,LVEF)、纤维蛋白原,并计算PLR。
1.3 观察指标及评价标准
观察患者入院时生化和凝血四项指标,并在AMI 5 d内行超声心动图评估或者心脏声学造影检查。根据美国超声心动图学会指南的推荐,Simpson方法用于评估二维超声心动图心尖四腔心切面中的LVEF。所有图像均已存档,并由对每位患者的数据不知情的彩超专家进行评估。
1.4 统计学方法

2 结果
2.1 急性前壁心肌梗死后影响LVT形成的单因素分析
血栓组室壁瘤比例、PLT、NEU、PLR高于对照组,LVEF低于对照组,差异有统计学意义(P<0.05);两组患者年龄、性别、吸烟比例及WBC、MYO、纤维蛋白原、Alb、Cr、TG、TC比较,差异无统计学意义(P>0.05)(表1)。
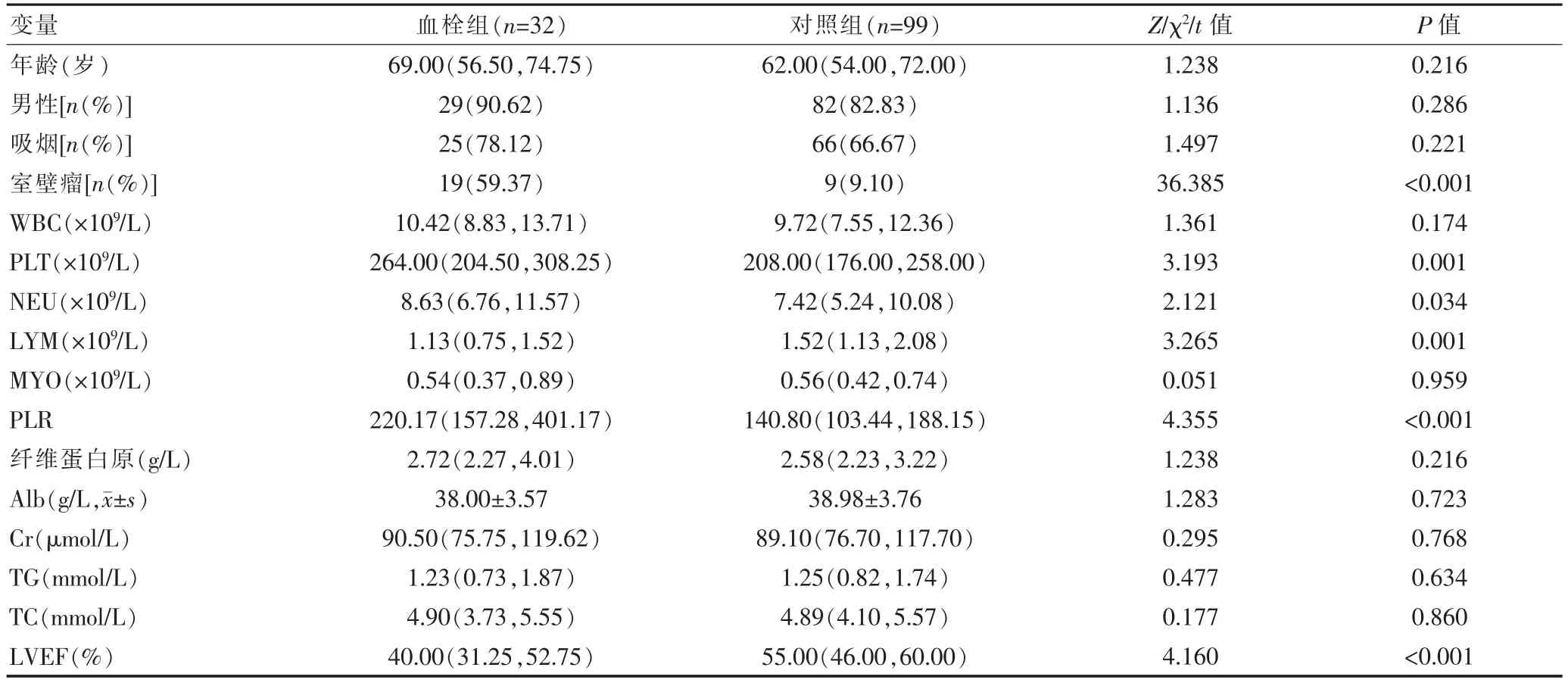
表1 急性前壁心肌梗死后影响LVT发生的单因素分析[M(P25,P75)]
2.2 急性前壁心肌梗死后影响LVT发生的多因素logistic回归分析
将发生LVT作为因变量,PLR、LVEF、室壁瘤比例作为自变量,纳入logistic回归模型分析(赋值情况见表2),结果显示,PLR升高、室壁瘤形成是LVT发生的独立危险因素,LVEF升高是LVT发生的保护因素(P<0.05)(表3)。
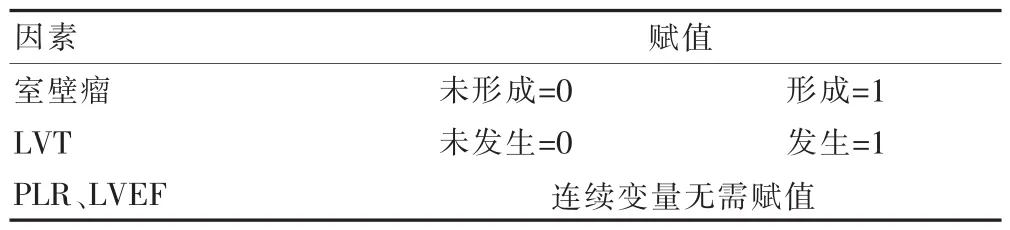
表2 变量赋值情况
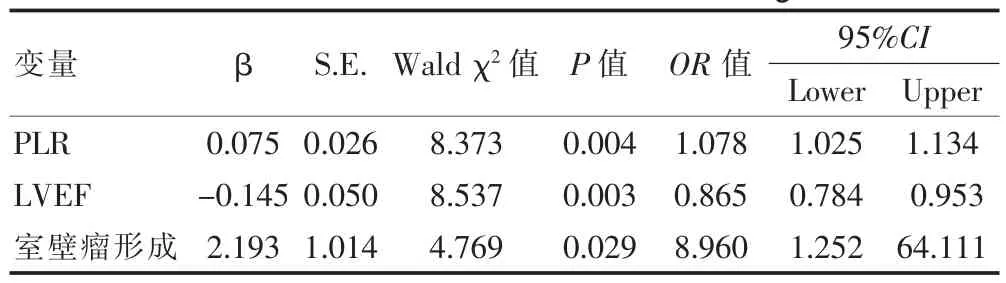
表3 急性前壁心肌梗死后影响LVT发生的多因素logistic回归分析
2.3 不同水平PLR患者的LVT发生率情况
根据所入选患者的PLR四分位数间距水平进行分组(Q1~Q4),分为Q1组(PLR<108.2474)、Q2组(108.2474≤PLR<156.3636)、Q3组(156.3636≤PLR<221.2389)、Q4组(PLR≥221.2389)进行趋势性检验。从Q1到Q4组,LVT发生率逐步增加,分别为3.1%、21.9%、28.1%、46.9%,差异有统计学意义(χ=18.086,P<0.05)。
2.4 PLR预测LVT的ROC曲线
曲线下面积(area under curve,AUC)为0.756 (95%CI=0.661~0.852,P<0.001),最佳截点为215.35,其灵敏度为0.563,特异度为0.818(图1)。

图1 PLR预测LVT的ROC曲线
3 讨论
目前对LVT形成的认识,包括AMI后室壁节段性运动异常、血液高凝、心肌细胞受损、内皮功能障碍,这些变化均导致了LVT的形成。在本研究中,随着PLR的升高,LVT发生率随之增加。在接受直接PCI治疗的患者中,室壁瘤形成、PLR升高是LVT形成的独立危险因素,LVEF升高是LVT形成的保护性因素(P<0.05)。在ROC曲线分析中,PLR的AUC为0.756,表明它是预测高危人群LVT形成的有前景的指标。
尽管再灌注技术在AMI早期已得到推广,但LVT形成的发生率仍然很高,DE-CMR被认为是评估血栓形成的金标准,超声心动图可能会忽略一部分血栓患者。在当今PCI时代,LVT与栓塞事件和长期死亡率的风险增加相关,AMI后LVT会使栓塞风险增加4倍,远期死亡率增加了2倍。目前已有的研究表明,梗死部位、室壁瘤形成、LVEF下降、缺血再灌注时间延长是影响LVT形成的危险因素。笔者希望找到一种生物标志物,在早期可以帮助预测LVT形成,以期指导临床治疗。
在多因素logistic回归分析中发现,LVEF下降是发生LVT的危险因素,考虑可能由于AMI患者坏死心肌组织扩张变薄,心肌细胞收缩功能减退,从而导致心衰的发生,入院时低LVEF更易形成LVT。同时坏死的心肌组织被纤维瘢痕组织替代,心肌收缩时此区域呈矛盾运动,局部血流淤滞,导致血栓的形成,已有文献报道室壁瘤形成是LVT发生的独立危险因素。
PLR是一种新兴且廉价易得的全身炎症性标志物,与炎症和血栓形成的病理生理机制有关。血小板参与凝血反应并传递炎症介质,促进炎症反应的发展及维持,血小板水平的升高,同时还伴有功能的亢进,中性粒细胞的激活,释放过氧化物酶、弹性蛋白酶,促进血小板黏附聚集。其中,急性ST段抬高型心肌梗死(acute ST-segment elevation myocardial infarction,STEMI)后NEU浸润到心肌梗死区,产生蛋白水解酶并氧化损伤血管内皮细胞,导致血液高凝状态,同时心肌梗死后的应激反应使得皮质醇激素分泌增加,导致LYM数量减少。LYM是动脉粥样硬化过程中慢性炎症的重要组成部分,具有抑制炎症反应的作用,其减少不仅与炎症反应增加有关,同时促进斑块生成、破裂,增加STEMI严重程度。另有报道,血常规中较高的PLT和较低的血红蛋白计数与心血管结局有关,高PLR和脑钠肽(brain natriuretic peptide,BNP)是AMI患者心肌再灌注不足的独立危险因素;在接受直接PCI的AMI患者中,较高的PLR与晚期心力衰竭和院内心血管危险事件相关。
现在有更多的证据表明,高PLR与血栓性疾病之间确实存在一定的关系。值得注意的是,Zuo等研究发现PLR是非瓣膜性心房颤动血栓形成的预测标志物,高PLR会增加脑静脉血栓形成的风险。深静脉血栓患者中,PLR与血栓位置、严重程度相关,在风湿性心脏病、二尖瓣狭窄的患者,较高的PLR与左房血栓的存在独立相关。另有研究显示,PLR是急性肠系膜动脉栓塞和血栓形成预后的有效预测因子;另有一项急性肺栓塞的研究结果显示,PLR是院内不良事件和长期全因死亡率的重要预测因子。
综上所述,在前壁心肌梗死患者中,室壁瘤形成、PLR升高与LVT的发生相关,并且是LVT形成的独立危险因素,而LVEF升高是LVT形成的保护性因素。在未来PLR可作为临床实践中判断LVT发生风险的指标,监测患者PLR水平,以期指导临床治疗方式选择。

