1,25-二羟维生素D3通过上调Nrf2表达抑制内质网应激改善小鼠中性粒细胞性哮喘的研究
韦丽莹 张景鸿
广西医科大学第二附属医院急诊科(南宁 530007)
支气管哮喘是常见的呼吸道慢性疾病,以气道炎症和气道高反应性为特征,临床表现复杂。哮喘是一种的异质性疾病,具有不同的临床和分子表型(phenotype)。根据气道炎症浸润细胞类型的不同,分嗜酸粒细胞哮喘、中性粒细胞哮喘(neutrophilic asthma,NA)、混合细胞哮喘及寡细胞哮喘4 种类型[1]。中性粒细胞性哮喘是非嗜酸性粒细胞性哮喘中最主要的类型,对糖皮质激素治疗不敏感,需要进一步探索其机制并寻找针对性的治疗方案。目前研究表明中性粒细胞性哮喘的发生与Th17 细胞、NLRP3 炎性小体(inflammasome named nod-like receptor family pyrin domain containing-3)的激活、中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)等关系密切。内质网应激(endoplasmic reticulum stress,ERS)诱导的NLRP3 炎性小体活化是众多炎症性疾病的病理生理基础,其对于重症哮喘的诱导和维持起着关键作用。
维生素D3 是体内调节钙磷代谢的脂溶性维生素,并发现其具有免疫调节作用。维生素D 缺乏与哮喘发作和严重程度之间具有相关性[2],实验也发现血清维生素D3 浓度降低和肥胖哮喘的症状表现相关,和NLRP3 的活性也有相关性[3]。许多研究观察了1,25-二羟维生素D3 在哮喘模型中减轻气道炎症、气道重塑和气道高反应性的作用;维生素D3 可通过激活Nrf2/HO-1 途径,抑制TGF-β/Smad 信号传导改善哮喘气道重塑[4]。核因子E2 相关因子(nuclear factor erythroid-2 related factor 2,Nrf2)是细胞内的一种关键转录因子,参与机体抗氧化应激和炎性组织损伤。氧化应激产生的活性氧(ROS)是炎症反应的重要介质,可引起未折叠/错误折叠蛋白质的积聚,加重ERS 状态。维生素D3 是否通过上调Nrf2 表达而抑制内质网应激,改善中性粒细胞哮喘的气道炎症,尚需进一步探究明确。本研究通过制作中性粒细胞性哮喘小鼠模型,使用1,25-二羟维生素D3[1,25(OH)2D3]进行干预,观察Nrf2 表达,内质网应激相关蛋白表达、ROS 生成、炎性细胞因子分泌及哮喘气道炎症表现,探讨1,25(OH)2D3治疗中性粒细胞性哮喘的效果及对内质网应激的影响。
1 材料与方法
1.1 主要仪器与试剂 鸡卵清蛋白(OVA,Grade V,美国Sigma 公司,# A5503),小鼠IL-4、IL-17、IL-5、CXCL2、CXCL8 酶联免疫吸附法(ELISA)检测试剂盒(美国R&D 公司,#M4000B,#M5000,#M1700,#MM200,#D8000C),苏木素-伊红染液试剂盒(江苏凯基生物技术股份有限公司KGA224),瑞氏染色液,小鼠抗Ly6G 抗体(美国Thermo Fisher scientific公司,thermo 14-5931-82),Western blot 检测试剂盒(江苏凯基生物技术股份有限公司,# KGP1201),Anti-GAPDH(江苏凯基生物技术股份有限公司,#KGAA002)、Anti-Nrf2、Anti- CHOP、Anti- GRP78 抗体(美国Cell Signaling Technology 公司,# 12721S,#5554S,# 3177S);TRIzol 总RNA 提取试剂盒(Invitrogen 公司);逆转录试剂盒、SYBR Green 核酸染料、PCR 引物设计合成(TaKaRa 公司)。多功能酶标仪(美国MD Spectramac M3),电泳仪(美国Bio-Rad Power Supplies Basic),Trans-Blot Turbo 全能型蛋白转印系统(美国Bio-Rad 170-4150),凝胶成像系统(英国SYNGENE G,BOXChemiXR5),病理图像分析系统(德国Leica 公司),5810R 高速低温离心机(德国Eppendorf 5810R),超声雾化器及自制雾化吸入箱等。
1.2 实验动物和分组 Balb/c 雌性小鼠购于广西医科大学实验动物中心,许可证号:SCXK(桂)2020-0003。无特定病原体(SPF)级,鼠龄6 周,体重18 ~22 g,饲养于SPF 屏障系统内,温度:(22 ±2)℃,相对湿度60% ~70%,保证通风,自由进食及饮水,动物实验方案严格按照广西医科大学动物伦理委员会规范执行,经伦理委员会审核通过,伦理审查件批号:2018-KY-国基-111。将24 只小鼠按随机数字表法分为3 组,每组8 只,分别为正常对照组(A)、中性粒细胞性哮喘模型组(B)、1,25(OH)2D3治疗组(C)。参照文献[5]及预实验的方法,B 组和C 组采用CFA+OVA(完全弗氏佐剂+鸡卵清蛋白)诱导的方法制作中性粒细胞性哮喘模型。适应性喂养后,小鼠在第0、7 和14 天经腹腔注射含20 μg 鸡卵清蛋白(OVA)和75 μL CFA 的乳化溶液,对照组注射生理盐水;致敏后,小鼠在第21 天和第22 天接受0.1%的OVA 溶液50 μL 鼻内滴入激发。观察小鼠行为学变化。正常对照组以PBS 代替行注射及鼻内滴入。C 组小鼠另给予0.1%的1,25(OH)2D3按4 μg/kg 在每次予以OVA鼻腔滴入激发前1 h 腹腔注射。
1.3 气道反应性测定 在小鼠末次激发24 h 采用双腔体积描记系统进行无创气道反应性检测,记录数据并分析小鼠气道反应性。采用美国BUXCO 公司TBL3999 双腔体积描记系统,以乙酰甲胆碱相应浓度激发下的特殊气道阻力(sRaw)平均值与PBS 激发下的特殊气道阻力平均值来反映,公式为:sRaw 值=Mch sRaw 值-PBS sRaw 值,单位为:cmH2O。将小鼠放入密闭舱内适应时间为5 min,以PBS 和12.5、25、50 mg/mL 3 个乙酰甲胆碱的浓度进行激发雾化,记录数据比较小鼠气道反应性。
1.4 标本收集 各组在气道反应性测定后处死小鼠,收集标本,使用500 μL 冰PBS 灌洗并收集支气管肺泡灌洗液(BALF)。保存BALF 的上清液备用以检测细胞因子。收取肺组织,左上叶肺组织福尔马林固定,下一步做常规病理检查;左下叶肺组织行氧化应激指标的生化检测;右肺叶织用液氮速冻处理后保存于-80 ℃低温冰箱,用于RT-PCR实验以及Western blot 分析。
1.5 炎症细胞计数 BALF 离心,细胞沉淀重悬于200 μL PBS 中。用血细胞计数器对细胞悬液进行细胞总数的计数。另一部分悬液经离心重悬,涂片行瑞氏染色,对每张玻片进行至少观察300 个炎症细胞,根据细胞形态学和染色性质光学显微镜下进行细胞分类(分嗜酸性粒细胞、中性粒细胞、巨噬细胞、淋巴细胞),由三位有经验的病理科医师进行盲法阅片,取平均值。
1.6 肺组织病理 小鼠肺组织用4%多聚甲醛固定24 h,进行清洗、脱水、石蜡包埋、切片,切成5 μm 薄片,脱蜡后进行苏木精伊红(HE)染色,观察小鼠肺部察炎症细胞浸润及支气管肺组织结构改变等炎症病理变化。
1.7 细胞因子水平检测 ELISA 法检测BALF 中IL-4、IL-17、IL-5、CXCL2、CXCL8 细胞因子浓度,操作严格按照相关试剂盒说明书进行。使用酶标仪检测吸光度值,根据标准曲线计算出各细胞因子水平。
1.8 免疫组化染色测定肺组织中性粒细胞的浸润 肺组织切片常规脱蜡,抗原修复,3% 过氧化氢(H2O2)溶液浸泡阻断内源性过氧化物酶。5%牛血清蛋白室温封闭。小鼠Ly-6G 抗体(1∶50)4 ℃下敷育过夜,加HRP 标记的二抗室温敷育1 h。DAB 显色试剂盒显色,以及苏木素复染,返蓝、常规脱水、二甲苯透明、干燥、中性树胶进行封固。在显微镜下观察染色结果判定中性粒细胞表面抗原Ly-6G 表达情况并拍照。
1.9 Western blot 检测CHOP、GRP78 和Nrf2 蛋白 Western blot 检测肺组织CHOP、GRP78 和Nrf2蛋白水平的表达变化。肺组织液氮充分研磨,加入含蛋白酶抑制剂的裂解液,混匀冰上裂解30 min,按照说明书提取蛋白、测定蛋白浓度。样品中加2×十二烷基硫酸钠(SDS)上样液,100 ℃煮10 min,进行蛋白电泳、转膜,加相应的一抗和二抗孵育,ECL显影、拍照、进行图像分析。内参照为GAPDH。
1.10 生化检测小鼠肺组织GSH、MDA 浓度 将保存的左肺组织制备肺组织匀浆,采用还原型谷胱甘肽(GSH)测定试剂盒和丙二醛(MDA)测定试剂盒检测肺组织GSH、MDA 浓度,严格按照产品说明书操作。
1.11 实时荧光定量(RT-PCR)检测肺组织醌氧化还原酶1(NQ01)mRNA 的表达水平 采用实时荧光定量RT-PCR 检测Nrf2 的靶基因NQO1 mRNA的表达。使用Trizol 试剂提取肺组织总RNA,严格按照试剂盒的使用说明用逆转录试剂盒合成cDNA,定量PCR 分析采用SYBR 绿色核酸染料,荧光定量PCR 系统扩增分析产物。以β-actin 为内参照基因,采用2-ΔΔCT法相对定量,计算NQO1 mRNA表达水平。
1.12 统计学方法 利用SPSS 23.0 统计软件进行实验数据处理分析,实验数据以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用SNK 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠气道反应性的变化 各组小鼠气道反应性测定表明,中性粒细胞性哮喘模型组经不同浓度Mch 激发有明显气道高反应性,其sRaw 增长值均高于对照组小鼠,差异有统计学意义(P<0.05);治疗组小鼠(1,25(OH)2D3治疗)在25 mg/mL 和50 mg/mL Mch 浓度的激发情况下,气道反应性对比模型组小鼠显著下降,sRaw 增长值差异有统计学意义(P<0.05)。见图1。
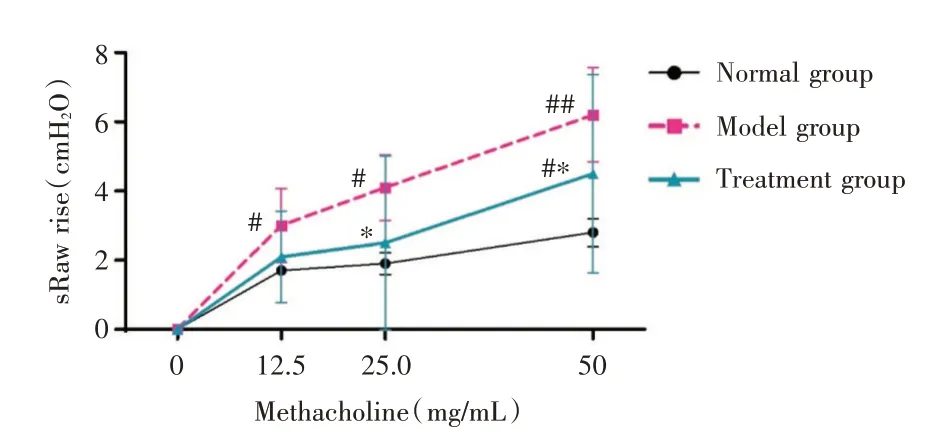
图1 气道高反应性测定结果Fig.1 Airway hyper-responsiveness test results
2.2 BALF 中细胞计数和分类BALF 中细胞总数、嗜酸性粒细胞和中性粒细胞细胞比例在中性粒细胞性模型组小鼠中增高,和对照组对比差异有统计学意义(P<0.01);1,25(OH)2D3治疗组细胞总数、嗜酸性粒细胞、中性粒细胞比例与模型组相比有明显降低,差异有统计学意义(P<0.05)。见表1。
表1 支气管肺泡灌洗液细胞计数及分类Tab.1 Total and differential cell counts in BALF ±s
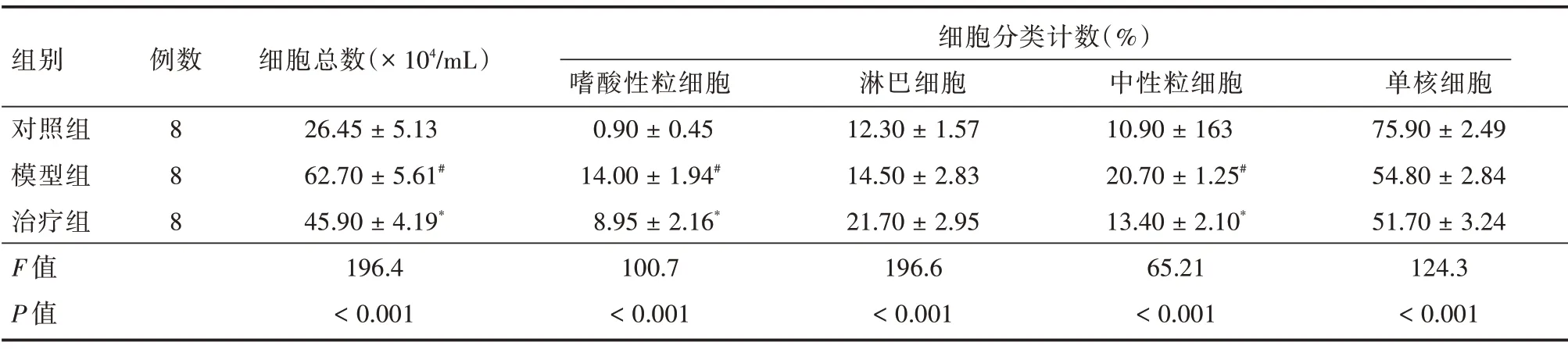
表1 支气管肺泡灌洗液细胞计数及分类Tab.1 Total and differential cell counts in BALF ±s
注:与对照组比较,#P <0.05,##P <0.01;与模型组比较,*P <0.05
组别对照组模型组治疗组F 值P 值例数8 8 8细胞总数(× 104/mL)26.45 ± 5.13 62.70 ± 5.61#45.90 ± 4.19*196.4<0.001细胞分类计数(%)嗜酸性粒细胞0.90 ± 0.45 14.00 ± 1.94#8.95 ± 2.16*100.7<0.001淋巴细胞12.30 ± 1.57 14.50 ± 2.83 21.70 ± 2.95 196.6<0.001中性粒细胞10.90 ± 163 20.70 ± 1.25#13.40 ± 2.10*65.21<0.001单核细胞75.90 ± 2.49 54.80 ± 2.84 51.70 ± 3.24 124.3<0.001
2.3 支气管肺组织病理改变 病理HE 染色观察小鼠肺组织病理改变:对照组小鼠肺组织肺泡壁及支气管结构、上皮黏膜完整,肺泡壁未见增厚,肺泡间隔、气道周围未见炎症细胞浸润。模型组小鼠肺组织可见肺组织的结构破坏,肺泡壁增厚和肺泡大小不一,支气管管腔可见分泌物,支气管周围可见较多炎性细胞浸润,可见肺泡及间质充血。治疗组炎症细胞浸润减少,支气管管腔通畅,黏膜层完整,肺泡及间质可见轻度充血现象,对比模型组肺泡壁增厚减轻。见图2。

图2 肺组织的病理学HE 染色(× 400)Fig.2 Histologic changes of lung tissue(× 400)
2.4 BALF 中细胞因子IL-4、IL-17、IL-5、CXCL2、CXCL8 浓度水平ELISA 检测 BALF 中细胞因子结果提示,中性粒细胞性哮喘模型组的IL-4、IL-17、IL-5、CXCL2、CXCL8 水平较对照组增高,差异有统计学意义(P<0.05);治疗组细胞因子浓度较模型组下降,差异有统计学意义(P<0.05)。见表2。
表2 支气管肺泡灌洗液细胞因子浓度Tab.2 Cytokine levels in BALF ±s,pg/mL
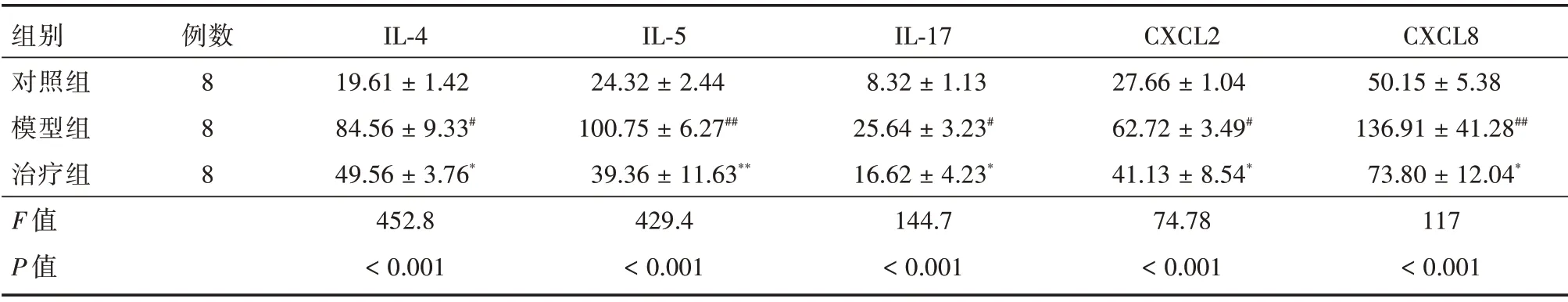
表2 支气管肺泡灌洗液细胞因子浓度Tab.2 Cytokine levels in BALF ±s,pg/mL
注:与对照组比较,#P <0.05, ##P <0.01;与模型组比较,*P <0.05
组别对照组模型组治疗组F 值P 值例数8 8 8 IL-4 19.61 ± 1.42 84.56 ± 9.33#49.56 ± 3.76*452.8<0.001 IL-5 24.32 ± 2.44 100.75 ± 6.27##39.36 ± 11.63**429.4<0.001 IL-17 8.32 ± 1.13 25.64 ± 3.23#16.62 ± 4.23*144.7<0.001 CXCL2 27.66 ± 1.04 62.72 ± 3.49#41.13 ± 8.54*74.78<0.001 CXCL8 50.15 ± 5.38 136.91 ± 41.28##73.80 ± 12.04*117<0.001
2.5 中性粒细胞Ly-6G 免疫组织化学染色 肺组织免疫组化染色显示,模型组小鼠肺组织与对照组比较可见中性粒细胞浸润数量显著增加;在1,25(OH)2D3治疗组小鼠肺组织中Ly-6G 阳性染色降低,提示中性粒细胞浸润减少。见图3。
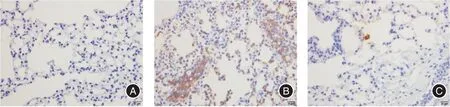
图3 中性粒细胞Ly-6G 免疫组化染色(× 400)Fig.3 Immunohistochemical staining for Ly-6G in lung tissue
2.6 肺组织CHOP、GRP78 和Nrf2 蛋白表达 Western blot 方法检测各组小鼠肺组织CHOP、GRP78、Nrf2 蛋白的表达水平,中性粒细胞性哮喘模型组小鼠肺组织CHOP、GRP78 蛋白水平与对照组相比均明显增高,差异有统计学意义(P<0.05);1,25(OH)2D3治疗组CHOP、GRP78 表达较模型组明显降低,差异有统计学意义(P<0.05);Nrf2 的蛋白表达较模型组增加,差异有统计学意义(P<0.05)。见图4。

图4 肺组织Western blot 检测CHOP、GRP78 和Nrf2 蛋白表达Fig.4 Expression of CHOP、GRP78 and Nrf2 in the lung tissue by Western blot
2.7 肺组织GSH、MDA 含量测定结果 模型组小鼠肺组织中MDA 水平明显高于对照组;模型组的GSH 低于对照组。1,25(OH)2D3治疗显著降低了中性粒细胞性哮喘小鼠肺组织中的MDA 水平,并增加了GSH 水平,差异有统计学意义(P<0.05)。见图5。

图5 肺组织GSH、MDA 含量Fig.5 MDA,GSH contents in lung tissue
2.8 肺组织NQO1 mRNA 表达水平测定结果NQO1 mRNA 的表达水平测定显示模型组中肺组织NQO1 mRNA 表达升高。在1,25(OH)2D3治疗组,NQO1 mRNA 的水平与正常对照组相比,表达水平显著提高(P<0.01),与模型组比较也有提高(P<0.05)。见图6。
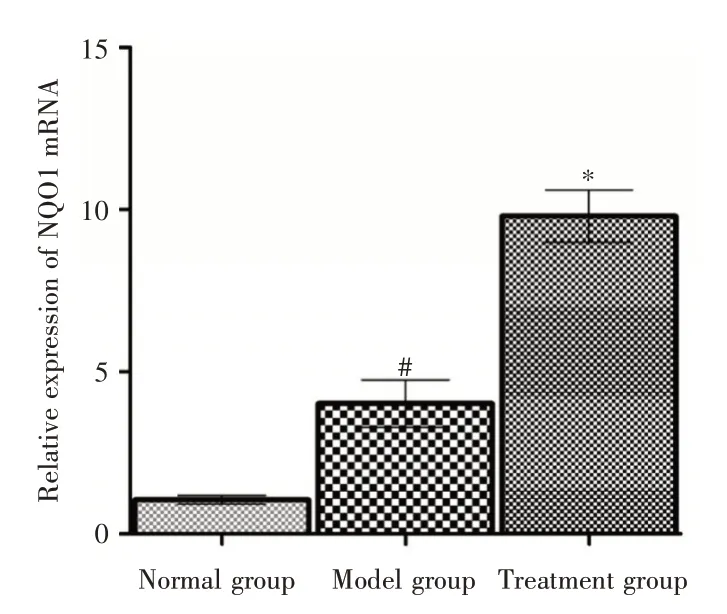
图6 肺组织NQO1 mRNA 表达水平测定Fig.6 NQO1 mRNA expression in lung tissue
3 讨论
中性粒细胞哮喘的发病机制尚不明确,因为对糖皮质激素治疗抵抗,且临床症状相比于其他类型的哮喘严重,给患者生活工作等方面带来极大影响。病毒、真菌等感染、大气污染、肥胖等合并因素导致以中性粒细胞性炎症为主的难治性哮喘增多。内质网应激是细胞为应对内质网腔内错误折叠与未折叠蛋白聚集等状况,从而激活未折叠蛋白反应、内质网超负荷反应等信号途径的反应过程[6]。研究表明,内质网应激可以诱导NLRP3 炎性小体活化,加剧了炎症小体诱导的炎症级联反应,这可能为系列炎症性疾病的治疗提供新的靶向途径[7]。而机体氧化应激引起未折叠蛋白质反应,加重ERS。Keap1-Nrf2/ARE 信号通路是细胞氧化应激反应中的关键通路,维持体内抗氧化物与过氧化物平衡[8]。Nrf2 的激活可启动下游多种靶蛋白的表达,调节机体内氧化还原平衡。笔者的研究结果证实在臭氧诱导的哮喘急性发作的小鼠模型中,通过激活Nrf2 恢复氧化抗氧化平衡,降低ROS,减少IL-17A、IL-4、IFN-γ 等的产生,并减少γδT17 细胞比例,减轻哮喘的气道炎症[9]。PATHINAYAKE 等[10]研究证明内质网应激的增强与严重嗜酸性粒细胞哮喘和中性粒细胞性哮喘有关,在哮喘的发病中起关键作用。通过下调内质网应激标志物可以减轻OVA 诱导的小鼠哮喘气道炎症[11]。GRP78 是一种多功能蛋白,是内质网应激信号的主要调节者;未折叠蛋白反应的持续会上调CCAAT 增强子结合蛋白同源蛋白(CCAATenhancer-binding protein homologous protein,CHOP)的表达,GRP78 与CHOP 蛋白表达的变化是内质网应激的标志[12]。在本实验研究中,中性粒细胞性哮喘模型小鼠出现气道反应性增高,支气管肺组织观察到明显炎症反应,中性粒细胞浸润增加,肺组织氧化应激及CHOP、GRP78 蛋白表达增强,提示内质网应激的增强加剧了哮喘的气道中性粒细胞性炎症。
1,25-(OH)2D3是维生素D3 的生物活性形式,主要生理功能是调节钙磷代谢,对固有免疫和特异性免疫功能也有明显的调节效应。较多研究显示了维生素D3 用于控制哮喘的作用[13-14]。活性维生素D3 在人体内表现的抗炎作用与抑制氧化应激有关,有研究报道1,25(OH)2D3可以通过激活Nrf2 从而抑制ROS-NLRP3-IL-1β 信号轴,减轻高渗诱导的人角膜上皮细胞炎症[15]。维生素D3 运用于预防和治疗糖尿病性视网膜病等炎症,维生素D3 可降低糖尿病诱导的ROS 上升并抑制ROS/TXNIP/NLRP3 途径,减轻视网膜血管损伤和细胞凋亡[16]。本实验观察了1,25-二羟维生素D3 治疗对中性粒细胞性哮喘的效果,在模型小鼠中降低了气道AHR 和炎性细胞浸润,减轻了肺组织中性粒细胞炎症和相关因子如IL-4、IL-17、IL-5、CXCL2、CXCL8 的水平,并且降低了氧化应激产物水平,提示1,25(OH)2D3对中性粒细胞性炎症的抑制作用和对氧化应激的调节作用。
1,25(OH)2D3治疗通过何种机制抑制中性粒细胞性气道炎症,是否通过调节体内氧化还原反应而抑制内质网应激?不少研究揭示1,25(OH)2D3通过调节内质网应激对呼吸道感染、炎症反应、糖尿病、细胞凋亡、缺血再灌注损伤的改善作用[17-21]。HU 等[22]的研究结果表明,1,25(OH)2D3可以通过抑制PERK-ATF4-CHOP 途径阻止内质网应激相关的凋亡。在本实验中使用1,25(OH)2D3治疗使哮喘动物肺组织CHOP、GRP78 表达水平降低,提高了Nrf2 蛋白表达以及其下游基因NQO1 mRNA 的表达,提示其可能通过上调Nrf2 表达抑制内质网应激改善小鼠中性粒细胞性哮喘炎症反应。
总之,本研究结果显示1,25-二羟维生素D3可通过增强Nrf2 蛋白的表达调节氧化应激,并抑制内质网应激,减少炎症细胞因子的分泌,从而减轻中性粒细胞性哮喘小鼠气道炎症。这为临床治疗中性粒细胞性哮喘或难治性哮喘提供了新的思路和理论研究,但其作用机制仍需进一步探讨,以及进行必要的临床试验以证实其治疗效果。

