碳酸钙纳米粒子用于靶向光动力治疗胰腺癌的实验研究
郭坤雄 王志华 郭婵娟 范应方
南方医科大学珠江医院肝胆一科(广州 510280)
胰腺癌是世界上最常见且致命的癌症之一,总体5年生存率不足10%[1-2]。目前胰腺癌的临床治疗方法包括手术、化疗、放疗和靶向治疗等疗效欠佳,研究进展缓慢,未能有效改善胰腺癌患者的预后[3-4]。因此,亟需开发有效治疗胰腺癌的新方法,以提高胰腺癌患者的远期生存率。
近年来,光动力治疗以其安全有效、创伤小等优点,在肿瘤的治疗中备受关注,有望为胰腺癌治疗提供新的思路和方法[5]。在特定波长激发光的照射下,光敏剂通过氧气生成活性氧,损伤癌细胞中线粒体等细胞器,导致癌细胞死亡[6-7]。光动力治疗疗效取决于癌细胞对光敏剂的摄取[8],然而,既往研究表明单纯光敏剂在胰腺癌中难以达到有效的治疗剂量[9]。如何高效递送光敏剂至肿瘤区域、增强肿瘤细胞对光敏剂的摄取是提高光动力治疗疗效的关键。随着纳米医学的发展,纳米递药系统成为提高药物递送效率、降低毒副作用、增强疗效的重要手段[10];而主动靶向型纳米载体能将药物靶向转运到肿瘤细胞,最大程度提高药物的抗肿瘤效果[11-12]。因此,利用主动靶向型纳米粒子递送光敏剂,增强肿瘤细胞对光敏剂的摄取,有望提高光动力治疗疗效。同时,肿瘤细胞溶酶体存在低pH 的特点,构建酸响应纳米递药系统以提高光敏剂胞内释放的特异性,也可进一步提高光动力治疗疗效。
本研究以胰腺癌细胞高表达的胰岛素样生长因子1 受体(insulin-like growth factor 1 receptor,IGF-1R)为靶点,以二氢卟吩e6(chlorine e6,Ce6)为光敏剂,构建酸响应的主动靶向型碳酸钙纳米粒子Ce6/Lins@CaCO3-PEG(CLCP),通过体内外实验观察CLCP 光动力治疗对胰腺癌的治疗效果,并对其作用机制进行探索。
1 材料与方法
1.1 动物与细胞 5 ~6 周龄的Balb/c 裸鼠和C57BL/6J 小鼠购自维通利华公司;人源性胰腺癌Bxpc-3 细胞株和C57 小鼠源性胰腺癌Pan-02 细胞株购自PerkinElmer 公司。
1.2 主要试剂及仪器 二水合氯化钙(CaCl2·2H2O)购自Sigma-aldrich 公司;Ce6 购自Frontier 公司;碳酸氢铵(NH4HCO3)、胆固醇、二氯甲烷、无水乙醇、二甲基亚砜(DMSO)购自北京伊诺凯科技有限公司;Linsitinib、1,2-二油酰-sn-丙三基-3 磷酸钠盐(DOPA)购自阿拉丁试剂(上海)有限公司;1,2-二十六烷酰基-sn-甘油-3-磷酸胆碱(DPPC)购自北京谨明生物科技有限公司;1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-甲氧基(聚乙二醇)-5000(DSPE-PEG-5000)购自上海芃硕生物科技有限公司。RPMI-1640 培养基、胎牛血清购自Gibco 公司;CCK-8 试剂盒购自北京索莱宝科技有限公司;Calcein-AM/PI 活/死细胞双染试剂盒购自翌圣生物科技(上海)股份有限公司;4′,6-二脒基-2-苯基吲哚(DAPI)溶液购自北京索莱宝科技有限公司;流式细胞术抗体(anti-CD16/32,FITC-anti-CD3,PE-anti-CD4,APC-anti-CD8)购自BioLegend 公司。635nm激光器购自中山鼎硕光电科技有限公司;粒度和电位分析仪(Zetasizer Nano ZS)购自Malvern 公司;透射电子显微镜(JEOL-1011)购自JEOL 公司;酶标仪(VICTOR Nivo)购自PerkinElmer 公司;倒置荧光显微镜(DMIL Led)购自Leica 公司;流式细胞仪(FACS Canto Ⅱ)购自Becton,Dickinson and Company 公司。
1.3 Ce6@CaCO3-PEG 的合成 采用气体扩散法合成Ce6@CaCO3。200 mg CaCl2·H2O、10 mg Ce6 溶于100 mL 无水乙醇。烧杯口用锡纸包封,留置多个小孔。烧杯与5 g NH4HCO3粉末共同放置在密闭箱中30 ℃下避光反应36 h,得到Ce6@CaCO3纳米粒子。20 mg Ce6@CaCO3、4 mg DOPA 溶于5 mL无水乙醇,超声反应20 min 得Ce6@CaCO3-DOPA。随后加入2 mL 二氯甲烷、16 mg DPPC、8 mg 胆固醇、32 mg DSPE-PEG-5000 搅拌反应过夜。真空旋蒸后PBS 超声振荡重悬,得到Ce6@CaCO3-PEG 纳米粒子。
1.4 Ce6@CaCO3-PEG 表面装载Linsitinib 5 mg Ce6@CaCO3-PEG、1 mg Linsitinib 溶于2 mL PBS 溶液,室温搅拌24 h。100 kDa 超滤管离心过滤即可得到Ce6/Lins@CaCO3-PEG 纳米粒子。
1.5 纳米粒子CLCP 的理化表征验证 将CLCP稀释成0.01 ~0.05 mg/mL 的溶液,振荡分散5 min后,分别通过粒度和电位分析仪、透射电子显微镜进行水合粒径、形貌像分析。CLCP 分别于pH=7.4和pH = 6.5 的缓冲溶液孵育4 h 后,随后制样并于透射电子显微镜下拍摄样品形貌像。
1.6 细胞培养 Bxpc-3 和Pan-02 细胞株采用含10%胎牛血清和1%青霉素-链霉素的RMPI-1640培养基,于恒温37 ℃、含5%CO2的饱和湿度培养箱中培养。
1.7 Bxpc-3 细胞对纳米粒子的摄取实验 将Bxpc-3 细胞以2 × 105个/孔种植到共聚焦皿培养24 h后,分别与50 μg/mL CCP 或CLCP 纳米粒子共培养24 h。随后弃去培养基,每孔加入1 mL DAPI 染色工作液孵育20 min,PBS 洗涤后共聚焦显微镜下观察DAPI 和Ce6 荧光信号并拍照。
1.8 CCK-8 法检测纳米粒子的体外光动力治疗效果 将Bxpc-3 细胞以1×104个/孔种植到96 孔板培养24 h 后,分别与0、3.125、6.25、12.5、25、50 μg/mL CCP 和CLCP 纳米粒子共培养24 h,在635 nm 激光下照射,功率为0.1 W/cm2,照射时间为5 min。继续培养24 h 后,弃去旧培养基,加入100 μL 含10%CCK-8 溶液的完全培养基,用酶标仪读取450 nm处吸光度。
1.9 活死细胞染色 处理基本同上,根据处理不同分为对照组、激光(PBS + L)组、非靶向治疗(CCP + L)组和靶向治疗(CLCP + L)组。在激光照射24 h 后,弃去培养基,加入Calcein-AM 和PI 工作液染色30 min后,在荧光倒置显微镜下观察拍照。
1.10 Bxpc-3 原位胰腺癌及Pan-02 胰腺癌皮下移植瘤模型构建 取Bxpc-3 细胞和Balb/c 裸鼠用于构建原位胰腺癌模型。通过消化、离心、洗涤收集Bxpc-3 细胞沉淀,与PBS 溶液、基质胶溶液以1∶1∶1 的比例混匀配置细胞悬液。手术暴露小鼠胰腺组织,抽取50 μL 细胞悬液注射进胰腺组织中。用小动物活体成像设备进行肿瘤自发光成像,将成功建模的小鼠进行后续实验。
取Pan-02 细胞和C57 小黑鼠用于皮下肿瘤模型构建。Pan-02 细胞悬液配置同上。将100 μL 细胞悬液注射到小鼠左侧大腿根部。当肿瘤逐渐成形生长至100 mm3可进行后续实验。
1.11 CLCP 光动力治疗原位胰腺癌的疗效观察 将成功构建的原位胰腺癌模型裸鼠随机分为对照组、PBS + L 组、CCP + L 组和CLCP + L 组。精密称取少量的CCP 和CLCP 粉末,用PBS 溶解并稀释为1 mg/mL。通过尾静脉注射的方式,给对照组和PBS + L 组 注 射200 μL PBS 溶 液,CCP + L 组 和CLCP + L 组分别注射200 μL 1 mg/mL CCP、CLCP溶液。24 h 后,手术暴露肿瘤组织,在635 nm 激光下以0.1 W/cm2照射15 min。对照组进行假手术处理,不接受激光照射。定期记录小鼠生存期。
小鼠死亡后,及时获取肿瘤组织进行原位末端转移酶标记技术染色(TUNEL 染色)观察肿瘤内细胞凋亡情况。
1.12 CLCP 光动力治疗对胰腺癌组织中T 细胞浸润的分析 将皮下胰腺癌移植瘤小鼠分组同上。在肿瘤形成后的第1、8 天进行治疗,药物注射剂量和方式同上。24 h后,对肿瘤区域进行激光照射,功率为0.1 W/cm2,照射时间为15 min。第21 天取肿瘤组织,用组织消化液消化得到单细胞悬液,裂红处理后anti-CD16/32 抗体封闭15 min。随后anti-CD3、anti-CD4 和anti-CD8 抗体染色25 min,及时用流式细胞仪检测。
1.13 统计学方法 所有实验至少进行了3 次重复。计量资料用()表示。两组之间差异采用t检验,Kaplan-Meier 法评估生存曲线。本研究中的所有数据分析均使用GraphPad Prism 8 进行。P<0.05 表示差异有统计学意义。
2 结果
2.1 CLCP 理化性质表征 通过透射电子显微镜观察CLCP 的形貌像。见图1A,CLCP 电镜下为直径(80.4±12.3)nm 的球形结构。在水溶液中,CLCP的流体动力学尺寸为(121.5±5.2)nm(图1B)。通过紫外分光光度计检测发现CLCP 对Ce6 的包封率为63.2%,包载率为16.37%。CaCO3在酸性条件下可降解为无害产物CO2和H2O[13]。见图1C,CLCP在pH=7.4 条件下形态和结构保持稳定。而在pH=6.5弱酸性条件下,CLCP 被降解,4 h 后没有观察到可见的形态和结构。
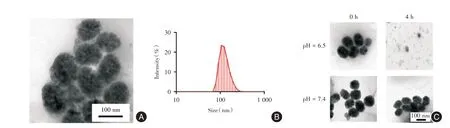
图1 纳米粒子CLCP 理化性质表征Fig.1 Physicochemical properties of CLCP nanoparticles
2.2 CLCP体外细胞靶向性分析 见图2A,用DAPI对Bxpc-3 细胞核进行染色定位(图中显示为蓝色),并观察细胞内Ce6 荧光信号(图中显示为红色)。结果表明,没有主动靶向能力的Ce6@CaCO3-PEG(CCP)只有少量进入细胞中,而有主动靶向能力的CLCP 能够被Bxpc-3 细胞大量摄取,表现为强烈的Ce6 荧光信号。对图像中的Ce6 荧光信号进行定量分析,表明相比未结合的纳米粒子,Bxpc-3 细胞对表面结合Linsitinib 的纳米粒子CLCP 具有更强的摄取量(P<0.001),见图2B。
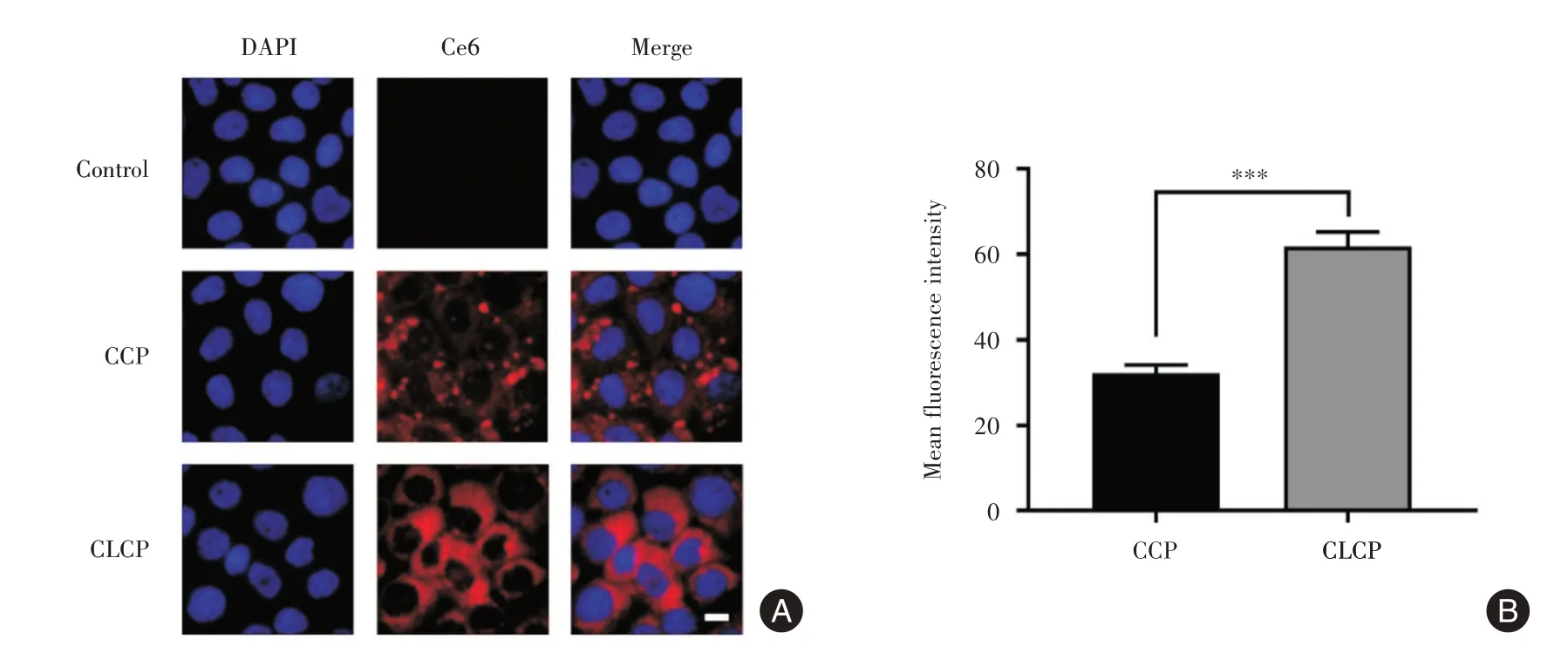
图2 CLCP 体外细胞靶向性分析Fig.2 In vitro cells targeting assay of CLCP nanoparticles
2.3 CLCP光动力治疗体外疗效评估 通过CCK-8法检测CCP和CLCP对Bxpc-3细胞的光毒性。见图3A,相比于CCP,CLCP 在激光照射下表现出更强的细胞活力抑制作用。通过活/死细胞染色来进一步分析细胞活力下降的原因,Calcein-AM 标记活细胞而表现为绿色荧光信号,作为核染色染料的PI仅在死细胞中进入细胞核而发出红色荧光信号。见图3C,对照组、激光(PBS + L,L 代表激光照射)组的细胞存活未受影响,CCP光动力治疗(CCP+L)组可以引起部分细胞死亡,而CLCP 光动力治疗(CLCP + L)组造成了显著的细胞死亡。通过对死细胞进行计数,可以更直观地发现CLCP + L 组具有更强的癌细胞杀伤作用(图3B)。
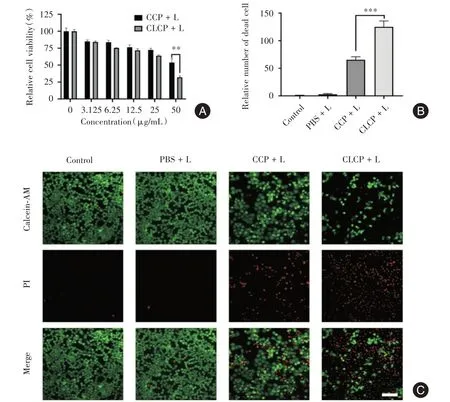
图3 CLCP 纳米粒子的体外疗效检测Fig.3 In vitro therapeutic effect of CLCP nanoparticles
2.4 CLCP 光动力治疗在体疗效评估 在原位胰腺癌模型裸鼠中评估不同治疗对小鼠生存期的影响。见图4A,CLCP+L、CCP+L、PBS+L 和对照组的中位生存期分别为46、40、28 和20 d。CLCP+L组的小鼠具有更长的生存期,并且其中位生存期是对照组的2.3 倍(P<0.001)。对获取的肿瘤组织进行TUNEL 凋亡染色发现,与其他组相比,CLCP+L 处理后肿瘤组织中凋亡细胞显著增加(图4C)。见图4B,对肿瘤组织中凋亡/正常细胞数量的比值进行分析发现,CLCP + L 组的凋亡细胞占比最大,多于CCP+L 组(P<0.05)。
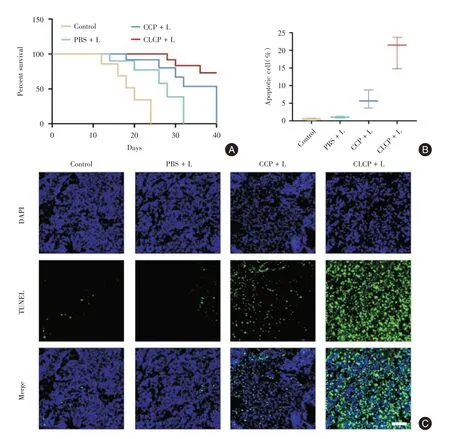
图4 CLCP 纳米粒子在体疗效评估Fig.4 In vivo therapeutic effect of CLCP nanoparticles
2.5 CLCP 光动力治疗对肿瘤免疫调节作用分析 肿瘤内死亡细胞诱导的炎症可有效提高肿瘤微环境的免疫原性[14]。通过流式细胞术来定量分析不同治疗后肿瘤中浸润T 细胞比例,以评估CLCP 光动力治疗对肿瘤免疫的调节作用。见图5A,在各组中CD4+T 细胞比例没有显著差异,但CLCP + L 组中肿瘤细胞毒性T 细胞(CD3+CD8+)比例最高。定量结果(图5B)显示,在对照组、PBS+L之间,肿瘤内细胞毒性T 细胞比例的差异无统计学意义;CLCP + L 组中细胞毒性T 细胞比例不仅显著高于对照组(P<0.01),并且高于CCP + L 组(P<0.05),表明CLCP 光动力治疗能够更有效地刺激肿瘤中CD8+T 细胞的募集。

图5 肿瘤浸润T 细胞流式分析Fig.5 Flow analysis of tumor-infiltrating T cells in vivo
3 讨论
胰腺癌恶性程度高、预后差;除了少部分患者得以手术治疗外,药物治疗效果不佳,亟需开发新的治疗手段[15]。近年来,光动力治疗在胆道肿瘤中表现出良好的治疗效果,也有临床试验探索光动力治疗胰腺癌的临床疗效[16-17]。Ce6 由于其安全性良好、光吸收能力强、活性氧产率高而备受关注,是目前用于光动力治疗的常用光敏剂[5,18-19]。然而,由于光敏剂难以递送到肿瘤区域,限制了光动力治疗在胰腺癌中的应用[20]。纳米载药技术可实现药物的高负载及高效递送,提高药物疗效、降低毒副作用[21],故采用纳米载药技术递送光敏剂,有望提高光动力治疗效果。研究表明,根据肿瘤细胞特异性高表达的分子靶标设计的主动靶向型纳米载体更有助于药物在肿瘤区域的聚集[10]。前期研究表明胰腺癌细胞高表达IGF-1R,且靶向IGF-1R 的纳米探针可实现良好的胰腺癌分子成像及治疗效果[22]。此外,根据肿瘤细胞中溶酶体低pH的特点,构建酸响应型纳米载体递送光敏剂可实现肿瘤细胞内的特异性释放,发挥精准光动力治疗效应[23]。研究表明,纳米碳酸钙具有价格低廉、合成简单、安全无毒、载药量大的优点,且对酸性环境敏感,在弱酸性条件(pH=6.5)下能够迅速降解为无毒物质Ca2+和CO2,因此,纳米碳酸钙已被广泛作为酸响应型载体应用于药物的递送[13]。本研究以IGF-1R 的靶向分子Linsitinib 作为主动靶向元件、纳米碳酸钙作为载体、Ce6 作为光敏剂合成了纳米粒子CLCP,其水合粒径为(121.5 ± 5.2)nm(图1C),呈均匀球形结构(图1B)。CLCP 中Ce6 包封率为63.2%,包载率为16.37%,可高效负载Ce6。除此之外,CLCP 具有敏感的酸环境降解能力(图1C),允许其在酸性的溶酶体内迅速降解释放Ce6 并进入胞质,为精准、有效的光动力治疗奠定了基础。体外实验表明CLCP 具有良好的胰腺癌细胞靶向性,能够被Bxpc-3 细胞大量摄取并释放Ce6(图2)。活/死细胞染色及CCK-8 实验表明,CLCP在激光照射下,可显著杀伤Bxpc-3细胞(图3)。体内实验表明CLCP 光动力治疗可引起明显的肿瘤组织细胞死亡,显著延长了荷瘤小鼠的生存期(图4)。上述结果表明,构建的CLCP 具有良好的酸响应性能和IGF-1R 主动靶向性,能够有效递送光敏剂Ce6 至肿瘤细胞,进而发挥光动力效应杀伤胰腺癌细胞,抑制肿瘤生长。
现有研究认为光动力治疗主要通过线粒体损伤介导的细胞死亡通路杀伤肿瘤细胞[24]。基于CLCP 的光动力治疗导致显著的细胞活性下降甚至死亡,推测与更高剂量的光敏剂Ce6 肿瘤区域递送及癌细胞摄取有关。其可能机制如下:CLCP经实体瘤高通透性和滞留效应在肿瘤组织中聚集,Linsitinib 识别结合胰腺癌细胞表面IGF-1R,CLCP 经内吞方式进入细胞,到达酸性溶酶体内后,降解并释放光敏剂Ce6 至胞质并聚集在线粒体周围,Ce6 在激光照射下产生大量活性氧,损伤线粒体膜导致细胞死亡[24-25]。
也有研究表明光动力治疗具有肿瘤免疫调节作用,通过促进肿瘤相关抗原的释放激活抗肿瘤免疫,特别是增强细胞毒性CD8+T 细胞浸润[5,26-27]。研究发现,与其他组比较,CLCP 介导的光动力治疗能够诱导广泛的肿瘤细胞死亡(图4B 和C),CLCP光动力治疗组肿瘤组织中CD8+T 细胞明显增多(图5),提示CLCP 光动力治疗能够实现更强的免疫激活反应。其可能机制为CLCP 光动力治疗导致肿瘤细胞死亡后,肿瘤细胞内钙网蛋白等免疫原性物质暴露,激活并募集了更多细胞毒性T 细胞,从而激活抗肿瘤免疫反应[5]。
综上所述,本研究成功构建了酸响应的主动靶向型纳米粒子CLCP,高效携载光敏剂Ce6 进行光动力治疗,可诱导胰腺癌细胞死亡,并激活抗肿瘤免疫。研究结果提示纳米载体靶向递送光敏剂可进一步提高光动力治疗的疗效,且光动力治疗联合免疫治疗具有协同抗肿瘤效应,为胰腺癌治疗提供了新思路。然而,本研究仅对CLCP 光动力治疗胰腺癌的疗效及其机制进行初步验证,后续尚需对CLCP 光动力治疗诱导胰腺癌细胞死亡和免疫激活的机制进行更深入的探索。

