根治性全胃切除术后吻合口漏列线图预测模型的建立与验证*
刘颖 龚细丹 王晓鹏
全球每年新发胃癌人数超过100万,是癌症相关死亡的第三大原因[1]。尽管化疗、靶向、免疫等治疗方式取得重大进展,但根治性手术切除仍是治愈胃癌的唯一方法。然而,胃癌手术切除范围广、淋巴结清扫范围大、胃血供丰富,术后总体并发症高达20%~40%[2-3]。吻合口漏是全胃切除术后最严重的并发症之一,可引起腹腔感染、腹膜炎、败血症、二次手术等,导致生活质量下降、住院时间延长、经济负担加重和死亡率增加,甚至缩短术后无病生存期和总生存期[4]。尽管胃癌的发病率和死亡率逐步下降,但食管胃结合部癌的发生人数呈上升趋势,需要行全胃切除手术的患者逐渐增多[5]。有研究表明全胃切除术后吻合口漏的发生率明显高于远端胃切除术[6]。因此,本研究将全胃切除术患者作为研究对象,分析术后吻合口漏的高危因素,旨在为识别高风险患者并制定预防措施提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2012年2月-2021年9月福建省肿瘤医院收治的胃癌患者。(1)纳入标准:①明确诊断为胃腺癌;②根治性全胃切除术;③临床资料完整。(2)排除标准:①联合多脏器切除术;②因梗阻、出血等原因急诊手术;③术前合并严重感染。共892例患者符合纳入及排除标准,按照3∶1随机数字表法分为训练集(n=669)和验证集(n=223)。训练集和验证集一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究已经医院伦理委员会批准,患者及家属均知情同意并签署知情同意书。
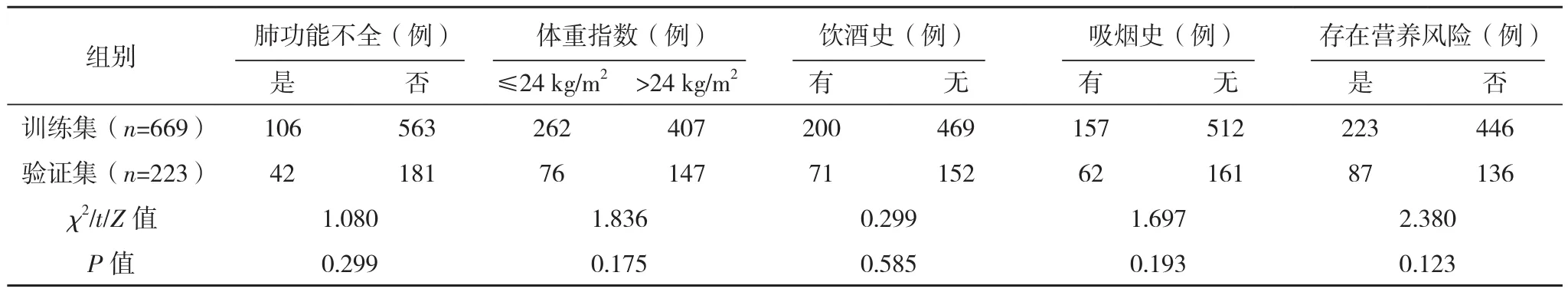
表1(续)
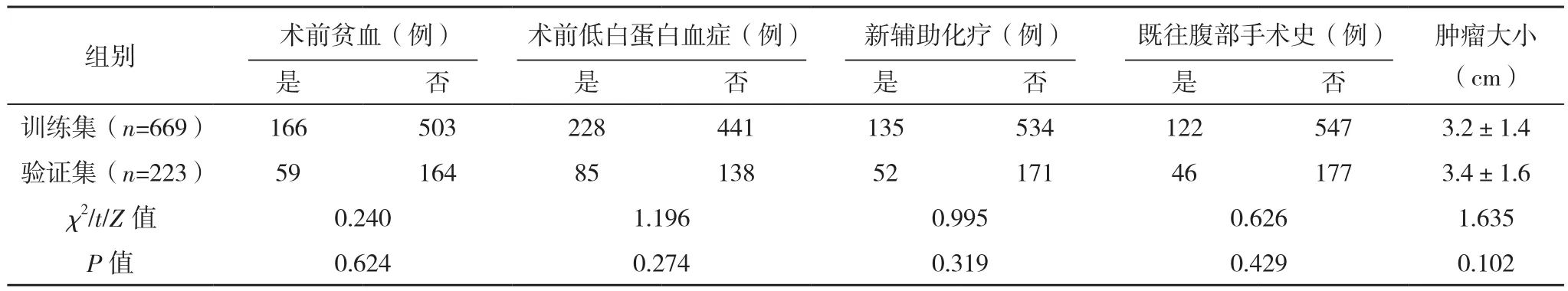
表1(续)

表1(续)
1.2 定义及量表
吻合口漏临床表现为体温升高、腹痛、脉搏增快、腹肌紧张、腹部压痛、反跳痛、白细胞计数升高。符合以下一项即可诊断:(1)引流液异常,如黄色胆汁样液体、胃内容物;(2)消化道造影见造影剂进入腹腔;(3)CT检查时吻合口周围可见气泡和/或包裹性积液[7]。肺功能不全是指1秒用力呼气容积/用力肺活量<0.70(阻塞性肺病)或肺总量<80%(限制性肺病)[8]。世界卫生组织将年龄≥60岁定义为老年人[9],体重指数(body mass index,BMI)>24 kg/m2为超重,因此本研究以此作为年龄和BMI的分界点。采用营养风险筛查(NRS2002)评估患者术前营养状态,该量表分为3个部分,包括营养状况评分、疾病严重程度评分和年龄,总分0~7分,得分≥3分表明存在营养风险[10]。
1.3 方法
成立研究小组,由2名医师和2名护士组成。所有成员经统一培训后掌握吻合口漏、肺功能不全等相关知识。所有患者在入院时常规评估营养状态。经本院病案室同意,查阅患者的临床病理资料。采用Epidata软件双录入,保证数据准确,请统计学专家指导数据分析。
1.4 统计学处理
采用SPSS 20.0软件对所得数据进行统计分析,符合计量资料用(±s)表示,组间比较采用独立样本t检验;不符合正态分布的计量资料用M(P25,P75)表示,采用秩和检验;计数资料以率(%)表示,比较采用χ2检验;将单因素分析中P<0.05的参数纳入二元Logistic回归分析吻合口漏的独立危险因素,使用R软件、rms软件包建立列线图预测模型,将训练集和验证集进行模型的内部验证和外部验证,绘制受试者工作特征曲线(receiver operating characteristic,ROC)和校准图评价模型的区分度和校准度,Hosmer-Lemeshow检验判断模型的拟合度。以P<0.05为差异有统计学意义。
2 结果
2.1 训练集吻合口漏的单因素及多因素分析
训练集,吻合口漏的发生率为7.6%(51/669)。单因素分析表明:年龄、糖尿病、肺功能不全、体重指数、术前存在营养风险、术前低白蛋白血症均与吻合口漏有关(P<0.05),见表2。将单因素分析中差异有统计学意义的变量纳入多因素分析,结果表明年龄≥60岁、糖尿病、BMI>24 kg/m2、术前存在营养风险、肺功能不全均是吻合口漏的独立危险因素(P<0.05),见表 3。

表2 训练集吻合口漏的单因素分析

表2(续)

表2(续)

表2(续)

表3 训练集中吻合口漏的多因素分析
2.2 根治性全胃切除术后吻合口漏列线图预测模型的构建及内部验证
训练集,基于根治性全胃切除术后吻合口漏的独立危险因素建立列线图预测模型,见图1。通过绘制受试者ROC曲线,结果显示列线图预测模型 ROC曲线下面积(area under the curve,AUC)为 0.760(95%CI:0.692,0.828),见图 2。校准曲线显示预测曲线与实际曲线一致性良好,见图3。Hosmer-Lemeshow检验结果表明模型拟合优度良好(χ2=6.079,P=0.531)。

图1 根治性全胃切除术后吻合口漏的列线图预测模型
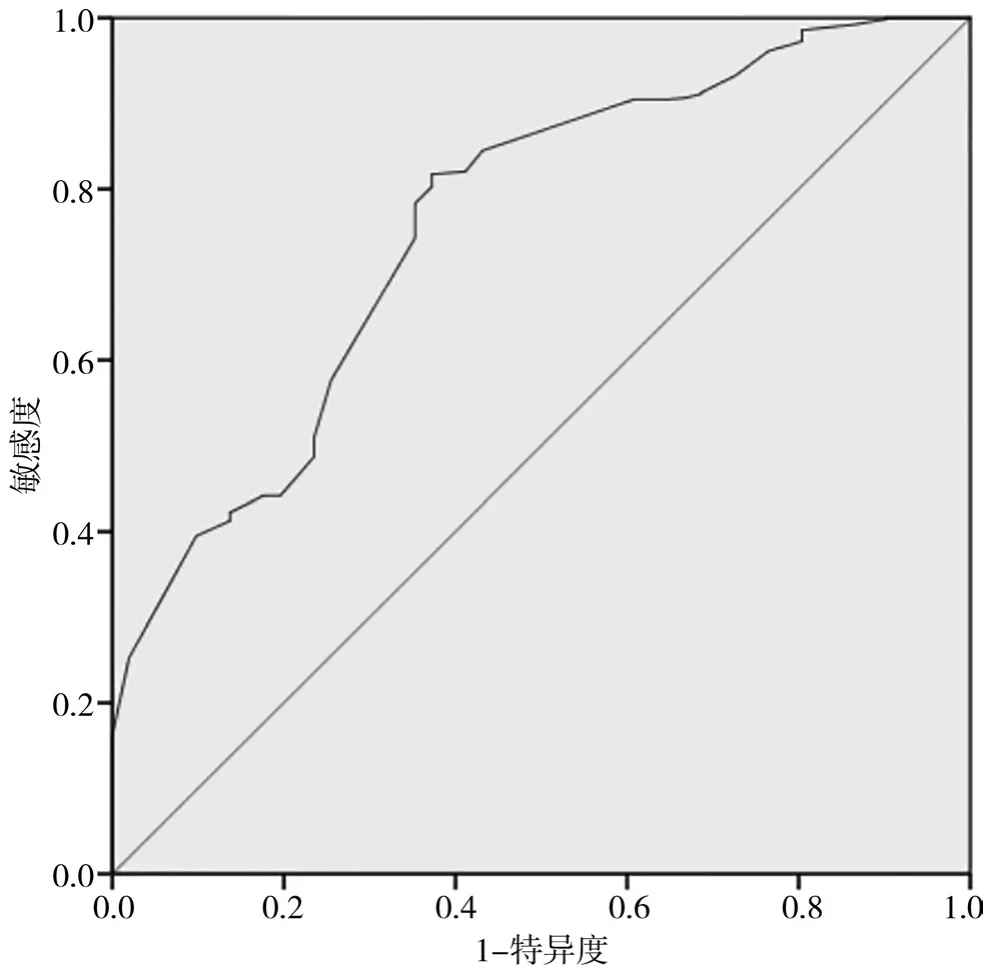
图2 训练集的ROC曲线
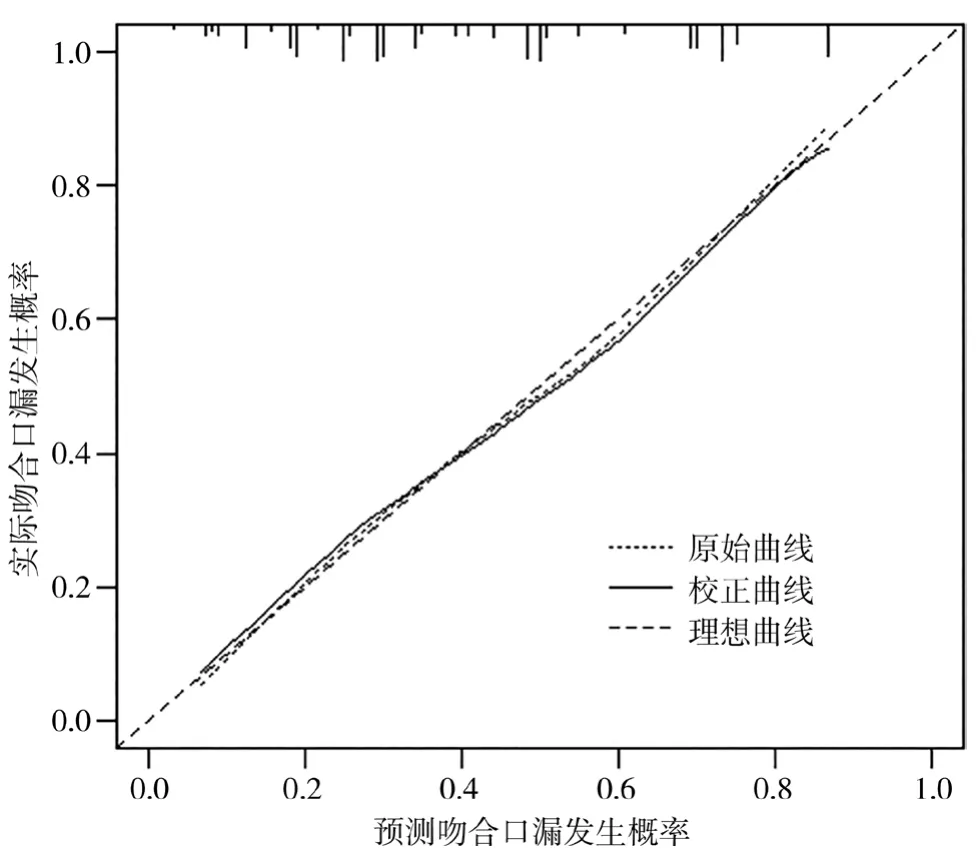
图3 训练集的校准曲线
2.3 吻合口漏列线图预测模型的外部验证
验证集中,AUC 为 0.741(95%CI:0.670,0.812),见图4,表明区分度良好;校准曲线显示列线图的预测值和实际观察值结果较为一致,见图5。
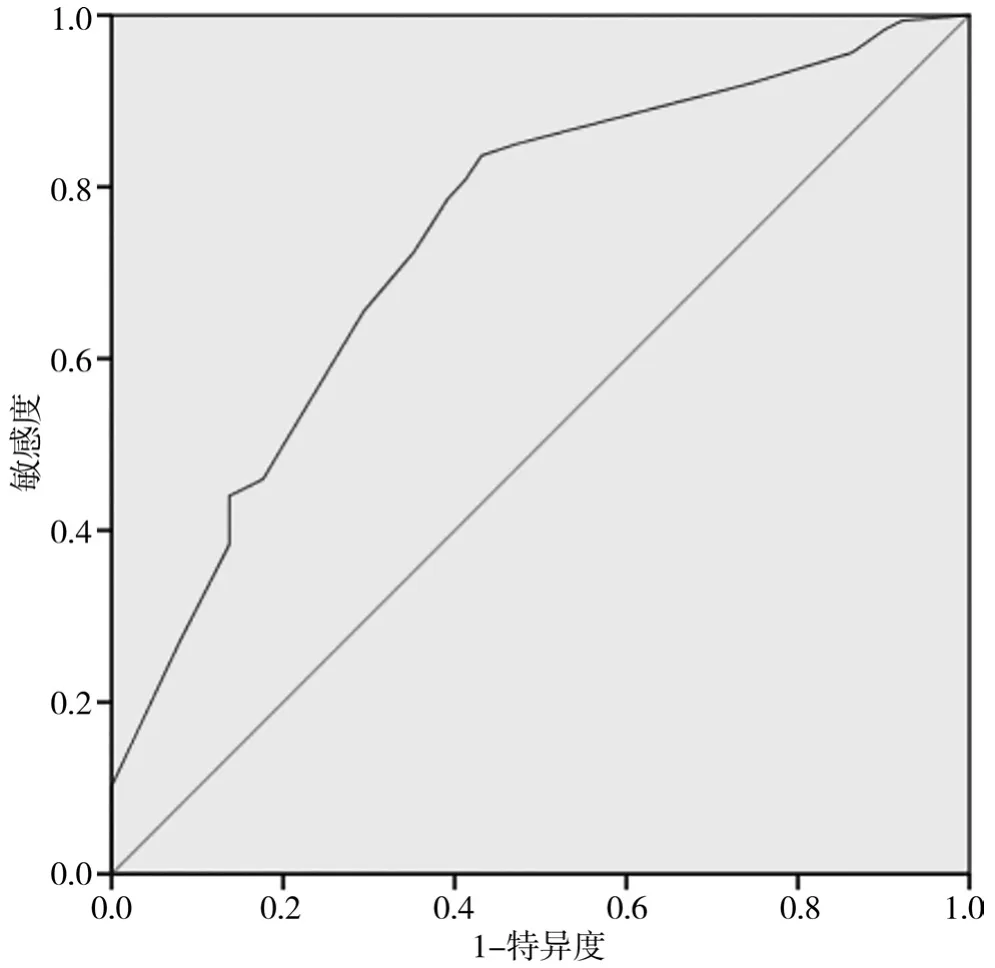
图4 验证集的ROC曲线

图5 验证集的校准曲线
3 讨论
随着缝合器械的发展、手术技术水平提高和围手术期管理的改进,吻合口漏有所减少,但仍是胃切除术后最常见的并发症之一。本研究中,训练集吻合口漏的发生率为7.6%,与Ding等[11]发现在1 815例食管胃结合部癌患者中,91例(5.0%)术后出现吻合口漏。日本一项研究表明9.9%全胃切除患者发生吻合口漏[6]。
列线图预测模型是将多因素分析的结果以图形化展示出来,可预测某个临床结局或不良事件的发生概率,具有可视化、易操作等优点,在评估某种临床疾病和预后中已广泛应用[12-14]。本研究列线图模型内部验证和外部验证的AUC分别为0.760(95%CI:0.692,0.828)和 0.741(95%CI:0.670,0.812),表明模型的区分度良好;两者校准曲线显示预测曲线贴近实际曲线,表明精确度较好。该列线图有利于医护人员精准判断个体出现吻合口漏的风险并制定针对性的临床决策。
本研究中,年龄是吻合口漏的重要影响因素。随着年龄增长,人体的生理衰退、器官功能减弱、身体结构退化,对外界环境的刺激耐受性下降,细胞再生和康复能力大大降低[15]。高BMI患者增加术后吻合口漏的风险。体重超重是全球最重要的公共卫生问题之一,常合并糖尿病、肺功能不全、心血管等基础疾病,降低机体的生理储备和应对手术能力,术后恢复缓慢;同时,体重超重由于内脏脂肪组织过多造成手术视野差、解剖层次难以辨认,引起手术和消化道重建难度增大,创伤增多、手术时间延长[16]。糖尿病患者出现术后吻合口漏是非糖尿病的3.34倍。一方面,高血糖状态引起微血管基底膜增厚、动脉粥样硬化,使得组织血供减少,吻合口愈合缓慢;另一方面,糖尿病患者内分泌和代谢功能紊乱、抵抗力下降、加重全身炎症反应,成纤维细胞和肉芽组织形成减慢,降低组织的修复能力[17]。术前存在营养风险更容易出现吻合口漏。胃癌引起腹痛、能量摄入减少、肿瘤慢性消耗,机体长期处于负氮平衡,高达38.3%的患者出现营养不良[18]。营养状态差引起体质弱、免疫功能低下、吻合口水肿,造成吻合口愈合延迟。《加速康复外科中国专家共识及路径管理指南》明确指出:需要常规评估术前患者的营养状况,对于存在营养风险的患者需要营养支持治疗时间一般为7~10 d[19]。肺功能不全是术后吻合口漏的独立危险因素。肺功能患者机体长期处于供氧能力不足的状态,术中麻醉药抑制呼吸运动、术后伤口疼痛限制胸廓起伏,进一步加重机体的缺氧,延长吻合口愈合时间[20]。
总之,年龄、糖尿病、体重指数、术前存在营养风险、肺功能不全均是根治性全胃切除术后吻合口漏的高危因素。建立的列线图预测模型有助于临床工作人员甄别高危人群并制定有效的防治措施,从而最大限度降低吻合口漏的发生。

