胆囊运动亢进的研究进展
梁文平, 罗丹堃, 刘 博, 薛东波, 马 骉
哈尔滨医科大学附属第一医院 微创胆道外科, 哈尔滨 150001
胆囊运动亢进是一种由胆囊原发性动力改变引发的一类疾病。这类疾病以反复右上腹部“胆绞痛”和腹部超声检查阴性为特征[1-3]。临床上通过肝胆亚氨酸二乙酸(hepatobiliary iminodiacetic acid, HIDA)扫描来测量胆囊排空分数(gallbladder emptying fraction,GBEF)[1, 4-7],GBEF的正常值为35%~80%,GBEF<35%表明胆囊运动功能减弱,即低动力性胆道运动障碍[8];GBEF>80%则为胆囊运动亢进[3, 9]。这种疾病首次报道是在1999年,但并未引起广泛重视,在过去通常认为高GBEF代表胆囊排空有效,不会导致胆绞痛[4, 10]。笔者统计近几年国外的文献发现:胆囊运动亢进是导致胆囊功能性疾病的重要原因[1, 4-5, 9],其发病率高于低动力性胆道运动障碍[11]。对具有胆绞痛症状的胆囊运动亢进患者行胆囊切除术后,胆绞痛症状几乎完全缓解。这一发现引起学者们对胆囊运动亢进的重视,但关于这种疾病的诊断和治疗,目前仍存在争议。为了更全面地理解和寻找胆囊功能性疾病的解决方案,有必要对胆囊运动亢进进行探索,本文将对这种疾病目前的研究现状和进展作相关阐述。
1 流行病学
胆囊运动亢进作为胆道运动障碍中的一员,通常被视为一种排除性诊断,这类疾病十分罕见。然而,在美国,诊断为功能性胆囊疾病而行胆囊切除术的约占20%。在美国,胆道运动障碍的发病率为85/1 000 000,在美国以外的地区为25/1 000 000。1991年—2001年,美国胆道运动障碍的发病率有所增加,从43/1 000 000增加到89/1 000 000[12]。1997年—2010年,儿童胆道运动障碍的发病率急剧增加(700%)[13-14]。然而,我国关于胆道运动障碍的研究较少,临床医生对胆囊运动亢进的认识不足,往往导致他们在工作中忽视本病的诊断。
2 发病机制和病理特点
2.1 发病机制 胆囊运动亢进诱发的腹痛可能与胆囊的剧烈收缩和异常排空有关[15]。其具体的发病机制目前仍不明确,但一般认为可能与胆囊收缩素(cholecystokinin, CCK)分泌增加、CCK受体(CCKR)亲和力增加或CCKR密度增加有关。CCK是调节胆囊运动的主要激素,由十二指肠和空肠上端黏液细胞合成。进食后,CCK分泌增加,通过血液循环与胆囊平滑肌和Oddi括约肌中1型CCK受体结合,二者特异性结合导致受体构象发生改变,受体的第3个胞内环暴露出来与Gq蛋白结合。Gα激活磷酸酯酶C,磷酸酯酶C促使二磷酸磷脂酰肌醇水解为三磷酸肌醇和二酰基甘油2个第二信使。随后三磷酸肌醇进入内质网并介导储存钙的释放,大量钙的释放进一步激活钙调蛋白和肌球蛋白轻链激酶,引起胆囊的剧烈收缩,由二酰基甘油激活的蛋白激酶C可能通过磷酸化参与胆囊收缩[16-17]。此外,CCK可促进胆囊神经元释放乙酰胆碱,通过神经调节的作用,抑制Oddi括约肌阶段性收缩,胆道压力降低,胆囊和Oddi括约肌相互协调,促使胆汁排入十二指肠[17]。CCK的分泌增加、CCKR亲和力增加和CCKR密度增加会通过上述通路导致胆囊运动亢进(图1)。一些胆囊运动亢进患者在使用CCK受体拮抗剂后疼痛明显减轻,这也证实CCK信号通路异常极可能是本病的发病机制。另有研究[17]表明,CCK水平越高,胆囊的收缩功能越强。胆囊运动亢进患者体内CCK含量高低对于阐述这种疾病的机理尤其重要,但目前少有研究对胆囊运动亢进患者体内CCK含量进行测定,而相关研究可能会更清楚地阐述胆囊运动亢进的病理生理学机制[15]。
2.2 病理学 胆囊持续而剧烈的收缩会导致胆道压力显著增高,从而导致黏膜损伤和慢性炎症。为明确胆囊运动亢进患者病理学特征[11, 18],表1统计了近5年报道胆囊运动亢进患者病理特点的研究,在这些研究中,大多数患者在术前未见慢性胆囊炎的影像学征象,如胆囊壁增厚、胆囊萎缩等。但术后病检显示,90%的患者患有慢性胆囊炎。上述现象表明,长期慢性黏膜炎症与高GBEF之间存在关联[4]。
3 临床表现与诊断流程
3.1 临床表现 胆囊运动亢进作为胆道运动障碍中的一类,重点了解患者病史对于明确胆道运动障碍的诊断至关重要。临床医生应关注患者疼痛的具体性质与食物、排便情况、持续时间、一天中发作的时间以及是否与之前的治疗存在关系。典型的“胆绞痛”是这类疾病的显著特征[2, 20],主要临床表现包括餐后右上腹疼痛,并向左侧腹部、背部或右肩胛骨放射;对脂肪类食物不耐受;疼痛常发生在夜间;腹胀;恶心和呕吐。
3.2 诊断流程 胆囊运动亢进的诊断建立在胆道运动障碍的基础之上,是一种排除性诊断。对于以反复上腹部(尤其是右上腹)疼痛就诊的患者,应首先考虑诊断为更常见、可能性更大的疾病,例如:恶性肿瘤、胆石症或胆汁淤积、消化性溃疡、慢性胰腺炎等(图2),通过实验室检查可以评估肝功能(ALT、AST、TBil)、寻找胰腺炎的证据(血清淀粉酶和脂肪酶);通过腹部超声可诊断胆结石或胆汁淤积;通过上消化道内镜检查可以诊断消化系统疾病;虽然CT通常用于评估急性腹痛的病因,但无法充分评估胆囊或胆道疾病。MRI的敏感性很高,但同时费用也很高,除非怀疑有恶性肿瘤或胆道梗阻,一般不作为主要检查方式。排除上述可能的疾病后,则考虑诊断为胆道运动障碍。为了评估胆囊的运动功能,临床上使用CCK-HIDA测量GBEF,GBEF>80%的患者则被定义为胆囊运动亢进(图2)[3]。
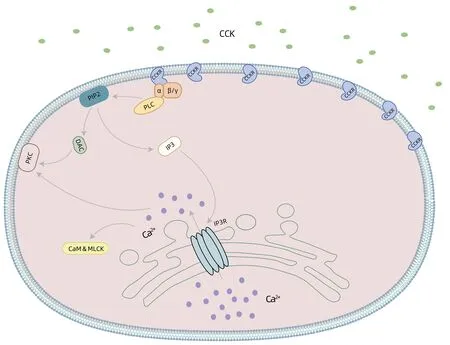
图1 胆囊运动亢进的信号通路

表1 胆囊运动亢进病理学特点
4 诊断性检查
4.1 腹部超声 腹部超声作为胆囊运动亢进诊断过程中的主要诊断方式,其对胆石症高度敏感(诊断率>90%),超声结果正常可率先排除胆结石。但对于微小的、位于漏斗处的结石,腹部超声仍难以发现,易误诊为胆囊功能性疾病[21]。内窥镜超声检查弥补了腹部超声在此方面的不足,既增加了胆石的检出率,又增加了对胆囊疾病的诊断敏感性[22]。
4.2 胆道闪烁显像 根据罗马标准Ⅲ,出现功能性胆绞痛的患者,应考虑行CCK胆道闪烁现象/CCK-HIDA检查[23]。99mTc标记的亚氨酸二乙酸是该项检查中最常用的放射性示踪剂,该药物可以被肝脏高度摄取,然后经胆管排出[15, 24]。在接受检查前,患者应禁食4 h以上,避免CCK内源性分泌引起的胆囊收缩,进而抑制放射性核素的吸收,从而导致假阳性结果[24]。同时给予受试者CCK类似物或脂肪粉以诱导胆囊收缩[8]。再使用大视野γ相机记录,获取连续显像下的胆囊排空曲线[25]。GBEF指的是胆囊体积改变的百分比,反映胆囊的收缩功能。要想获得准确的GBEF,对CCK的输注剂量和时间的标准量化变得尤其重要。经过多方研究证实,国际专家组共识[26]建议最标准的方法是:以0.02 mcg/kg的速度输注60 min,GBEF>38%是正常的。但反复测试发现,GBEF不是静止的,其重复性不高,容易受到一些药物影响,特别是影响Oddi括约肌功能的药物,包括麻醉剂、硝酸盐和钙通道阻滞剂[8, 24, 27-30]。虽然目前普遍将GBEF作为评估胆囊排空功能的一项金标准,但Rose等[31]研究发现,53%的GBEF异常患者在重新测试后GBEF正常,GBEF的结果仍不稳定。此外,一些基础疾病(如肝硬化、糖尿病等)可能影响胆囊的动力,引起GBEF降低的假阴性结果。同理,是否也有一些疾病会造成GBEF升高(GBEF>80%)的假阳性结果,目前仍不明确。临床医生在诊断胆囊运动亢进时,不可单单依据GBEF,应从大局出发,全面分析。
4.3 MRI 在临床上,磁共振胰胆管成像(MRCP)可用于评估胆总管结石、胆道梗阻和胆道恶性肿瘤,但在评估胆囊功能时仍存在一定的局限性。钆塞酸增强MRI弥补了MRCP的不足,可以对胆囊管通畅性和胆囊运动功能进行评估[32-33]。在对疑似胆道运动障碍患者的研究[34-35]中,研究人员用钆塞酸增强MRI的肝胆期和肝胆闪烁显像对疑似胆囊运动障碍患者的胆囊管通畅性和胆囊收缩性进行了评估,发现两种方法得到的结果类似,从而证实钆塞酸增强MRI也可用于评估胆囊管通畅性和测量GBEF。但目前MRI应用于胆囊功能性疾病的研究较少,仍需要大量高质量研究来验证其可行性。
5 鉴别诊断
胆囊运动亢进的诊断首先应排除胆石症等胆道器质性疾病,其次可与其他引起类似症状的疾病相鉴别。如Oddi括约肌功能障碍、低动力性胆道运动障碍、功能性消化不良等。
5.1 胆结石 胆结石是引起胆绞痛最常见的原因,腹部超声作为其首选诊断方式,检出率可达90%。检查中应尤其注意一些容易被忽视的区域,如Hartmann囊等,避免漏诊。如怀疑有难以发现的微小结石(<3 mm)和胆汁淤积,可以补充检查内镜超声和胆汁显微镜检查辅助腹部超声以明确胆石症的诊断。
5.2 Oddi括约肌功能障碍(sphincter of oddi dysfunction,SOD)
胆道运动障碍主要包含胆囊及胆囊管运动障碍(gallbladder dyskinesia, GD)和SOD[36],两者临床症状十分相似。胆囊运动亢进主要与胆管SOD相鉴别,关于胆管SOD的诊断,罗马标准Ⅳ中必要的诊断标准有:(1)胆道疼痛,(2)肝酶升高或胆管扩张,(3)无胆结石或者其他结构异常;同时支持标准有:(1)淀粉酶/脂肪酶正常(2)Oddi括约肌测压异常(3)肝胆显像异常[2, 20]。 目前认为Oddi括约肌测压(sphincter of Oddi manometry, SOM)是SOD诊断的金标准[37-38]。但因其数据结果的不准确性及测压后严重的并发症等影响,排除胆道结石后,不推荐使用SOM[39]。 因此,鉴别胆囊运动亢进和SOD更加困难,目前关于此方向的研究尚少。
5.3 低动力性胆道运动障碍 虽然胆囊运动亢进与低动力性胆道运动障碍属于相对立的胆囊动力性疾病,但二者临床症状相似,主要鉴别点在于两者的胆囊排空分数不同。对于低动力性胆道运动障碍,罗马标准Ⅳ认为必要的诊断标准:(1)胆道疼痛(2)无胆结石或者其他结构异常;支持标准:(1)胆囊闪烁显像低排空分数(GBEF<35%)(2)正常肝酶、结合胆红素和淀粉酶/脂肪酶。这类疾病目前是腹腔镜胆囊切除术的公认指征[2]。
5.4 功能性消化不良(functional dyspepsia, FD) FD是指具有与饮食相关的上腹部疼痛不适,偶伴恶心、呕吐和饭后胀满感等症状,使用目前的检查手段未能发现消化性溃疡、糜烂、肿瘤,并排除返流性食管炎,肝、胆、胰疾病、肠易激综合征及其他系统疾病的一组临床症侯群[40-41]。FD和胆囊运动亢进均为排除性诊断。两者的鉴别主要取决于患者的症状特点[42],FD患者常诉腹部轻微持续性疼痛,多在餐后加重,伴腹胀,每日发作或每次发作6 h以上[43]。
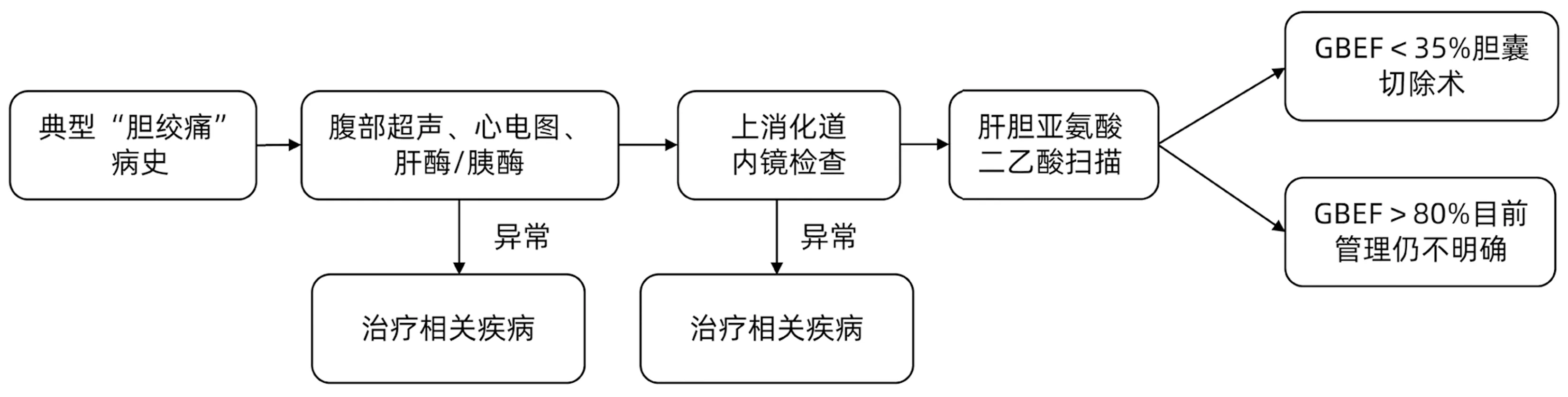
图2 胆囊运动亢进患者的诊断流程
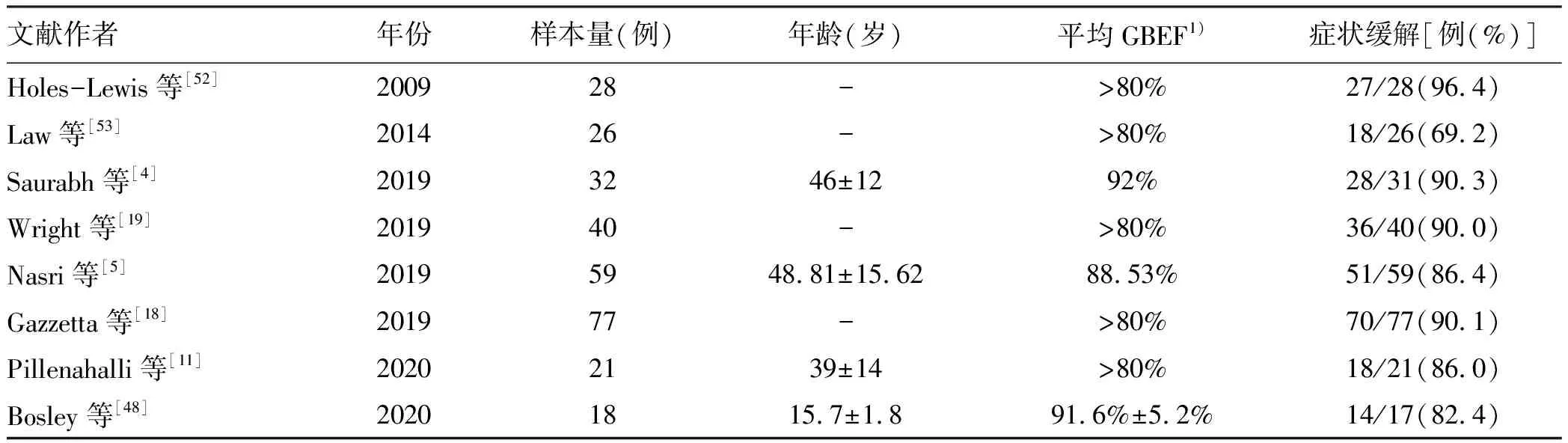
表2 腹腔镜胆囊切除术对胆囊运动亢进患者的症状缓解情况
6 治疗及预后
既往观点认为:胆囊及胆囊管运动障碍(gallbladder dyskinesia, GD)多指低动力性胆道运动障碍,其症状往往可以自愈,不建议早期干预[44]。自Dunn等[45]首次提出胆囊切除术治疗低动力性胆道运动障碍的建议后,GD的治疗开始倾向于手术干预。目前,GD已成为腹腔镜胆囊切除术的明确指证[46-47]。对于胆囊运动亢进,具体治疗方式还不明确。研究[2,19, 48-51]发现,胆囊切除术能明显改善胆囊运动亢进患者的相关症状,其缓解率甚至高于胆囊切除术对低动力性胆道运动障碍患者的缓解率,这表明胆囊运动亢进可能成为胆囊切除术的新指征(表2)。但目前仍不清楚的是为什么仍有高GBEF患者在胆囊切除术后症状没有得到缓解,甚至复发加重,这可能提示其他的胃肠道疾病或多病因同时存在,也有可能是胆囊切除术对胆道动力系统的影响,以对Oddi括约肌功能影响最为常见。在对胆囊运动亢进患者的术后随访中,各研究的随访时长也不一致,以3个月~1年不等,对其治愈的标准目前没有统一。鉴于该领域缺乏大量前瞻性研究数据,是否应将胆囊运动亢进作为胆囊切除术的手术指征,仍具有争议,对胆囊运动亢进患者的非手术治疗研究仍然较少,中药调理可能对这种功能性疾病的症状改善有良好的效果。
7 总结与展望
综上所述,在排除常见胃肠道疾病及肝外结石等器质性疾病的情况下,患者如果出现典型的“胆绞痛”症状,应考虑胆道运动障碍性疾病的可能,并及时评估患者胆囊功能。对于GBEF<35%的患者,手术治疗可以明显缓解这类患者的疼痛,而对于GBEF>80%的胆囊运动亢进的患者,其诊断和治疗仍存在争议,临床医生应严格把握手术指证,在保守治疗无效的情况下,手术治疗将是这类患者的选择。而目前针对该疾病的诊治仍需大量前瞻性、随机对照研究来进行指导分析。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:梁文平负责课题设计,资料分析,撰写论文;罗丹堃、刘博参与收集数据,修改论文;薛东波、马骉负责拟定写作思路,指导撰写文章并最后定稿。

