去乙酰化酶Sirtuins家族与非酒精性脂肪性肝病的关系
宗也凯, 刘江凯
1 河南中医药大学 第一临床医学院, 郑州 450008; 2 河南中医药大学第一附属医院 脾胃肝胆科, 郑州 450008
非酒精性脂肪性肝病(NAFLD)也称代谢相关脂肪性肝病(MAFLD),是一种潜在的严重肝病,是指除外酒精和其他明确损肝因素所致的以肝细胞内脂质过量沉积为主要特征的临床病理综合征[1]。其临床疾病谱发展包括非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)甚至肝硬化和肝细胞癌(HCC)。流行病学调查结果显示NAFLD全球患病率为25.24%[2],在我国,NAFLD患病率为29.2%[3]。全球范围内,2010年—2020年儿童NAFL的发病率迅速攀升,NAFLD整体呈年轻化趋势[4]。但迄今为止尚无针对这种疾病的特定药物治疗被批准[5],因此如何诊治NAFLD已成为当今中西医学界面临的严峻挑战。近些年,国内外大量研究发现Sirtuins在NAFLD的发生发展中扮演着重要的角色,Sirtuins有望成为新的治疗靶点。
1 Sirtuins概述
Sirtuins是一组高度保守的线粒体烟酰胺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖性蛋白质去乙酰化酶家族,由沉默信息调节因子2编码。它们通过各种翻译后修饰调节下游靶蛋白功能,大约与25%的人类蛋白质组相互作用。生物活性主要包括细胞应激、耐药性、基因组稳定、肿瘤发生和调节能量代谢等[6]。Sirtuins对翻译后蛋白底物的化学修饰主要以乙酰化为主,辅以丙二酰化、琥珀酰化和戊二酰化[7]。Sirtuins家族由7种不同的同源蛋白质组成(SIRT1~7),具有不同的亚细胞定位和功能(表1)[8-10]。其在代谢组织如肝脏、胰腺和脂肪组织中具有很高的表达特征[11],因此对肝脏可能有潜在特异性。Sirtuins涉及很多包括肝脏在内的细胞生理功能:生物氧化、糖脂代谢、线粒体功能、胰岛素分泌、肝糖异生、脂肪细胞成熟、炎症活动。这与NAFLD多重打击假说中的多种因素相重合,如氧化应激诱导的线粒体能量代谢障碍、内质网应激以及促炎和纤维化途径的激活[12]。
2 Sirtuins在NAFLD中的作用
2.1 Sirtuins与脂肪代谢 肝内脂肪过度异位沉积是NAFL发生发展的重要病理基础,Sirtuins通过多种途径参与脂肪代谢,减少因肝细胞脂肪过度沉积对细胞结构和功能的破坏[13],预防脂毒对肝细胞二次打击的发生。脂肪由甘油和三分子脂肪酸合成,各种异常的脂肪酸活化过程是甘油三酯积累的主要原因之一[14]。肝细胞SIRT1特异性缺失损害过氧化物酶体增殖物激活受体α(PPARα)的信号传导,抑制了脂肪酸β-氧化过程,过多的脂肪酸难以分解,从而加重了肝内脂肪堆积[15]。成人NAFLD大泡状脂肪变性从肝脏中央周围区开始发生,随着疾病的进展,逐渐向门静脉周围区扩散。SIRT5在肝门静脉周围细胞有高表达特征,基因敲除SIRT5小鼠中受损的线粒体对中链甘油三酯(C6-C12)β-氧化能力下降可能驱动了门静脉周围大泡性脂肪变性[16]。作为脂肪基本成分之一的棕榈酸酯,其介导的异常脂肪代谢可通过AMPK/PPARα/PPARγ途径被SIRT1抑制,从而减轻过量异常脂肪合成对肝脏代谢的负担[17]。
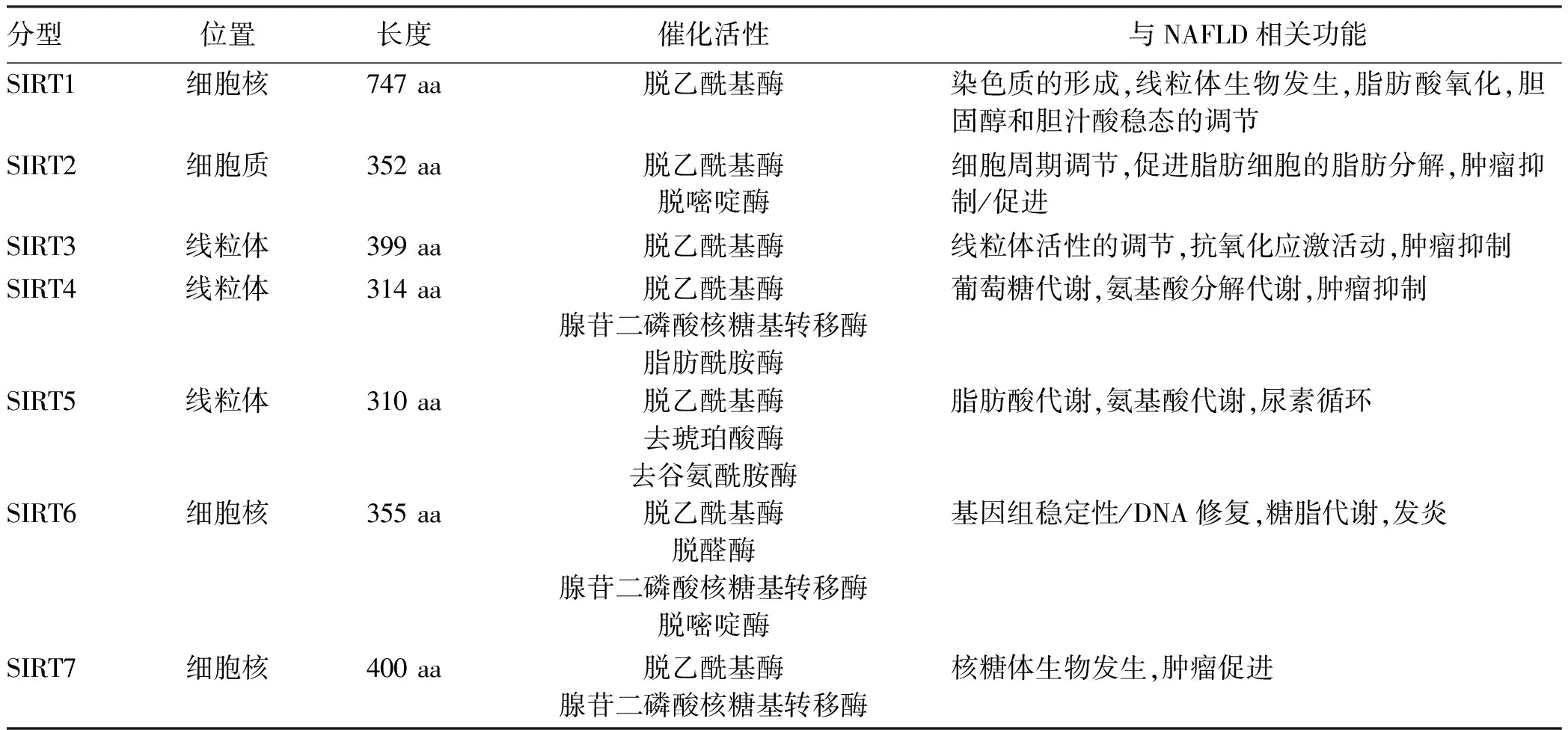
表1 哺乳动物Sirtuins一般特征[8-10]
载脂蛋白是脂质运输的重要载体,亦是肝脂质代谢的主要途径,其主要由肝细胞合成,NAFL的发生可能与不同类型载脂蛋白的缺失或增加相关[18]。相关研究[19]表明,SIRT3可恢复非酯化脂肪酸诱导的极低密度脂蛋白低效组装和分泌,提高肝脏脂肪代谢效率。相反,肝SIRT6缺乏则会导致糖类应答元件结合蛋白和胆固醇调节元件结合蛋白1(SREBP1)的水平和转录活性升高。低密度脂蛋白受体在细胞膜表面的表达与SREBP1呈正相关,过高的SREBP1表达会促进低密度脂蛋白携带脂质由血浆向胞内转运,增加肝脏对脂质的摄取,诱发NAFL的发生[20]。近年来,自噬/脂噬也被广泛认为是脂肪代谢及降解的重要途径之一,甘油三酯脂酶通过SIRT1介导的信号促进自噬/脂噬的发生,是控制肝脏脂滴分解代谢和脂肪酸氧化的主要手段[21]。研究[22]证实,丹皮酚能够通过促进SIRT1-FoxO1-ATG14(自噬相关蛋白14)依赖性脂噬预防棕榈酸诱导的HepG2细胞损伤中的脂代谢障碍,降低细胞中脂滴数量。这一行为也可被SIRT3通过激活AMPK信号来增强脂滴中巨噬细胞和分子伴侣介导的自噬[23]。综上所述,Sirtuins通过氧化分解、调控脂肪细胞、修饰功能蛋白、激活自噬等途径对人体脂肪代谢产生影响,尤其在对肝脂肪变的预防和改善当中扮演着重要的角色。
2.2 Sirtuins与胰岛素抵抗或缺失 胰岛素抵抗或缺失是NAFLD发生发展的关键打击因素。脂肪组织中甘油三酯脂解后,脂肪酸主要从血液输送到肝脏,这一过程受胰岛素调节。胰岛素缺失或抵抗致使细胞利用葡萄糖不足,导致过多的脂肪酸运输到肝脏诱发形成NAFL[24]。目前已知诱发胰岛素缺失或抵抗的原因有脂肪诱导、线粒体功能障碍、氧化应激、胰岛素受体突变、炎症因子的分泌等[25]。
脂联素是脂肪组织分泌的一种人体内主要内源性胰岛素增敏激素,其特异性缺失常常诱发胰岛素抵抗。有研究[26]证实,SIRT1可通过FoxO1途径上调脂肪组织中脂联素的表达水平,增强包括肝在内的细胞对胰岛素的敏感性。高血糖会加剧细胞线粒体活性氧的产生,SIRT1通过介导氧调节蛋白150减轻棕榈酸诱导的HepG2细胞内质网应激和胰岛素抵抗[27]。胰岛素由胰腺胰岛β细胞分泌,其合成速率受血浆葡萄糖浓度影响,胰岛β细胞功能障碍和体积减少是导致胰岛素分泌受损的主要原因[28]。研究[29]发现SIRT1可通过AMPK信号介导的脂肪酸氧化激活胰腺导管细胞的神经原3阳性内分泌祖细胞的活化,从而促进胰岛β细胞的再生。内质网应激此前已被证实与胰岛β细胞损害相关,且这一过程通常合并脂毒的发生。SIRT3通过修饰IRE1、ATF6能够拮抗氧化应激,维持和保护胰腺β细胞正常功能免受脂肪毒性并促进胰岛素的分泌[30]。以上代谢方式,离不开细胞受体的协同作用,胰岛素通过调节含有葡萄糖转运蛋白4的囊泡运输来增加肝脏、脂肪、肌肉细胞对葡萄糖的摄取[31]。当这一关键过程失调,即会导致胰岛素抵抗,而SIRT1可激活葡萄糖转运蛋白4的失常表达,促进细胞对葡萄糖的转运,减少肝脂肪聚集预防NAFL的发生[32]。综上所述,Sirtuins相关的脂糖代谢与NAFLD的发生发展息息相关。
2.3 Sirtuins与炎症 NASH组织病理学改变主要为肝细胞脂肪变性合并小叶内炎症浸润,期间可伴随纤维化的发生,是NAFLD向肝硬化和HCC过渡的中间阶段,且难以自行痊愈。NASH发生发展由多种机制所致,包括脂肪酸堆积、线粒体/内质网功能障碍、氧化应激和内毒素介导的细胞因子释放等[33]。
Sirtuins家族通过信号级联反应减缓炎症的发生,这与其修饰蛋白、沉默基因的生理功能相关[34]。氧化应激导致膜脂过氧化可使细胞结构遭到破坏,许多抗氧化酶的调节依赖于转录因子Nrf2。有研究[35]表明,SIRT6靶向调控Nrf2,使Nrf2与抗氧化反应元件结合增加Ⅱ相/抗氧化酶的表达,从而减缓因氧化应激产生的细胞炎性浸润,改善NASH。各种损伤因素诱发肝细胞对炎症因子的募集可伴随炎症瀑布效应的发生,根据近年来研究显示,Sirtuins在炎症信号通路中对抗炎抗应激有明显的正向作用。SIRT1介导的NF-κB乙酰化(ac-NF-κB)在炎症信号的激活中具有重要作用。游离脂肪酸处理的HepG2细胞中,ac-NF-κB的表达显著上调,而SIRT1的表达下调。用七叶素(SIRT1激活剂)处理HepG2细胞显著抑制了TNFα和IL-6表达的增加,减少了肝细胞炎性浸润[36]。C-Jun也是炎症主要信号通路之一,其可被SIRT6影响经由脱乙酰H3K9、AP-1或AP-1相关结合位点,下调炎症因子MCP-1、IL-6及TNFα的表达[37]。现今,Sirtuins在慢性炎症中的作用相关研究还处于非常早期的阶段,但越来越多的证据表明,在慢性炎症期间,特定组织中的NAD+水平和Sirtuins转录水平持续降低[38]。
2.4 Sirtuins与纤维化 脂肪性肝纤维化进展是NAFLD中后期病理阶段之一,终末可演变为脂肪性肝硬化。脂肪性肝纤维化主要是由肝脂质异常堆积等慢性损伤因素引起细胞外基质蛋白积累所导致,不断的纤维化进展致使肝正常结构和功能被破坏[39]。
肝星状细胞(HSC)及其分泌的因子蛋白是细胞外基质的主要来源,有研究[40]证实SIRT1可通过去乙酰化增强子EZH2阻断静止期HSC PPARγ的转录活性,减缓HSC的激活。在肝脏受到物理、化学、感染等刺激产生病理变化时,HSC增殖并激活转变为肌成纤维细胞,表达α-平滑肌肌动蛋白,合成细胞外基质[41]。肌成纤维细胞分化是肝纤维化发病机制中的一个关键过程,TGFβ是肌成纤维细胞分化的强有力诱导剂。相关研究[42]表明,SIRT1选择性抑制剂EX-527通过上调细胞中SIRT2、SIRT3和SIRT4的水平来降低TGFβ和α-平滑肌肌动蛋白的表达水平以减缓纤维化的发生,但具体机制尚未阐明。然而,另一项研究[43]显示,抑制SIRT2会导致ERK的磷酸化和c-MYC的降解,其可显著抑制人肝星状LX2细胞中成纤维基因的表达。这与上述实验结果有所出入,猜测Sirtuins在肝纤维化的过程中可能存在某种相互拮抗作用,但尚未有相关研究证实这一关系。肝脏基因敲除和HSC基因敲除SIRT6小鼠比野生型小鼠出现更严重的炎症浸润和纤维化程度,这可能与SIRT6在关键赖氨酸残基K333和K378处脱乙酰化Smad3,并减弱在HSC中由TGFβ诱导的转录活性相关[44]。肌成纤维细胞中线粒体功能常常表现一定的缺陷,SIRT7能够通过去乙酰化GABPβ-1增强线粒体稳态[45]。由此可见,Sirtuins主要通过抑制HSC激活因子预防肝纤维化的发生。
3 Sirtuins在NAFLD中的变化
NAFLD过程中,Sirtuins的表达也会发生某些改变,了解这些变化有利于更全面梳理Sirtuins在脂肪肝中的作用。一项对比研究[46]显示,与正常体质量受试者相比,超重或肥胖受试者脂肪组织中SIRT1、SIRT2、SIRT3和SIRT6 mRNA表达存在差异。除了SIRT2,所分析的基因都显示与BMI呈负相关。有趣的是SIRT2在超重组中含量最高,肥胖组最低。另有Kim等[47]发现,SIRT1能够与SIRT6启动子上的FOXO3a和NRF1形成复合物并正向促进SIRT6的表达,从而负向调节糖酵解、甘油三酯合成和脂肪分解。这预示着Sirtuins之间存在着某些正负调节和协同机制。关于Sirtuins随着BMI增高而下降的原因,在另一项研究中可能得到一些合理的解释。经棕榈酸处理过的HepG2细胞中细胞核和线粒体部分的SIRT3表达水平降低,其细胞伴随显著的活性氧诱导和凋亡以及线粒体跨膜电位的消耗[48]。
一项研究[49]报告了SIRT1水平在不同的小鼠模型和经历活化的培养HSC的肝脏中降低,SIRT1的下调与HDAC4上调平行。HDAC4在HSC激活过程中被募集到SIRT1启动子,并从SIRT1启动子中去除乙酰化组蛋白H3和H4,这导致了SIRT1反式阻遏。与其他肝细胞类型相比,SIRT6在HSC中表达最丰富,其可能对肝纤维化有特异性,但在小鼠和人的活化HSC和纤维化肝脏中SIRT6的表达却降低[50]。以上研究表明Sirtuins在肝纤维化进展中被某些机制阻遏导致其正常功能失效,诱发加重了纤维化进展。现阶段对Sirtuins的研究主要集中在挖掘功能作用、信号通路方面,涉及NAFLD中Sirtuins交互关系或表达变化等方面研究较少。近年来表观遗传学是Sirtuins研究的一个新方向,有望解答其在NAFLD中更深层次的关系[51]。
4 小结和展望
Sirtuins是治疗NAFLD的潜在靶点,它们通过多种途径参与了与NAFLD发生发展密切相关的糖脂代谢、氧化应激、炎症反应、纤维变性。大量实验研究表明其对NAFLD的干预效果是显性的,但具体机制仍未完全阐明或仅有小部分阐明。仅基于目前的研究,Sirtuins还不能应用于NAFLD的治疗。对于Sirtuins在NAFLD中完整全面的生理病理功能还需要更深入的了解,因此迫切需要更多的研究来加深对NAFLD中各种Sirtuins相互作用的理解,并开发Sirtuins的选择性激活剂/抑制剂,这对于今后攻克治疗NAFLD具有深刻意义[52]。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:宗也凯负责论文设计,收集数据,资料分析,撰写论文并最后定稿;刘江凯参与论文指导。

