雄全异株桂花不同花期光合和内源激素的变化
张 成,王小燕△,王贤荣*,段一凡*,张 敏,施大伟,朱 跃,宋炎峰,柴子涵,李 岚
(1.南京林业大学生物与环境学院,南方现代林业协同创新中心,江苏 南京 210037;2.木犀属植物栽培品种国际登录中心,江苏 南京 210037)
桂花(Osmanthusfragrans)作为我国十大传统名花之一,同时拥有罕见的雄全异株繁育系统。研究发现,雄性和两性桂花在花芽分化的早期并无差异,但在分化后期,两性株的两个心皮愈合发育成1个完整的雌蕊,而雄株的两个心皮未能愈合,最终导致雌蕊败育[1-2]。在桂花完成花芽分化之后的开花阶段,雄性和两性桂花花瓣的脱落情况差异显著。雄性桂花的花瓣在末花期大量脱落,而两性桂花花瓣脱落较少,甚至基本不脱落。由于雄性桂花花瓣脱落且方便采收,因此雄性品种桂花通常用于食品、药品和香精等产品的开发;而两性桂花能够产生种子,通常被用于播种繁殖,选育变异的新品种。
光合特性可以直接反映植物的生长发育状态,因此越来越多的研究者将光合特性用作监测植物在不同处理或胁迫下生长发育的主要生理指标[3-4]。植物的内源激素种类繁多,参与生长发育的各个阶段。在花器官发育的复杂调控过程[5-6]中,6-BA能够促进钝叶柃(Euryaobtusifolia)雄性器官的发育,而茉莉酸甲酯(MeJA)能使欧洲油菜(Brassicanapus)提前开花,但同时会引起花丝变短,导致雄性不育[7-8]。桂花在花芽分化阶段完成性别分化,然而雄性和两性桂花花瓣的脱落情况差异显著,并且缺乏花期阶段基础的生理数据。本研究比较雄性和两性桂花在不同花期的光合及内源激素含量的变化规律,为评价雄性和两性桂花生长适应性及其生理生态研究提供参考。
1 材料与方法
1.1 试验材料
供试材料为南京林业大学校园内正常生长的雄性(male,代号M)及两性(hermaphroditic,代号H)桂花,2020年9—10月依据开花状态,分别在初花期(少量开放、多数半闭合状态)、盛花期(开放量大于80%)和末花期(盛花期后2~3 d,且有陆续落花)进行光合测量并采集用于激素测定的花部组织材料。
1.2 试验方法
1.2.1 不同花期光合生理特性的测定
选取生长状况良好,无病虫害的雄性和两性桂花各4株,选取每株树冠不同方向中上部8片健康成熟的叶片,分别在初花期、盛花期和末花期天气晴朗的9:00—12:00,利用Li-6400XT(LI-COR,美国)便携式光合作用测量系统进行光合作用的测量,在光合有效辐射强度800 μmol/(m2·s)、样品室CO2流速为500 μmol/s的条件下,记录植株净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)及饱和水汽压差(Vpdl)等光合指标[9-10]。
1.2.2 不同花期花部组织激素含量的测定
本研究采用酶联免疫吸附分析法(enzyme-linked immunosorbent assay, ELISA)对生长素(IAA)、茉莉酸(JA)、脱落酸(ABA)、赤霉素(GA3)和玉米素核苷(ZRs)5种植物激素含量进行测定,每个花期的雄花和两性花均重复3次。称取新鲜的不同花期雄性和两性桂花各1 g,加2 mL样品提取液,在冰浴下研磨成匀浆,4 ℃冰箱中提取4 h,3 500 r/min离心10 min, 取上清液。沉淀中加1 mL提取液,搅匀, 4 ℃冰箱中再提取1 h,离心,合并上清液并记录体积。上清液过C-18固相萃取柱,过柱后的样品转入10 mL离心管中,真空浓缩干燥或用氮气吹干,除去提取液中的甲醇,用样品稀释液定容,摇匀后用于激素含量测定。具体测定方法参照Zhao等[11]进行。
1.2.3 数据处理
参照文献[12-13],计算如下指标:光合作用叶片的水分利用率(EWUE)=Pn/Tr,气孔限制值(LS)=(1-Ci/Ca)×100%(Ca为参比室CO2浓度),叶片羧化速率(CE)=Pn/Ci。采用Excel 2016处理数据,利用SPSS 24.0分析光合参数相关性,用Origin 2018作图。
2 结果与分析
2.1 不同花期桂花主要光合参数变化趋势
对雄性和两性桂花的初花期、盛花期和末花期进行光合作用的测定,结果见图1。根据图1可知,雄性桂花的净光合速率在3个阶段均低于两性桂花的。雄性桂花净光合速率(Pn)呈先下降再上升的趋势,两性桂花净光合速率在初花期为最高,随着花期的推移逐渐降低(图1A)。雄性和两性桂花的气孔导度(Gs)均呈先下降后上升的变化趋势,且末花期的气孔导度均大于初花期(图1A)。胞间CO2浓度(Ci)与蒸腾速率(Tr)的变化趋势一致,均随着花期的推移而逐渐上升,在末花期达到最高峰;初花期和盛花期雄性桂花的胞间CO2浓度高于两性桂花,但两性桂花从盛花期到末花期阶段内,胞间CO2浓度快速升高,最终在末花期超过雄性桂花的含量(图1B)。蒸腾速率和胞间CO2浓度变化趋势一致,都随着花期的推进而不断升高,但与胞间CO2浓度不同的是,两性桂花的蒸腾速率在不同花期均高于雄性桂花的(图1B)。

图1 雄性和两性桂花在不同花期光合作用主要参数变化趋势Fig.1 Trends of main photosynthetic parameters of male and hermaphroditic Osmanthus fragrans at different flowering stages
2.2 不同花期桂花净光合速率与蒸腾速率变化
经相关性分析(表1)可知,不同花期雄性桂花的净光合速率与气孔导度变化趋势一致,且平均相关性系数为0.634 3,达到极显著正相关(P< 0.01);与雄性桂花类似,两性桂花在不同花期的净光合速率与气孔导度也呈正相关,说明气孔导度是影响桂花净光合速率的一个主要因子;此外,两性桂花在不同花期的净光合速率与水汽压差呈极显著负相关,平均相关性为-0.481 3 (P< 0.01)。雄性和两性桂花的蒸腾速率与气孔导度和胞间CO2浓度都呈正相关,表明更大的气孔导度和更高的胞间CO2浓度会加速桂花叶片水分的蒸腾。值得注意的是,雄性桂花的净光合速率与胞间CO2浓度在初花期和末花期为极显著负相关,而两性桂花的净光合速率与胞间CO2浓度在初花期和盛花期分别为显著正相关和显著负相关。并且雄性和两性桂花的蒸腾速率与饱和水汽压差的相关性在末花期也截然相反。

表1 雄性和两性桂花净光合速率、蒸腾速率与环境因子的相关性
2.3 不同花期桂花的水分利用率、气孔限制值和叶片羧化速率
净光合速率与蒸腾速率的比值即为水分利用率(EWUE),雄性和两性桂花的蒸腾速率随着花期的推进呈不断上升趋势,净光合速率整体呈下降趋势,因此水分利用率在花期内逐渐降低;两性桂花末花期蒸腾速率迅速升高,所以导致末花期两性桂花水分利用率低于雄性桂花的(表2)。
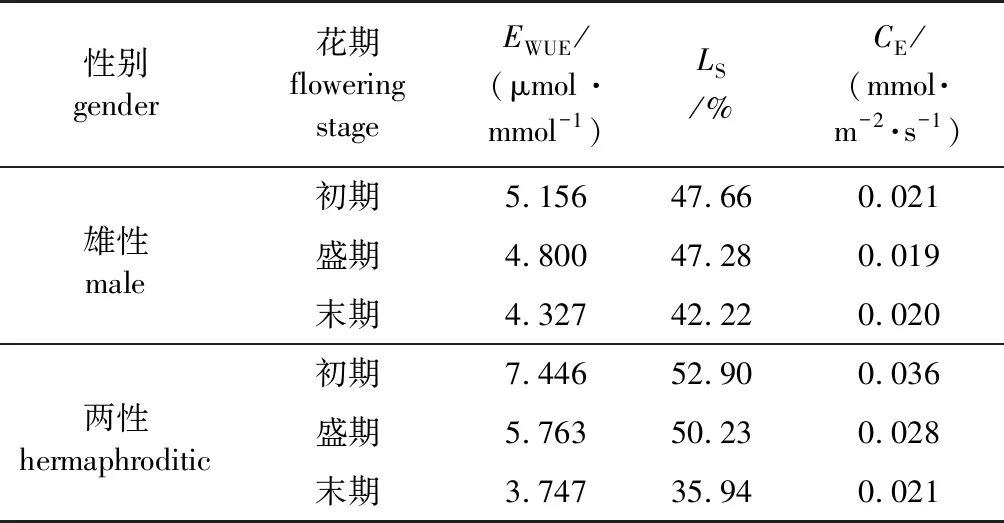
表2 雄性和两性桂花的水分利用率、气孔限制值及叶片羧化速率
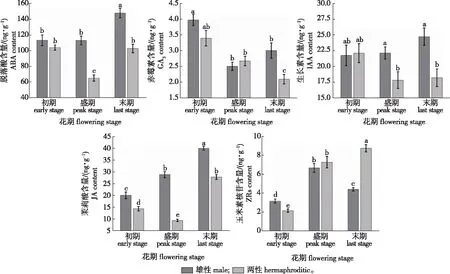
不同小写字母表示差异显著(P < 0.05)。Different lowercase letters showed significant differences(P < 0.05).图2 雄性和两性桂花在不同花期的5种激素含量Fig.2 The five hormones content in male and hermaphroditic O. fragrans at different flowering stages
在初花期和盛花期两性桂花的胞间CO2浓度低于雄性桂花,所以这两阶段的气孔限制值(LS)高于雄性桂花;但在末花期,两性桂花的胞间CO2浓度迅速升高,甚至超过雄性桂花的胞间CO2浓度,此时两性花的气孔限制值迅速降低至35.94%,低于雄花的42.22%。因此推测,不同花期的胞间CO2浓度是影响气孔限制值的关键因素。胞间CO2浓度越低,气孔限制值越大,能够进入气孔的CO2减少,光合作用降低。叶片羧化速率(CE)是净光合速率和胞间CO2浓度的比值。在3个花期内,两性桂花的净光合速率不断降低,且胞间CO2浓度持续升高,因此两性桂花的叶片羧化速率从初花期到末花期一直降低。但由于两性花的净光合速率在不同花期持续高于雄性桂花,因此在整体上,两性桂花的叶片羧化速率高于雄性桂花。
2.4 不同花期桂花的激素含量测定结果分析
利用酶联免疫吸附分析法(ELISA)对雄性和两性桂花5种植物激素进行测定(图2)。整体来看,在两性桂花中含量最高的激素为脱落酸(ABA),雄花和两性花不同花期的平均含量分别为124.75和90.72 ng/g,表明ABA在桂花的花期中发挥重要作用;含量最低的激素为赤霉素(GA3),雄花和两性花不同花期的平均含量分别为3.16和2.72 ng/g。雄花和两性花的生长素(IAA)含量在不同花期差异变化不大,雄花IAA的平均含量略高于两性花的含量,分别为22.88和19.39 ng/g。雄花的茉莉酸(JA)含量在不同花期均显著高于两性花,并且在雄花中,随着花期的延长,JA的含量逐渐升高,并在末花期达到最高峰;雄花的玉米素核苷酸(ZRs)含量在花期的变化表现为先上升在下降的趋势,而两性花的ZRs含量则一直升高。
3 讨 论
植物在长期的演化过程中为适应各种复杂的环境因素,逐渐出现了性别分化。而性别分化之后,同种植物不同性别的个体在生长特征、生理生化特性以及基因表达等方面均存在差异[14-16]。桂花为雄全异株繁育系统,同时拥有雄性和两性植株,笔者对能直接反映植物生长发育状态的光合特性以及体现植物基础生理特征的内源激素含量进行测定研究。结果表明,气孔导度与净光合速率呈正相关,并且决定了通过气孔进入细胞参与光合作用的CO2的量[17],所以两性桂花的气孔导度、净光合速率与叶片羧化速率在不同花期均大于雄性桂花。这是因为雄性桂花叶片通过光合作用积累的物质与能量只需要满足花瓣和花药的发育,但两性桂花同时也需要为后续果实的发育积累更多的物质与能量。因此,两性桂花在末花期阶段,蒸腾速率和胞间CO2浓度快速增加,导致两性桂花水分利用率变低,叶片羧化速率变慢,此时净光合速率减慢,只需为后续果实的发育提供保障。在3个花期中,两性桂花的气孔导度与ABA含量均呈现先下降后上升的趋势,整体呈正相关; 这与前人研究结果一致[18-19],即ABA作为内源激素能够调控气孔开度,并且在末花期,ABA含量的上升对果实的发育起着积极作用。
5种激素含量的测量结果表明,雄性和两性桂花GA3的含量在测量的5种激素中均为最低,IAA的含量在不同花期变化不显著,因此本研究推测,GA3与IAA两种激素在不同性别桂花的花期中可能起到的调控作用较小。此外,在两种性别的桂花中平均含量最高的激素为ABA,前人研究表明外源ABA处理能够加快牡丹(Paeoniasuffruticosa)和芍药(Paeonialactiflora)的衰老进程[20-21],而雄性桂花ABA的含量始终高于两性桂花的,并且在雄花初花期至末花期的过程中呈现上升趋势,在末花期达到峰值;与ABA的表达模式类似,雄性桂花JA的含量高于两性桂花的,并且随着花期的进行,JA的含量不断升高。在拟南芥中,JA的含量诱导H2O2的积累及衰老相关基因的表达升高,最终导致叶片衰老[22-23]。因此,笔者结合前人研究[24],推测雄花中ABA和JA的大量积累可能与雄花花瓣的衰老和大量脱落相关。ZRs与ABA、JA的表达趋势不同,ZRs在两性花中不断累积。已有研究表明ZRs在花芽分化期间含量呈上升趋势,能够促进桂花的花芽分化[25],结合本次研究花期中ZRs的变化趋势,笔者推测ZRs能够促进细胞分裂,并在开花之后果实的发育过程中也发挥积极的作用。

