神经肽PACAP27抑制线粒体依赖性细胞凋亡途径对环磷酰胺所致大鼠睾丸损伤的改善作用
廖 源,王开举,李浩僡,陈惠萍,李选逸,黄 勇
(海南医学院第二附属医院生殖科,海南 海口 570311)
不育不孕作为严重的社会问题,其中约50%以上是由男性不育引起,男性不育症的发病率逐年增加,该现象与环境污染和食品污染等多种问题有紧密关联[1-2]。男性不育的病因十分复杂,其临床上仅表现为精液中精子数目和质量下降,且精液存在异常[3]。环磷酰胺作为细胞毒性烷化剂,被临床上广泛用作抗癌剂和免疫抑制剂,除急性不良反应外,环磷酰胺还可对男性患者造成长期或永久性睾丸损伤,致使精子发生异常而不育[4]。目前,环磷酰胺引起睾丸损伤的机制尚未完全阐明,因而仍无有效的防治措施。
垂体腺苷酸环化酶激活多肽(pituitary adenylate cyclase activating polypeptide,PACAP)是一种具有多种生物活性的神经肽,最初由绵羊下丘脑提取物中分离获得,能够刺激垂体细胞中腺苷酸环化酶活性,增加环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的 形 成。PACAP38和PACAP27是PACAP的2种主要存在形式,其中PACAP27与多种生物学功能相关,可以参与细胞增殖、凋亡、氧化反应、胰岛素释放、神经递质释放 和 炎 症 反 应 等[5-8]。研 究[9]表 明:PACAP27干预能够缓解糖尿病诱导大鼠睾丸组织细胞凋亡、血管损伤和氧化应激,并发挥保护作用。因此,本研究采用环磷酰胺建立动物睾丸损伤模型,探究PACAP27对环磷酰胺所致大鼠睾丸损伤的保护作用,并阐明其可能机制,为临床治疗和改善男性不育提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器健康清洁级雄性SD大鼠60只,8周龄,体质量(230±10)g,购自海南药物研究所有限责任公司,动物生产许可证号:SCXK(琼)2020-0007,动物使用许可证号:SYXK(琼)2017-0013。环境温度(22±2)℃,湿度40%~60%,光照/黑暗各12 h循环,自由进食和饮水。环磷酰胺(上海华联制药有限公司),左卡尼汀(常州兰陵制药有限公司),PACAP27(美 国Simga公 司),促 卵 泡 激 素 (folliclestimulating hormone,FSH)、黄 体 生 成 素(luteinizing hormone,LH)和睾酮(testosterone,T)放射免疫试剂盒(北京北方生物技术研究所),苏木精-伊红(hematoxylin-eosin,HE)染色法试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性及丙二醛(malondialdehyde,MDA)水平检测试剂盒(南京建成生物工程研究所),末端脱氧核糖核酸转移酶介导的原位缺口末端标记(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒和线粒体分离纯化试剂盒(北京天根生化科技有限公司),线粒体膜通透性转换孔(mitochondrial permeablity transition pore,mPTP)检测试剂盒和JC-1荧光探针染色试剂盒(北京百奥莱博科技有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白测定试剂盒和电化学发光(electrochemiluminescence,ECL)液(上海碧云天生物研究所),兔抗人细胞色素C(cytochrome C,Cyt C)、B细 胞 淋 巴 瘤2(B-cell lymphoma-2,Bcl-2)、兔抗人Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase-3,caspase-3)和含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase-9,caspase-9)(英国Abcam公司),兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG(北京中杉金桥生物科技公司)。高速冷冻离心机购自美国Beckman Coulter公司,光学显微镜和激光共聚焦显微镜购自日本Olympus公司,全波长酶标仪购自美国MD公司,电泳检测系统购自美国BioRad公司。
1.2 动物分组和处理60只SD大鼠随机分为对照组、模型组、PACAP27组和左卡尼汀组,每组15只。对照组大鼠腹腔注射生理盐水;模型组大鼠腹腔注射环磷酰胺(20 mg·kg-1);PACAP27组大鼠腹腔注射环磷酰胺(20 mg·kg-1),1 h后注射100 μL PACAP27(1 μmol·L-1);左卡尼汀组大鼠注射环磷酰胺(20 mg·kg-1),1 h后注射左卡尼汀(100 mg·kg-1)。每日给药1次,连续5 d。给药后第3天,各组大鼠禁食过夜,10%水合氯醛麻醉,称体质量并采集血液,剖开腹腔,取睾丸称质量,计算睾丸指数。睾丸指数=大鼠双侧睾丸质量(mg)/大鼠体质量(g)。左侧睾丸置于4%多聚甲醛溶液中固定,右侧睾丸置于液氮迅速冷冻后保存于-10℃冰箱。
1.3 放射免疫法检测各组大鼠血清中FSH、LH和T水平各组大鼠采集血液后室温静置2 h,置于离心机4 000 r·min-1离心15 min,分离血清,按试剂盒说明书检测各组大鼠血清中FSH、LH和T水平。
1.4 HE染色观察各组大鼠睾丸组织病理形态表现取出保存于4%多聚甲醛溶液中固定的睾丸组织,切为0.5 mm×0.5 mm×0.5 mm组织块,常规石蜡包埋,切为厚度约5 μm石蜡组织切片,切片脱蜡脱水处理后,HE染色,经乙醇脱水和二甲苯透明后,中性树胶封片,光学显微镜观察各组大鼠睾丸组织病理形态表现并拍照。
1.5酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测各组大鼠睾丸组织中SOD和CAT活性及MDA水平取冻存睾丸组织置于玻璃匀浆器中切碎、洗涤,加入预冷氯化钠溶液,冰上研磨组织,收集匀浆液,4℃、12 000 r·min-1离心5 min,取上清液检测SOD和CAT活性及MDA水平,具体操作步骤严格按照试剂盒说明书进行。
1.6 TUNEL染色检测各组大鼠睾丸组织细胞凋亡率取制备的睾丸组织石蜡切片,置于58℃烘箱烤片2 h,滴加0.1% TritonⅩ-100、0.1%柠檬酸钠溶液,室温下通透处理,PBS缓冲液冲洗切片3次,每 次3 min,加 入50 μL TUNEL检 测 液,37℃孵育1 h,再加入过氧化物酶转化剂,继续孵育30 min,PBS缓冲液冲洗切片3次,每次3 min,滴加DAPI染液,室温避光孵育10 min,经乙醇脱水、二甲苯透明后,中性树胶封片,激光共聚焦显微镜观察并捕获图像,随机选择6个视野计数TUNEL染色阳性细胞和总细胞数,计算TUNEL染色阳性细胞百分率,即细胞凋亡率。TUNEL染色阳性细胞百分率=TUNEL染色阳性细胞数/视野下总细胞数×100%。
1.7 Western blotting法检测各组大鼠睾丸组织中线粒体凋亡途径相关蛋白表达水平使用RIPA裂解液裂解剪碎的睾丸组织,提取蛋白,BCA法测定总蛋白含量。制备10% SDS-PAGE分离胶,取各样品等量蛋白上样,120 V、90 min电泳分离蛋白,将分离后的蛋白切胶电转至PVDF膜,5%脱脂牛奶封闭液室温封闭2 h,将膜与一抗4℃孵育过夜,次日,TBST洗膜3次,每次3 min,加入对应二抗,室温下孵育1 h,TBST洗膜3次,每次3 min,加入ECL发光液可视化蛋白条带,采用Image ProPlus 5.0图像分析软件分析各蛋白条带灰度值,以GAPDH为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 线粒体分离试剂检测各组大鼠睾丸组织mPTP开放程度取睾丸组织剪碎,按照线粒体分离试剂盒方法提取组织线粒体,BCA法定量,调整浓度为1.5 g·L-1。取100 μL各组线粒体样品加入至96孔细胞培养板中,并加入37℃缓冲液,混匀,酶标仪测定540 nm波长处吸光度(A)值,室温静置1 min,加入10 μL诱导液,混匀,10 min后测定A值(A10min),计算A值降低程度,代表mPTP。ΔA(540 nm)=(A0min-A10min)/A0min。
1.9 JC-1荧光探针染色检测各组大鼠睾丸组织线粒体膜电位水平取50 μL荧光染料JC-1,加入8 mL超纯水稀释,混匀后加入2 mL JC-1染色缓冲液,配制JC-1工作液。采用JC-1染色缓冲液对JC-1工作液按5倍稀释,取0.9 mL稀释JC-1工作液,加入0.1 mL纯化线粒体,室温下避光孵育10 min,荧光显微镜观察绿色荧光和红色荧光表达,荧光酶标仪检测JC-1聚合体值(激发波和发射波波长分别为525 nm和590 nm)和JC-1单体值(激发波和发射波波长分别为490 nm和530 nm),计算线粒体膜电位水平。线粒体膜电位=JC-1聚合体值/JC-1单体值。
1.10 统计学分析采用SPASS 23.0统计软件进行统计学分析,采用Graphpad 8.3.0软件绘制统计图。各组大鼠体质量、睾丸质量和睾丸指数,血清中FSH、LH和T水平,睾丸组织中SOD、CAT活性和MDA水平,细胞凋亡率,睾丸组织中Cyt C、Bcl-2、Bax、caspase-3和caspase-9蛋白表达水平,mPTP开放程度和线粒体膜电位水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体质量、睾丸质量和睾丸指数实验前各组大鼠体质量比较差异均无统计学意义(P>0.05)。实验后,与对照组比较,模型组大鼠体质量、睾丸质量和睾丸指数均明显降低(P<0.05);与模型组比较,PACAP27组和左卡尼汀组大鼠睾丸质量和睾丸指数明显升高(P<0.05),3组大鼠体质量比较差异无统计学意义(P>0.05)。见图1。

图1 各组大鼠体质量(A)、睾丸质量(B)和睾丸指数(C)Fig.1 Body weights(A),testis weights(B)and testis indexes(C)of rats in various groups
2.2 各组大鼠血清和睾丸组织中生化指标各组大鼠血清中FSH、LH和T水平检测结果显示:与对照组比较,模型组大鼠血清中FSH、LH和T水平 明 显 降 低 (P<0.05);与 模 型 组 比 较,PACAP27组和左卡尼汀组大鼠血清中FSH、LH和T水平均明显升高(P<0.05)。见表1。
各组大鼠睾丸组织中SOD、CAT活性和MDA水平检测结果显示:与对照组比较,模型组大鼠睾丸组织中SOD和CAT活性明显降低(P<0.05),MDA水平明显升高(P<0.05);与模型组比较,PACAP27组和左卡尼汀组大鼠睾丸组织中SOD和CAT活性明显升高(P<0.05),MDA水平明显降低(P<0.05)。见表1。
表1 各组大鼠血清中FSH、LH和T水平及睾丸组织中SOD、CAT活性和MDA水平Tab.1 Levels of serum FSH,LH and T and activities of SOD,CAT and MDA levels in testis tissue of rats in various groups(n=6,±s)

表1 各组大鼠血清中FSH、LH和T水平及睾丸组织中SOD、CAT活性和MDA水平Tab.1 Levels of serum FSH,LH and T and activities of SOD,CAT and MDA levels in testis tissue of rats in various groups(n=6,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group Control Model PACAP27 L-carnitine FSH[λB/(U·L-1)]31.89±2.99 20.57±2.01*27.93±2.68△28.55±2.75△LH[λB/(U·L-1)]65.40±6.34 52.42±5.21*60.86±5.98△60.91±6.03△T[cB/(nmol·L-1)]6.86±0.66 4.27±0.41*6.20±0.61△6.47±0.63△SOD[λB/(U·mg-1)]412.52±39.34 327.82±30.09*376.96±36.01△382.71±37.61△CAT[λB/(U·mg-1)]1.25±0.12 0.17±0.01*1.01±0.09△1.05±0.10△MDA[mB/(mol·g-1)]28.35±2.80 48.63±4.69*34.22±3.37△32.98±3.17△
2.3 各组大鼠睾丸组织病理形态表现HE染色结果显示:对照组大鼠睾丸组织生精小管排列整齐,生精上皮可见不同发育阶段的生精细胞,生精细胞排列规整,管腔内可见大量精子;模型组大鼠睾丸组织生精小管排列紊乱,管腔间有较大间隙,生精上皮组织中生精细胞排列紊乱且数量减少,管腔内精子数量极少;PACAP27组和左卡尼汀组睾丸组织形态表现明显改善,生精小管排列较整齐,生精上皮组织中生精细胞数量增多,排列较规整,管腔内可见较多精子。见图2。
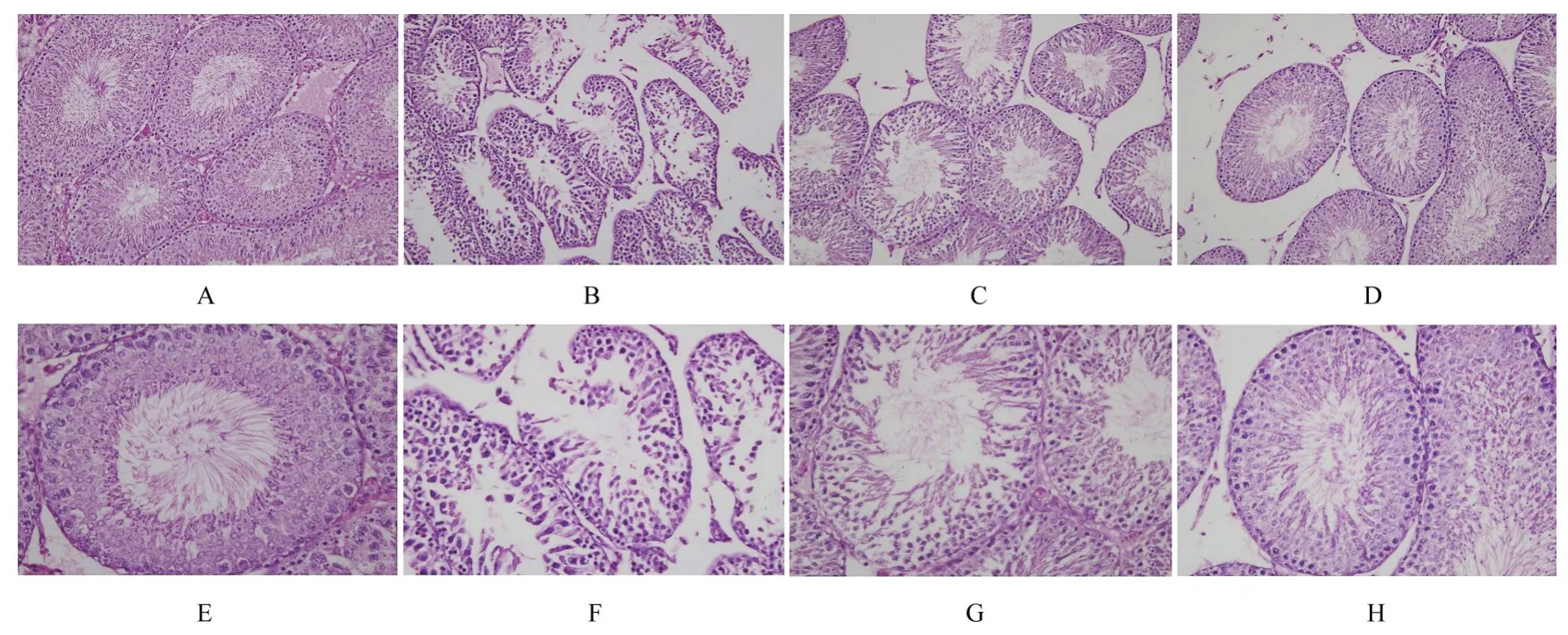
图2 各组大鼠睾丸组织病理形态表现(HE)Fig.2 Pathomorphology of testis tissue of rats in various groups(HE)
2.4 各组大鼠睾丸组织细胞凋亡率TUNEL染色结果显示:绿色荧光代表凋亡细胞,即TUNEL染色阳性细胞,对照组大鼠睾丸组织中TUNEL染色阳性细胞较少,模型组大鼠睾丸组织中TUNEL阳性染色细胞明显增加;与对照组比较,模型组大鼠睾丸组织细胞凋亡率明显升高(P<0.05)。与模型组比较,PACAP27组和左卡尼汀组大鼠睾丸组织中TUNEL染色阳性细胞明显减少,细胞凋亡率明显降低(P<0.05)。见图3和4。
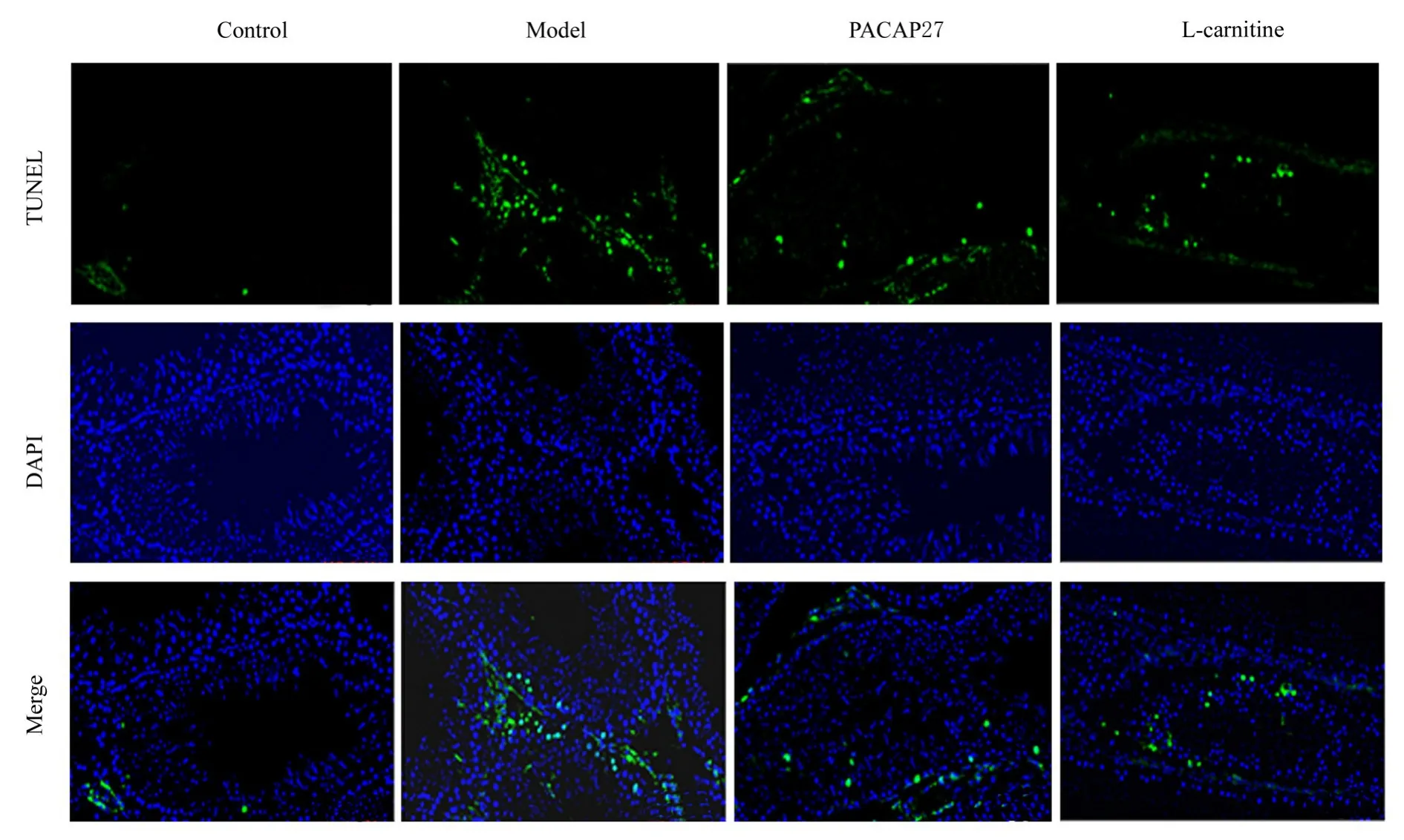
图3 TUNEL染色观察各组大鼠睾丸组织中细胞凋亡情况(×400)Fig.3 Apoptosis in testis tissue of rats in various groups observed by TUNEL staining(×400)
2.5 各组大鼠睾丸组织中线粒体凋亡途径相关蛋白表达水平Western blotting法检测结果显示:与对照组比较,模型组大鼠睾丸组织中Cyt C、Bax、caspase-3和caspase-9蛋白表达水平均明显升高(P<0.05),Bcl-2蛋白表达水平明显降低(P<0.05);与模型组比较,PACAP27组和左卡尼汀组大鼠睾丸组织中Cyt C、Bax、caspase-3和caspase-9蛋白表达水平均明显降低(P<0.05),而Bcl-2蛋白表达水平明显升高(P<0.05)。见图5。

图5 Western blotting法检测各组大鼠睾丸组织中线粒体凋亡途径相关蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A)and histogram(B)of expressions of mitochondrial apoptosis pathway-related proteins in testis tissue of rats in various groups
2.6 各组大鼠睾丸组织中mPTP开放程度mPTP开放程度检测结果显示:与对照组比较,模 型 组ΔA(540 nm)值 明 显 升 高(P<0.05),表明mPTP开放增强;与模型组比较,PACAP27组和左卡尼汀组ΔA(540 nm)值明显降低(P<0.05),表明mPTP开放受到抑制。见图6。

图6 各组大鼠睾丸组织线粒体mPTP开放程度Fig.6 Opening degrees of mPTP in testis tissue of rats in various groups
2.7 各组大鼠睾丸组织中线粒体膜电位水平与对照组比较,模型组大鼠睾丸组织中红色荧光较弱、绿色荧光较强,线粒体膜电位明显降低(P<0.05);与模型组比较,PACAP27组和左卡尼汀组大鼠睾丸组织中红色荧光较强、绿色荧光较弱,线粒体膜电位明显升高(P<0.05)。见图7和8。
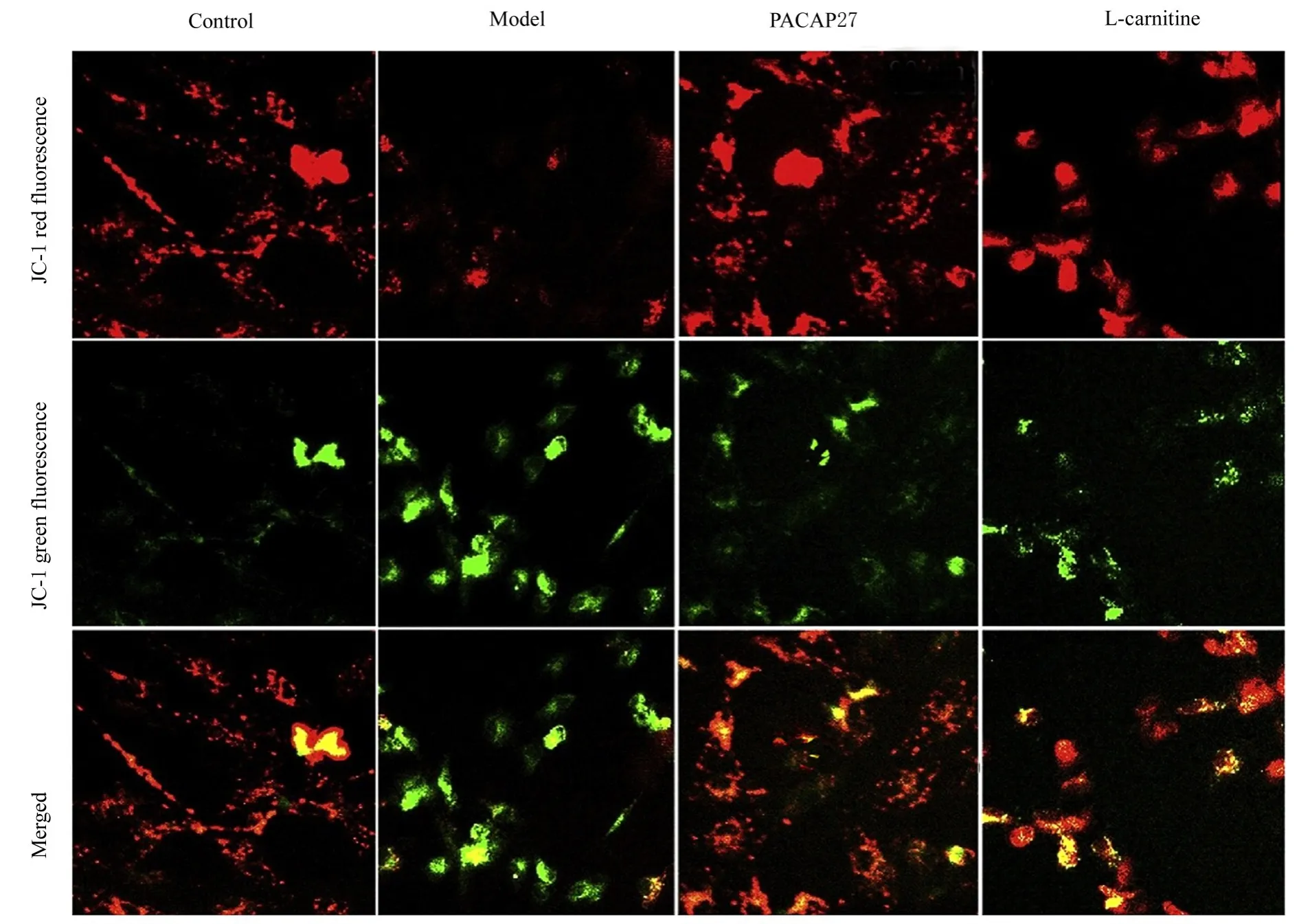
图7 JC-1荧光染色检测各组大鼠睾丸组织中线粒体膜电位(×100)Fig.7 Mitochondrial membrane potentials in testis tissue of rats in various groups detected by JC-1 fluorescence staining(×100)
3 讨 论
研究[2]显示:导致男性不育的原因众多,除遗传因素外,还与接触毒物、免疫抑制和抗癌治疗有关。近年来,主要针对改善或解决男性因素不孕症的传统男性生殖手术方面展开研究,如精索静脉曲张切除术和睾丸精子提取术,以试图扩大其适应证。尽管目前对男性不育的理解有所改进,但特发性精子异常仍占男性不育症的30%左右[10]。

图4 各组大鼠睾丸组织细胞凋亡率Fig.4 Apoptotic rates in testis tissue of rats in various groups
男性不育与化疗药物、长期使用皮质类固醇、钙通道阻滞剂、α-受体阻滞剂、5-α还原酶抑制剂或T替代疗法等药物的使用有关[3,11-13]。该药物通常是在未讨论对当前或未来生育能力可能产生影响的情况下使用的,但其可能会改变精液参数、减少精子发生甚至导致性功能障碍和射精功能障碍[14]。因此,抑制睾丸生殖细胞损伤和恢复睾丸组织结构的完整性,探究引起精子异常的分子和遗传因素,能够更好地了解男性因素不育的病因,从而改善患者预后并提高患者的生活质量。
本研究采用环磷酰胺建立大鼠睾丸损伤模型,结果显示:大鼠体质量、睾丸质量和睾丸指数均降低,睾丸组织发生明显病理损伤,如生精小管间隙变大、管腔内生精细胞排列紊乱、数目减少及坏死脱落等,提示环磷酰胺诱导大鼠睾丸发生损伤,动物实验模型建立成功。本研究结果显示:大鼠血清中FSH、LH和T水平降低。FSH、LH和T在精子发生和精子成熟中均具有重要作用。T是精子发生过程中的主要雄激素,可促进血睾屏障维持、增加精子的黏附和成熟精子的释放[15]。促性腺激素释放激素在控制精子发生方面具有核心作用,可通过诱导垂体前叶分泌FSH和LH来发挥作用,其中LH能够刺激成熟的Leydig细胞产生T,而FSH水平升高可促进精原细胞、精母细胞和精子细胞数目增加[16-17]。本研究结果显示:PACAP27组大鼠血清中FSH、LH和T水平均明显升高。
环磷酰胺为前药,由肝细胞色素P-450激活形成4-羟基环磷酰胺,再通过化学过程分解转化为磷酰胺氮芥和丙烯醛,或由醛脱氢酶介导生成无活性代谢物羧乙基磷酰胺氮芥。磷酰胺氮芥是主要的活性代谢物,可诱导DNA交联,形成阻止DNA复制的加合物,也会影响线粒体,导致跨膜电位和细胞溶 质Cyt C积 累 的 降 低[18-19]。研 究[20]表 明:环 磷酰胺导致组织损伤主要是由于机体内氧化与抗氧化平衡被破坏,致使过氧化物质损伤组织中大量细胞。本研究结果显示:环磷酰胺作用后大鼠睾丸组织中SOD和CAT活性降低,MDA水平升高,提示环磷酰胺致损伤的机制之一可能是引发自由基损伤;而经PACAP27干预后,模型大鼠睾丸组织中SOD和CAT活性均升高,MDA水平降低,提示PACAP27在大鼠睾丸损伤中发挥抗氧化作用。
线粒体是机体活性氧生成、能量代谢和细胞凋亡的重要整合细胞器,在正常生理状态下较为稳定,但当受到不良刺激时可导致一系列不良反应发生,从而致使细胞凋亡。已有研究[21]表明:抗氧化防御失衡通常伴随线粒体功能受损,而线粒体依赖性凋亡途径是细胞凋亡重要途径之一。线粒体依赖性凋亡途径被氧化应激激活,线粒体介导的细胞凋亡受Bcl-2家族蛋白中促凋亡蛋白和抗凋亡蛋白之间表达平衡的高度调节,一旦该平衡被打破,将引起线粒体膜电位丧失。线粒体膜电位去极化触发Cyt C由线粒体膜间隙释放至细胞质中,与衔接蛋白凋亡蛋白酶激活因子-1结合形成凋亡体,随后裂解并激活下游的caspase家族蛋白,从而诱导线粒体凋亡发生[22-24]。mPTP是位于线粒体内膜上的非选择性电导孔,其开放可引起线粒体肿胀和外膜破裂,释放促凋亡蛋白,是线粒体凋亡途径中的一个关键靶点[25]。本研究结果显示:经PACAP27干预环磷酰胺作用大鼠能够抑制睾丸组织细胞凋亡,下调Cyt C和促凋亡蛋白Bax、caspase-3和caspase-9表达,上调抗凋亡蛋白Bcl-2表达,线粒体膜电位升高并抑制mPTP开放,提示PACAP27可能通过调控线粒体依赖性凋亡途径对环磷酰胺所致睾丸损伤大鼠起到保护作用。
综上所述,PACAP27通过抑制线粒体依赖性细胞凋亡途径缓解环磷酰胺所致大鼠睾丸损伤,其机制与抑制氧化应激反应、mPTP开放及线粒体膜电位降低,减少线粒体内Cyt C释放进而抑制凋亡级联反应有关。本研究为PACAP27对线粒体功能作用研究提供了新的思路,也对环磷酰胺所致睾丸损伤分子机制提出了新的见解。

图8 各组大鼠睾丸组织中线粒体膜电位水平Fig.8 Levels of mitochondrial membrane potentials in testis tissue of rats in various groups

