苍术挥发油和苍术醇提物对溃疡性结肠炎模型小鼠的改善作用及其效果比较
林 雄,瞿领航,许 静,刘春莲,李水清,刘艳菊,2
(1.湖北中医药大学药学院中药炮制教研室,湖北 武汉 430065;2.湖北省中药炮制工程技术研究中心,湖北 武汉 430065)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因未明的慢性非特异性肠道炎症,临床主要表现为腹痛、腹泻和黏液脓血便等。目前,治疗UC的药物包括氨基水杨酸类药物、糖皮质激素类药物、免疫抑制剂、抗生素、益生菌和生物制剂等,但长期使用会产生较大毒副作用[1]。UC与中医学中的“泄泻”、“久痢”和“休息痢”等病相对应[2]。中药对UC治疗表现出多系统、多环节和多靶点调控的特点。近年来,中药治疗UC显现良好疗效,且副作用小。
苍术为菊科植物茅苍术或北苍术的干燥根茎,始载于《神农本草经》,称为“术”,味苦温,主风寒湿痹死肌[3]。苍术是中医临床常用中药,现代药理研究[4]表明:苍术具有抗胃溃疡、抗菌、抗病毒和增强免疫等作用。在胃肠道疾病治疗方面,苍术对于改善湿阻中焦、脘腹胀满和泄泻等症状效果明显。中医古籍记载,苍术具有治疗泄泻、久痢等病症的功效,如《丹溪心法》载有“泄泻,有湿、火、气虚、痰积。湿用四苓散加苍术,甚者苍白二术同加,炒用燥湿兼渗泄”。苍术挥发油和醇提物在抗炎和肠道屏障保护等方面作用较强。研究[5-6]显示:苍术挥发油能够通过抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β) 和 白 细 胞 介 素6(interleukin-6,IL-6)等表达而改善类风湿性关节炎,可通过保护肠道屏障而改善肠易激综合征。苍术醇提物可通过抑制蛋白激酶B(protein kinase B,Akt)/核 因 子-κB(nuclear factor-κB,NF-κB)信号通路发挥抗炎作用来改善胃溃疡,焦苍术醇提物较其水提物抗腹泻作用更强[7-8]。然而,目前关于苍术对UC动物模型治疗作用的研究鲜见报道。相较于苍术挥发油,苍术醇提物中除含挥发油类脂溶性成分外,还含有水溶性成分。本研究以UC小鼠为模型,对苍术挥发油和醇提物2种提取物进行药效研究,探讨其对UC模型小鼠症状的改善作用,并确定最佳有效部位。旨在挖掘苍术的潜在功效,为扩大其临床用药和新药开发提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF级BALB/c小鼠,雄性,40只,体质量18~22 g,由三峡大学提供,动物生产许可证号:SCXK(鄂)2017-0012。小鼠饲养于清洁级环境中,自由进食和饮水,环境温度为(22±2)℃,湿度为(55±5)%,12 h光照和12 h黑暗循环,适应性饲养5 d后开始实验。苍术采自湖北省英山县,经湖北中医药大学药学院杨红兵教授鉴定为菊科苍术属植物茅苍术的干燥根茎;葡聚糖硫酸钠(dextran sodium sulfate,DSS)购自美国MP Biomedicals公司,柳氮磺吡啶肠溶片购自上海信谊天平药业有限公司,无水乙醇和吐温80购自国药集团化学试剂有限公司,隐血试剂盒和髓过氧化物酶(myeloperoxidase,MPO)试剂盒购自南京建成生物工程研究所,通用型组织固定液购自武汉赛维尔生物科技有限公司,TRIzol购自安迪福诺生物科技有限公司,Q RT SuperMix for qPCR和SYBR qPCR Master Mix购 自 南 京 诺 唯赞生物科技股份有限公司,TNF-α、IL-6单克隆抗体和IL-1β多克隆抗体购自武汉三鹰生物技术有限公司。病理切片机购自上海徕卡仪器有限公司,NIKON ECLIPSE CI型正置荧光显微镜购自日本尼康公司,1580R型离心机购自韩国Gene Company Limited公司,Nano-600型超微量核酸蛋白测定仪购自上海嘉鹏科技有限公司,qTOWER3 G型PCR仪 购自德国Analytik Jena AG公司。
1.2 实验药物制备称取DSS试剂3.5 g,纯水溶解制得3.5% DSS溶液。称取苍术饮片200 g,经打粉,水蒸气蒸馏法制得苍术挥发油,密封后置于-20℃环境中保存备用。苍术挥发油得率=(挥发油质量/饮片质量)×100%。经计算苍术挥发油得率为5%。取适量苍术挥发油,加入1%(W/V)吐温80,纯水溶解制得18.5 g·L-1(生药量369 g·L-1)苍术挥发油。称取苍术饮片200 g,经打粉,80%乙醇超声提取,过滤,滤液旋蒸浓缩并真空干燥后得苍术醇提物浸膏,置于-20℃环境中保存备用。苍术醇提物得率=(醇提物质量/饮片质量)×100%。经计算苍术醇提物得率为30%。取适量苍术醇提物,加入1%(W/V)吐温80,纯水溶解制得110.7 g·L-1(生药量369 g·L-1)苍术醇提物。称取柳氮磺吡啶0.25 g,纯水溶解制得25 g·L-1柳氮磺吡啶。
1.3 实验动物分组造模40只小鼠随机分为正常组、模型组、苍术挥发油组、苍术醇提物组和柳氮磺吡啶组,每组8只。自第1天起,正常组小鼠自由饮用纯水,其余各组小鼠自由饮用3.5% DSS溶液,每2 d更换一次纯水和新配制的DSS溶液[9]。苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠自 第2天 起 均 按10 mL·kg-1灌胃给药,每 日1次,共7 d。依据现版《中国药典》[3]规定苍术饮片用量为3~9 g,以成人体质量60 kg用药剂量为9 g计,按照小鼠与人剂量换算系数12.3计算,饮片给药剂量为1.845 g·kg-1,根据预实验并结合本课题组前期研究结果[10],以2倍剂量即3.690 g·kg-1为给药剂量,同时计算出苍术挥发油组给药剂量为0.185 g·kg-1,苍术醇提物组给药剂量为1.107 g·kg-1,柳氮磺吡啶组给药剂量为0.250 g·kg-1。
1.4 测量各组小鼠体质量和计算疾病活动指数(disease activity index,DAI)评分自实验第1天起,每天于相同时间段内,称量并记录各组小鼠体质量,计算各组小鼠体质量变化率,观察并记录各组小鼠大便性状及便血情况,按照隐血试剂盒说明检测小鼠大便隐血情况,按参考文献[11]计算DAI评分标准(表1)。体质量变化率=(起始体质量-实验当天体质量)/起始体质量×100%,DAI评分=体质量变化评分+大便性状评分+隐血或血便评分。

表1 各组小鼠DAI评分标准Tab.1 DAI score standard of mice in various groups
1.5 测量各组小鼠结肠长度和计算脾脏系数末次给药后处死小鼠,取小鼠结肠和脾脏。直尺测量结肠自然长度,并拍照。滤纸吸干脾脏外表面血液,称量并记录小鼠脾脏质量。脾脏系数=小鼠脾脏质量/小鼠体质量。
1.6 检测各组小鼠结肠组织MPO活性冰生理盐水清洗结肠,剪取约1 cm远端结肠,置于4%多聚甲醛中固定48 h以上,其余部分装入离心管中,于-80℃条件下保存备用。称取适量冻存结肠组织,按照MPO检测试剂盒说明书方法检测结肠组织MPO活性,单位为U·g-1组织湿重。
1.7 HE染色观察各组小鼠结肠组织病理形态表现取多聚甲醛固定的结肠组织,经脱水、石蜡包埋和组织切片后,HE染色。光学显微镜下观察小鼠结肠组织结构、黏膜、杯状细胞、绒毛排列和炎性细胞浸润等形态表现并拍照。
1.8 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平称取适量冻存的结肠组织,加入1 mL TRIzol,4℃下研磨,加入200 μL三氯甲烷,震荡后静置;取离心后上清液,加入500 μL异丙醇,涡旋后静置;弃上清,加入75%乙醇,涡旋后离心,弃上清,提取总RNA。加入适量DEPC水溶解RNA,采用超微量核酸蛋白测定仪检测RNA纯度和浓度,按照Q RT SuperMix for qPCR试剂盒说明将其逆转录为cDNA。cDNA按照SYBR qPCR Master Mix试剂盒说明进行循环扩增。PCR引物由北京擎科生物科技有限公司提供,以β-actin为内参。β-actin上 游 引 物 为5′-TGCTGTCCCTGTATGCCTCT-3′,下 游 引 物 为5′-TTTGATGTCACGCACGATTT-3′,长 度224 bp;TNF-α上 游 引 物 为5′-TATGGCTCAGGGTCCAACTC-3′,下 游 引 物 为5′-GCTCCAGTGAATTCGGAAAG-3′, 长 度140 bp;IL-1β上游引物为5′-TCCAGGATGAGGACATGAGCAC-3′,下 游 引 物 为5′-GAACGTCACACACCAGCAGGTTA-3′,长 度105 bp;IL-6上 游 引 物 为5′-AGACAAAGCCAGAGTCCTTCAGAGA-3′,下 游 引 物 为5′-GCCACTCCTTCTGTGACTCCAGC-3′,长 度146 bp。采 用2-ΔΔCt法计算各组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平。
1.9 免疫组织化学法检测各组小鼠结肠组织中炎症因子阳性表达情况各组小鼠结肠组织石蜡块切片脱蜡后抗原修复,4℃一抗和二抗孵育,显色并采用苏木素复染细胞核,梯度乙醇脱水并封片。光学显微镜下观察各组小鼠结肠组织中TNF-α、IL-1β和IL-6阳性表达情况,其中蓝色为细胞核,棕黄色为相应炎症因子的阳性表达。
1.10 阿利新蓝-过碘酸-雪夫(alcian blue-periodic acid-Schiff,AB-PAS)染色观察各组小鼠结肠组织中杯状细胞数各组小鼠结肠组织石蜡块切片经二甲苯脱蜡和梯度乙醇脱水后,采用AB染色液染色,过碘酸溶液浸泡并加入Schiff试剂反应,梯度乙醇脱水,二甲苯透明,封片。光学显微镜下观察各组小鼠结肠组织中杯状细胞数,酸性黏液物质呈蓝色,糖原和中性黏液物质呈红色。
1.11 统计学分析采用GraphPad Prism 8.0统计软件进行统计学分析。各组小鼠体质量、DAI评分、结肠长度、脾脏系数、结肠组织中MPO活性和结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体质量和DAI评分与正常组比较,模型组小鼠体质量自第5天降低,第7和8天明显降低(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠第7和8天体质量均升高,但差异无统计学意义(P>0.05),见表2。与正常组比较,模型组小鼠DAI评分第4~8天升高(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠DAI评分第6~8天明显降低(P<0.05)。见表3。
表2 各组小鼠体质量Tab.2 Body weights of mice in various groups (n=8,±s,m/g)

表2 各组小鼠体质量Tab.2 Body weights of mice in various groups (n=8,±s,m/g)
*P<0.05 compared with normal group.
Group Normal Model Atractylodes rhizome oil Atractylodes ethanol extract Sulfasalazine Body weight(t/d)1 21.35±1.08 21.75±1.19 21.66±0.72 21.46±1.47 21.56±0.29 2 21.61±1.28 22.08±1.09 21.61±0.97 21.45±1.97 21.92±0.25 3 21.63±1.51 22.32±1.05 21.77±0.48 22.25±2.24 22.20±0.12 4 22.11±1.60 22.60±1.01 21.01±1.24 22.29±2.35 21.98±0.22 5 22.60±1.39 22.47±1.29 20.94±1.09 22.38±2.02 22.12±0.31 6 22.70±1.36 21.57±1.36 21.09±1.01 21.94±2.28 21.74±0.39 7 22.89±1.41 20.38±1.47*20.65±0.97 21.19±2.51 21.31±0.73 8 22.91±1.49 18.97±1.59*20.21±1.13 20.10±2.89 20.22±0.68
表3 各组小鼠DAI评分Tab.3 DAI scores of mice in various groups (n=8,±s)

表3 各组小鼠DAI评分Tab.3 DAI scores of mice in various groups (n=8,±s)
*P<0.05 compared with normal group;△P<0.05 compared with model group.
Group Normal Model Atractylodes rhizome oil Atractylodes ethanol extract Sulfasalazine DAI(t/d)1 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 2 0.00±0.00 0.57±0.53 0.43±0.54 0.50±0.93 0.00±0.00 3 0.00±0.00 1.00±0.82 0.14±0.38 0.13±0.35 0.00±0.00 4 0.00±0.00 2.00±0.82*1.29±1.11 0.63±0.52 1.00±1.56 5 0.17±0.41 2.71±1.38*1.71±1.38 1.13±1.13 1.50±1.92 6 0.00±0.00 5.29±2.50*2.43±2.23△2.88±3.31△2.50±3.11△7 0.00±0.00 7.71±1.80*1.29±2.98△2.38±2.93△2.75±4.19△8 0.00±0.00 11.00±1.41*5.43±2.94△7.00±2.67△5.50±3.87△
2.2 各组小鼠结肠长度、脾脏系数和MPO活性与正常组比较,模型组小鼠结肠长度明显缩短(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠结肠长度明显增加(P<0.05)。与正常组比较,模型组小鼠脾脏系数明显增大(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠脾脏系数明显减小(P<0.05)。与正常组比较,模型组小鼠结肠组织中MPO活性明显升高(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠结肠组织中MPO活性明显降低(P<0.05)。见表4。
表4 各组小鼠结肠长度、脾脏系数和MPO活性Tab.4 Colon lengths,spleen coefficients and MPO activities of mice in various groups (n=8,±s)
表4 各组小鼠结肠长度、脾脏系数和MPO活性Tab.4 Colon lengths,spleen coefficients and MPO activities of mice in various groups (n=8,±s)
*P<0.05 compared with normal group;△P<0.05 compared with model group.
Group Normal Model Atractylodes rhizome oil Atractylodes rhizome ethanol extract Sulfasalazine Colon length(l/cm)8.97±0.70 5.70±0.27*6.30±0.49△6.48±0.48△6.83±0.75△Spleen coefficient 3.43±0.20 4.40±0.55*3.60±0.30△3.64±0.28△3.72±0.80△MPO activity[λB/(U·g-1)]0.63±0.22 2.17±0.25*1.60±0.22△1.48±0.12△1.39±0.12△
2.3 各组小鼠结肠组织病理形态表现正常组小鼠结肠组织结构完好,黏膜完整,杯状细胞和绒毛排列整齐,无明显水肿和炎性细胞浸润,肌层厚薄均匀适中,无异常。与正常组比较,模型组小鼠结肠组织结构明显被破坏,杯状细胞和绒毛排列不整齐或缺失,有大量的炎性细胞浸润,且肌层明显增厚。与模型组比较,苍术挥发油组小鼠结肠组织结构损伤得到改善,黏膜较完整,杯状细胞及绒毛排列较均匀,但仍有少量炎性细胞浸润,肌层增厚未得到明显改善;苍术醇提物组小鼠结肠组织结构更接近于正常组,黏膜完整,杯状细胞及绒毛排列较整齐,炎性浸润明显减少,肌层厚薄适中;柳氮磺吡啶组小鼠结肠组织结构完整,黏膜较为完整,杯状细胞排列均匀,无明显绒毛减少或缺失,无明显炎性浸润,肌层基本无异常。见图1。

图1 各组小鼠结肠组织病理形态表现(HE,×100)Fig.1 Pathomorphology of colon tissue of mice in various groups(HE,×100)
2.4 各组小鼠结肠组织中炎症因子mRNA表达水平RT-qPCR检测结果显示:与正常组比较,模型组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平明显升高(P<0.05);与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平明显降低(P<0.05);与苍术挥发油组比较,苍术醇提物组小鼠结肠组织中TNF-α、IL-1β和IL-6mRNA表达水平降低(P<0.05)。见表5。
表5 各组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平Tab.5 Expression levels of TNF-α,IL-1β and IL-6 mRNA in colon tissue of mice in various groups(n=8,±s)

表5 各组小鼠结肠组织中TNF-α、IL-1β和IL-6 mRNA表达水平Tab.5 Expression levels of TNF-α,IL-1β and IL-6 mRNA in colon tissue of mice in various groups(n=8,±s)
*P<0.05 compared with normal group;△P<0.05 compared with model group;#P<0.05 compared with Atractylodes rhizome oil group.
Group Normal Model Atractylodes rhizome oil Atractylodes rhizome ethanol extract Sulfasalazine TNF-α 1.00±0.31 2.63±0.16*1.54±0.16△1.22±0.16△#1.06±0.21△IL-1β 1.00±0.51 5.69±1.36*2.89±0.96△2.72±1.05△#2.36±0.70△IL-6 1.00±0.16 53.03±15.26*2.31±0.74△1.40±0.86△#4.17±1.23△
2.5 各组小鼠结肠组织中炎症因子阳性表达情况免疫组织化学检测结果显示:与正常组比较,模型组小鼠结肠组织中TNF-α、IL-1β和IL-6阳性表达增加;与模型组比较,苍术挥发油组、苍术醇提物组和柳氮磺吡啶组小鼠结肠组织中TNF-α、IL-1β和IL-6阳性表达减少。见图2。

图2 各组小鼠结肠组织炎症因子表达情况(免疫组织化学,×100)Fig.2 Expressions of inflammatory factors in colon tissue of mice in various groups(Immunohistochemistry,×100)
2.6 各组小鼠结肠组织中杯状细胞数与正常组比较,模型组小鼠结肠组织中杯状细胞数明显减少;与模型组比较,苍术挥发油组小鼠结肠组织中杯状细胞数增多,苍术醇提物组和柳氮磺吡啶组小鼠结肠组织中杯状细胞数明显增多。见图3。
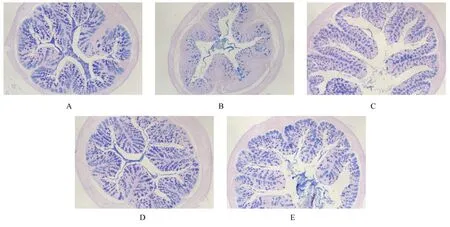
图3 各组小鼠结肠组织中杯状细胞(AB-PAS,×100)Fig.3 Goblet cells in colon tissue of mice in various groups(AB-PAS,×100)
3 讨 论
UC作为炎症性肠道疾病,其发病率逐年上升[12]。目前,关于UC的确切病因和发病机制尚未完全阐明。UNGARO等[1]报道:UC受遗传、免疫、感染、环境和饮食等多种因素综合影响,致使患者肠黏膜屏障受损,免疫平衡失调,肠道局部溃疡进而发展为UC。炎症反应是UC发生发展中的重要表征,同时患者肠道屏障受到严重破坏。MPO由中性粒细胞产生并释放,炎症反应发生时会有大量的中性粒细胞浸润,MPO可作为中性粒细 胞 的 标 志 物 来 评 价UC的 严 重 程 度[13]。UC患 者肠黏膜通透性增加,细菌或抗原侵入黏膜固有层,激活免疫细胞,释放大量炎性因子,包括TNF-α和IL-1β等,导致细胞间的紧密连接受损,屏障功能缺陷,进而发生炎症反应[14]。IL-6过表达导致肠上皮细胞电解质紊乱,皮内细胞肿胀,肠道通透性增强。IL-6表达水平可作为UC炎症反应评判程度参考[15]。本研究选择TNF-α、IL-1β和IL-6为炎症评价指标。结肠组织杯状细胞含大量的黏液颗粒,在肠黏膜表层形成一层致密的黏液层,与其他细胞共同维持肠道稳态[16]。炎症因子的释放导致杯状细胞和黏液层损伤,肠道黏膜屏障破坏,杯状细胞及其分泌物形成的黏液层在维持肠道屏障中起到 重 要 作 用[17]。ALIPOUR等[18]研 究 表 明:UC患者结肠组织中杯状细胞数明显减少,黏液层严重破坏。苍术长于燥湿健脾,临床多用于治疗胃肠道疾病,能够防治胃肠道疾病,与UC病因病机相符[19]。
研究[5,20]表明:茅苍术及其麸炒品对胃溃疡大鼠具有明显的抗炎作用,可下调IL-6等炎性因子和炎性介质的表达。苍术素能够通过抑制促炎因子TNF-α、IL-1β和IL-6等表达,抑制大鼠空肠上皮组织炎症[21]。苍术炮制品能够恢复结肠组织结构损伤,抑制杯状细胞数减少,维持肠道黏膜完整性,对肠道损伤具有保护作用[8]。目前关于苍术对DSS诱导UC模型小鼠的治疗作用研究尚未见报道。
DSS诱导的UC小鼠模型是目前病理和生理状态最接近人体的小鼠模型,其症状和组织学改变与人类结肠炎相似[9]。DSS诱导的UC小鼠会出现体质量减轻、腹泻和结直肠出血等症状,与结直肠变薄和缩短、肠系膜淋巴结及脾脏增大有关。DSS诱导UC小鼠结肠组织形态表现包括杯状细胞和绒毛排列混乱,隐窝结构混乱,炎性细胞侵入固有层和黏膜下层等。本研究结果显示:UC小鼠体质量降低,出现腹泻、隐血或便血症状,DAI评分升高,结肠长度明显缩短,脾脏系数增大,出现炎症反应,结肠组织损伤和肠道屏障破坏等,造模成功。苍术挥发油或苍术醇提物干预后,UC小鼠体质量降低减缓,腹泻、隐血或便血症状减轻,结肠长度缩短和脾脏系数增大被抑制,表明苍术挥发油和苍术醇提物能够有效改善UC。本研究结果显示:UC小鼠给予苍术挥发油或醇提物后结肠组织结构损伤得到恢复,结肠组织MPO活性和炎性因子TNF-α、IL-1β及IL-6表达下调,表明炎性反应被一定程度抑制;AB-PAS染色显示:杯状细胞数增多,表明肠道屏障被有效保护。综上所述,苍术挥发油和醇提物均能改善UC小鼠症状,在同等剂量条件下,苍术醇提物对UC小鼠改善作用更强。
本研究从苍术的中医主治功能出发,探讨其对类似“泄泻”和“久痢”等症的UC的治疗作用。本研究结果表明:苍术能够明显改善UC症状,且苍术醇提物对UC症状的改善作用更好,从现代药理实验证明苍术对UC的治疗作用,挖掘苍术临床上的潜在功能,为其新药开发提供参考。

