黄芪对大黄诱导大鼠腹泻的治疗作用及其机制
庄雪峰,律广富,林 贺,黄晓巍,周 佳,李禹墨,赵嘉睿,林 喆,王雨辰
(长春中医药大学药学院中药药理学实验室,吉林 长春 130117)
慢性腹泻是一种由脾脏生理功能紊乱引起的胃肠道疾病,以排便次数增多、稀便或伴有脓血为主要症状[1]。慢性腹泻的发生发展与肠道屏障的完整性、肠道炎症性病变和肠道菌群有密切关联[2]。当肠道屏障受损时,肠道通透性增加,导致由肠道菌群产生的肠道内毒素水平升高,并输送至循环系统,进而促进肠道内毒素积累和肠道细胞的炎症反应[3]。内毒素在肠道中的积累可以通过激活Toll样受体(Toll-like receptor,TLR),而Toll样受体4(Toll-like receptor 4,TLR4)/肿瘤坏死因子受体相关因子6(tumor necrosis factor receptorassociated factor 6,TRAF6)/核因子κB(nuclear factor-κB,NF-κB)信号通路是相关通路之一。肠道炎症发生后,肠道无法维持正常新陈代谢,进而导致腹泻等一系列症状[4-5]。同时,肠道炎症会进一步破坏肠道屏障,导致肠道菌群失衡[6]。因此,恢复肠道屏障的完整性、维持肠道微生物的平衡和减少肠道炎症是目前治疗慢性腹泻药物的主要作用机制[7]。黄芪是常用的补气中药之一。现代药理学研究[8]显示:黄芪具有促进机体新陈代谢、清除自由基、抗衰老、增强机体抗病力、降血压、保护心脏和保护肝脏等作用。临床上黄芪建中汤和黄芪注射液多用于治疗小儿慢性腹泻[9]。然而,黄芪治疗慢性腹泻的具体机制目前尚未完全阐明。本研究采用灌胃大黄水提液结合饮食不节方法制备大鼠慢性腹泻模型,探讨黄芪水煎液对模型大鼠结肠组织中TLR4/TRAF6/NF-κB信号通路相关蛋白的影响,阐明其对肠道屏障、肠道炎症和肠道菌群的作用。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器选取50只健康雄性Wistar大鼠,体质量(200±20)g,由长春亿斯实验动物技术有限公司提供,动物生产许可证号:SCXK(吉)2020-0002。本研究严格按照中国国家卫生研究院《实验动物保护与使用指南》建议进行。动物实验方案经吉林省实验动物质量检测中心和长春中医药大学伦理委员会批准(批准号:2021058),实验动物护理、使用和治疗的所有实验程序均遵循中国国家动物福利法规定。光照/黑暗周期为12 h,环境温度23℃~25℃,湿度40%~70%,适应性饲养1周后于长春中医药大学实验动物中心饲养,实验动物使用许可证号:SYXK(吉)2018-0014。大黄购自吉林国安药业股份有限公司。黄芪由长白山职业技术学院提供,采自吉林省农安县(东经124°36′3"7,北纬44°56′47")。按照《中国药典》2020年版[10]要求,将黄芪去除杂质,按大小分开,洗净,充分湿润,切成厚片,阴干,黄芪煎煮并浓缩至0.135和0.065 g·mL-1;大黄采用粉碎机粉碎,加入适量水浸泡大黄粉末,混合物60℃环境下保持过夜后过滤,低温下使用旋转蒸发器浓缩至1 g·mL-1。参苓白术散(山西省华康药业股份有限公司),BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),Protein Marker和ECL发光试剂盒(上海碧云天生物技术有限公司),苏木精-伊红(hematoxylin-eosin,HE)染液、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、白细胞介素6(interleukin-6,IL-6)试剂盒、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素10(interleukin-10,IL-10)试剂盒、胃泌素(gastrin,GAS)试剂盒和胃动素(motilin,MTL)试剂盒(长春维尔科特科技有限公司),丙二醛(malondialdehyde,MDA)试剂盒、白细胞介素1β(interleukin-1β,IL-1β)试剂盒和分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)试剂盒(江苏酶免实业有限公司),蛋白酶激活受体2(protease activated receptor-2,PAR-2)、p38、磷酸化p38(phosphorylated p38,p-p38)、肌球 蛋 白 轻 链 激 酶 (myosin light-chain kinase,MLCK)、肌 球 蛋 白 轻 链(myosin light chain,MLC)、闭锁蛋白1(zonula occludens-1,ZO-1)、闭合蛋白(Occludin)、TLR4、髓样分化因子88(myeloid differentiation factor 88,MyD88)、NF-κB和 甘 油 醛-3-磷 酸 脱 氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(武汉三鹰生物技术有限公司),磷酸化MLC(phosphorylated MLC,p-MLC)一抗(美国Cell Signaling Technology公司),TRAF6一抗(英国ABCOM公司)。酶标仪(型号:Multiskan FC)和-80℃超低温冰箱(型号:ULT1386-3-V41)(美国赛默飞世尔科技公司),电泳仪、电泳系统和BE6085转印槽(美国Bio-Rad公司),荧光发光凝胶成像仪(型号:Alliance Q9,瑞士Tecan公司),4℃低温离心机(型号:Centrifuge 5810R,德国艾本德股份公司),Illumina HiSeq测序平台(型号:Illumina HiSeq 2 500,美国Illumin公司)。
1.2 实验动物分组和造模50只大鼠随机分为对照组、模型组、阳性对照组(2.468 g·kg-1参苓白术 散)、低剂量(1.35 g·kg-1)黄 芪组和高剂量(2.7 g·kg-1)黄芪组,每组10只。除对照组外,其余各组大鼠采用大黄建立腹泻模型。20 mL·kg-1大黄提取液灌胃给药,每天1次,给药前禁食8 h造成饮食不节,持续14 d。观察造模期间大鼠临床表现,如出现便溏、肛门污秽、活动减少、拱背、毛发干枯无光泽和体质量减少等症状,表明脾虚泄泻模型建立成功[11]。造模成功后,各组大鼠均以20 mL·kg-1剂量灌胃给药,每天固定时间灌胃给药1次,持续14 d。在实验期间,对照组大鼠给予等量生理盐水。实验共持续28 d。实验结束后,将大鼠粪便收集于无菌管中,-80℃下保存。大鼠经戊巴比妥钠麻醉后,收集血液、结肠组织和其他组织用于后续实验。
1.3 各组大鼠腹泻指标测定实验开始后,每3 d于固定时间段记录各组大鼠体质量。每3 d采用干燥失重法测定大鼠粪便含水量。粪便含水量=(干燥前粪便湿质量-干燥后粪便干质量)/干燥前粪便湿质量×100%。每3 d采用参考文献[12]中的方法测量大鼠腹泻评分。腹泻评分:0分,无腹泻或大便正常;1分,大鼠未见水样腹泻,但大便较湿软;2分,中度腹泻,大便稀薄,肛周轻度沾染;3分,重度腹泻,大便水样,肛周严重沾染。
1.4 HE染色观察各组大鼠结肠组织病理形态表现实验结束后,迅速收集各组3只大鼠结肠组织,4%多聚甲醛固定过夜,梯度酒精脱水、二甲苯组织透明、浸蜡、包埋、切片、脱蜡、染色、脱水。再次梯度脱水后,烘干玻片表面液体,盖玻片覆盖。室温下干燥,观察各组大鼠结肠组织病理形态表现并拍照。采用双盲法,根据炎症细胞浸润(0~3分)和上皮损伤(0~3分)的综合评分评估结肠组织损伤。
1.5 Western blotting法检测各组大鼠结肠组织中屏障相关蛋白和TLR4/TRAF6/NF-κB信号通路相关蛋白表达水平各组分别选取3只大鼠结肠组织,采用含有蛋白酶抑制剂RIPA裂解缓冲液(1∶1 000)提取总蛋白。采用BCA蛋白浓度检测试剂盒测定蛋白浓度。10% SDS-PAGE凝胶100 V电泳分离蛋白,湿转法将其转移至PVDF膜上。5%脱脂奶粉封闭2 h。PBS缓冲液洗涤,与一抗(1∶1 000)4℃冰箱中孵育过夜,PBS缓冲液洗涤3次后,二抗孵育2 h,PBS缓冲液洗涤。采用ECL试剂盒和荧光发光凝胶成像系统显色成像。采用Image J软件分析蛋白条带灰度值,以GAPDH为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 16S r DNA基因测序分析各组大鼠肠道菌群情况在提取粪便中分离总DNA,根据保守区设计引物,并在引物末端加入所需测序接头。PCR扩增,产物纯化、定量和均质化,形成完整测序文库。文库质量测序分析后,采用碱基调用分析,将由高通量测序获取的原始图像数据文件转化为原始测序读数。通过读数拼接和过滤、聚类或去噪、物种注释和丰度分析,揭示样品物种组成。采用α多样性、β多样性、显著物种差异分析、相关分析和功能预测分析等方法分析样品间差异。
1.7酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)法检测各组大鼠血清中MTL、GAS、MDA、IL-1β、TNF-α、IL-6、IL-10和SIgA水平及SOD活性收集各组大鼠动脉血,静置30 min,4℃、3 000 g离心10 min,取上清,分装于0.5 mL EP管中,-80℃超低温冰箱保存。根据ELISA试剂盒说明书操作,检测各组大鼠血清中MTL、GAS、MDA、IL-1β、TNF-α、IL-6、IL-10和SIgA水 平 及SOD活 性。
1.8 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组大鼠体质量、粪便含水量和腹泻评分,血清中TNF-α、IL-1β、IL-6、MDA、IL-10和SIgA水平及SOD活性,结肠组织中PAR-2、MLCK、TLR4、NF-κB、MyD88、TRAF6、p-MLC和p-p38蛋白表达水平均符合正态分布,以-±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠腹泻指标和血清中胃肠动力激素水平与对照组比较,模型组大鼠体质量明显降低(P<0.01),粪便含水量和腹泻评分明显升高(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠体质量明显升高(P<0.01),粪便含水量和腹泻评分明显降低(P<0.01)。与对照组比较,模型组大鼠血清中MTL水平明显升高(P<0.01),GAS水平明显降低(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠血清中MTL水平明显降低(P<0.01),GAS水 平 明 显 升 高(P<0.01)。见图1和表1。
表1 各组大鼠血清中MTL和GAS水平Tab.1 Levels of MTL and GAS of rats in various groups[n=10,±s,ρB/(ng·L-1)]

表1 各组大鼠血清中MTL和GAS水平Tab.1 Levels of MTL and GAS of rats in various groups[n=10,±s,ρB/(ng·L-1)]
*P<0.01 compared with control group;△P<0.01 compared with model group.
Group Control Model Positive control High dose of Astragali Radix Low dose of Astragali Radix MTL 64.11±5.29 83.03±3.36*73.84±6.64△75.06±4.89△75.23±3.02△GAS 63.79±2.29 49.20±1.51*59.67±2.01△56.30±1.97△55.40±2.32△
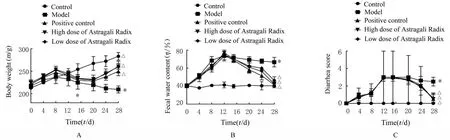
图1 各组大鼠体质量(A)、粪便含水量(B)、腹泻评分(C)Fig.1 Body weights(A),fecal water contents(B)and diarrhea scores(C)of rats in various groups
2.2 各组大鼠结肠组织病理形态表现和结肠组织损伤评分HE染色结果显示:与对照组比较,模型组大鼠结肠组织上皮黏膜损伤,大量炎症细胞浸润,腺体排列紊乱,结肠组织损伤评分升高(P<0.01)。与模型组比较,阳性对照组和高剂量黄芪组大鼠结肠组织上皮黏膜结构较规则,炎症细胞浸润较少,未见明显腺体紊乱;低剂量黄芪组大鼠结肠组织上皮黏膜结构可见轻微损伤,部分炎症细胞浸润,腺体排列较整齐;阳性对照组、低剂量黄芪组和高剂量组大鼠结肠组织损伤评分降低(P<0.01)。见图2和3。
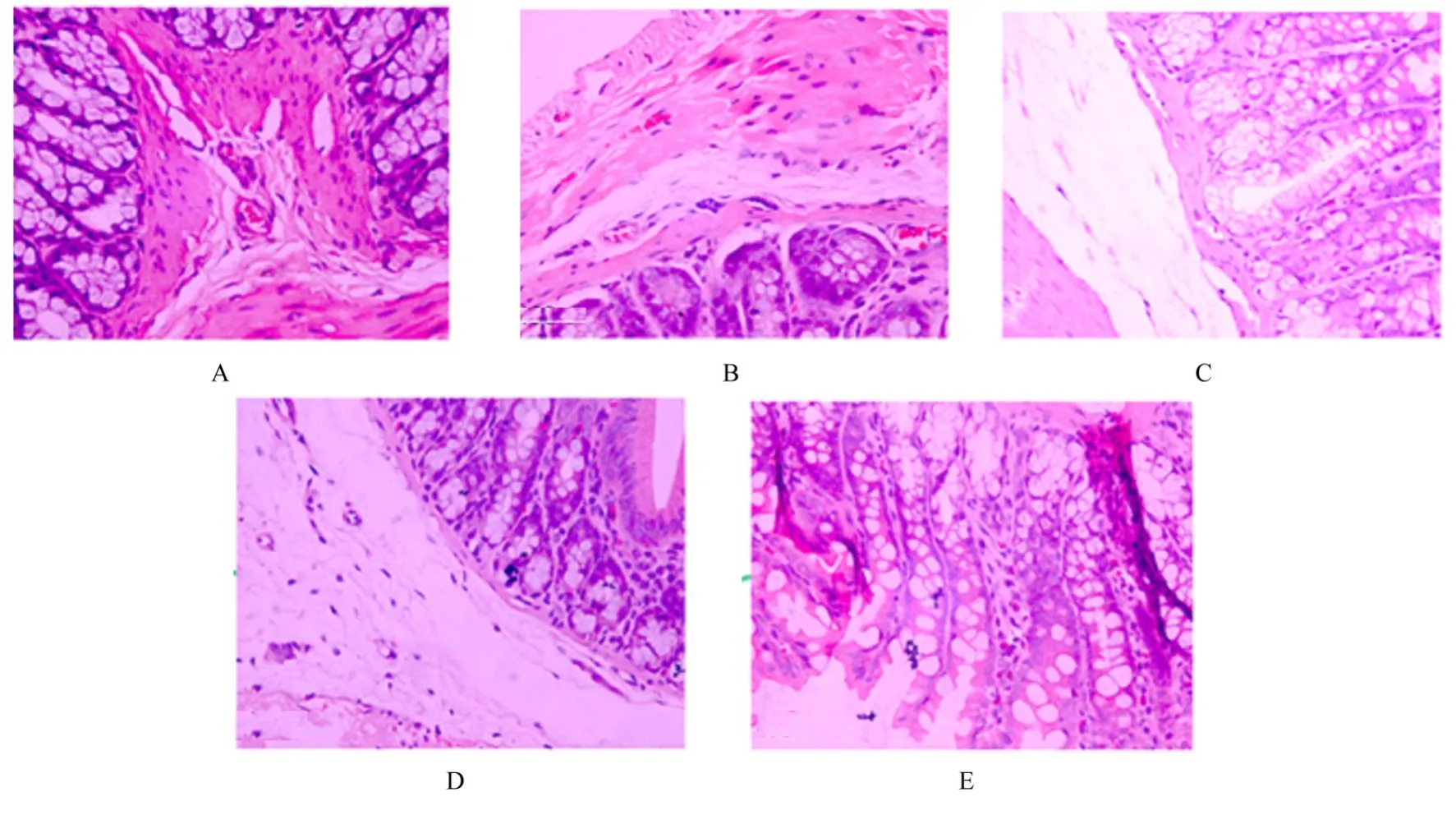
图2 各组大鼠结肠组织病理形态表现(HE,×400)Fig.2 Pathomorphology of colon tissue of rats in various groups(HE,×400)
2.3 各组大鼠结肠组织中肠屏障相关蛋白表达水平Western blotting检测结果显示:与对照组比较,模型组大鼠结肠组织中ZO-1和Occludin蛋白表达水平明显降低(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠结肠组织中ZO-1和Occludin蛋白表达水平明显升高(P<0.01)。与对照组比较,模型组大鼠结肠组织中p-p38和PAR-2蛋白表达水平明显升高(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠结肠组织中p-p38和PAR-2蛋白表达水平明显降低(P<0.01)。与对照组比较,模型组大鼠结肠组织中MLCK和p-MLC蛋白表达水平明显升高(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠结肠组织中MLCK和p-MLC蛋白表达水平明显降低(P<0.01)。见图4。
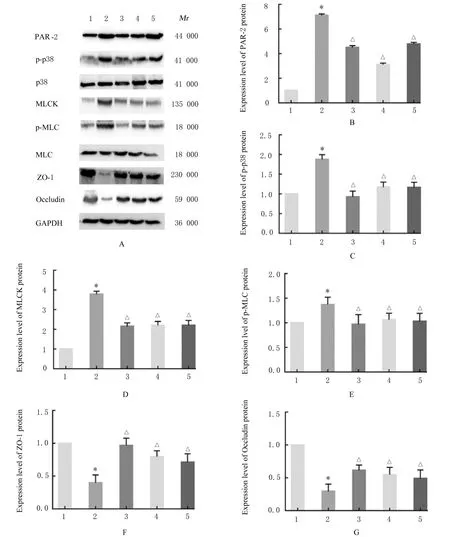
图4 各组大鼠结肠组织中肠屏障相关蛋白表达电泳图(A)和直条图(B-G)Fig.4 Electrophoregram(A)and histogram(B-G)of expressions of intestinal barrier-related proteins in colon tissue of rats in various groups
2.4 各组大鼠结肠组织中TLR4/TRAF6/NF-κB信号通路相关蛋白表达水平Western blotting法检测结果显示:与对照组比较,模型组大鼠结肠组织中TLR4、MyD88、TRAF6和NF-κB蛋 白表达水平明显升高(P<0.01);与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠结肠组织中TLR4、TRAF6、MyD88和NF-κB蛋 白表达水平明显降低(P<0.05或P<0.01)。见图5。

图5 各组大鼠结肠组织中TLR4/TRAF6/NF-κB信号通路相关蛋白表达电泳图(A)和直条图(B-E)Fig.5 Electrophoregram(A)and histogram(B-E)of TLR4/TRAF6/NF-κB signaling pathway-related proteins in colon tissue of rats in various groups
2.5 各组大鼠肠道菌群变化情况由各组大鼠粪便样本中检测到2 239 065对高质量序列和1 362个操 作 分 类 单 元 (operational taxonomic units,OTUs)。α多样性分析结果显示:与对照组比较,模型组大鼠ACE指数和Chao1指数降低,但差异无统计学意义(P>0.05);与模型组比较,低和高剂量黄芪组大鼠ACE指数和Chao1指数升高(P<0.05),肠道菌群物种丰度增加。β多样性分析结果显示:根据非计量多维尺度(non-metric multidimensional scale score plot,NMDS)得 分 图结果,与对照组比较,模型组大鼠肠道菌群结构存在明显变化;与模型组比较,低和高剂量黄芪组大鼠肠道菌群结构存在差异。基于算术平均未加权配对 法 (unweighted paired average method,UPGMA)加权Unifrac聚类树结果显示:首先各组大鼠组内肠道菌群聚类,随后低和高剂量黄芪组与对照组大鼠肠道菌群聚类,而均与模型组大鼠间存在差异。在肠道菌群门丰度分析中,对照组和高剂量黄芪组大鼠肠道菌群主要由厚壁菌门和拟杆菌门组成,模型组大鼠肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门和疣微菌门组成。与对照组比较,模型组大鼠肠道菌群中变形菌门和疣微菌门丰度明显升高(P<0.01);与模型组比较,低和高剂量黄芪组大鼠肠道菌群中变形菌门和疣微菌门丰度均明显降低(P<0.01),高剂量组大鼠肠道菌群中ε-变形菌门丰度明显升高(P<0.01)。见图6和表2。
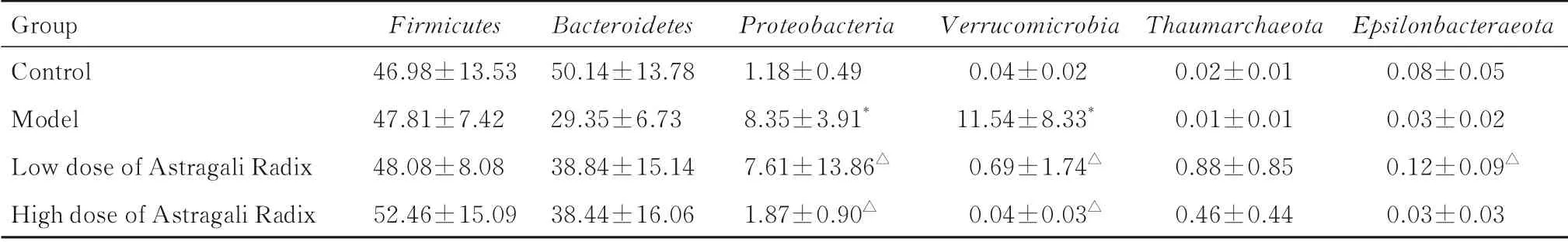
表2 各组大鼠在门水平上的肠道菌群丰度Tab.2 Abundance of intestinal flora of rats in various groups at phylum level (n=7,x±s,η/%)
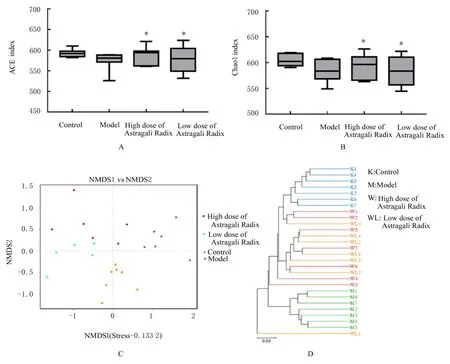
图6 各组大鼠的肠道菌群变化情况Fig.6 Changes in intestinal flora of rats in various groups
2.6 各组大鼠血清中TNF-α、IL-1β、IL-6和IL-10水平与对照组比较,模型组大鼠血清中TNF-α、IL-1β和IL-6水平明显升高(P<0.01),IL-10水平明显降低(P<0.01)。与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠血清中TNF-α、IL-1β和IL-6水平明显降低(P<0.01),IL-10水平明显升高(P<0.01)。见表3。
表3 各组大鼠血清中TNF-α、IL-1β、IL-6和IL-10水平Tab.3 Levels of TNF-α,IL-1β,IL-6 and IL-10 in serum of rats in various groups (n=8,±s)

表3 各组大鼠血清中TNF-α、IL-1β、IL-6和IL-10水平Tab.3 Levels of TNF-α,IL-1β,IL-6 and IL-10 in serum of rats in various groups (n=8,±s)
*P<0.01 compared with control group;△P<0.01 compared with model group.
Group Control Model Positive control Low dose of Astragali Radix High dose of Astragali Radix TNF-α[ρB/(ng·L-1)]78.58±5.15 90.88±3.26*79.95±5.85△80.86±6.70△81.54±4.54△IL-1β[ρB/(μg·L-1)]26.12±2.91 34.08±3.20*27.73±2.21△27.47±1.15△27.28±1.98△IL-6[ρB/(ng·L-1)]75.20±19.95 240.10±15.37*93.24±18.04△143.81±11.19△118.76±15.88△IL-10[ρB/(ng·L-1)]10.54±0.88 8.20±0.52*10.13±0.91△9.80±0.58*△10.10±0.74△
2.7 各组大鼠血清中MDA水平和SOD活性与对照组比较,模型组大鼠血清中MDA水平明显升高(P<0.01),SOD活性明显降低(P<0.01)。与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠血清中MDA水平明显降低(P<0.01),SOD活 性 明 显 升 高(P<0.01)。见表4。
2.8 各组大鼠血清中SIgA水平与对照组比较,模型组大鼠血清中SIgA水平明显降低(P<0.01)。与模型组比较,阳性对照组、低剂量黄芪组和高剂量黄芪组大鼠血清中SIgA水平明显升高(P<0.01)。见表4。
表4 各组大鼠血清中MDA和SIgA水平及SOD活性Tab.4 Levels of MDA and SIgA and SOD activities in serum of rats in various groups (n=8,±s)

表4 各组大鼠血清中MDA和SIgA水平及SOD活性Tab.4 Levels of MDA and SIgA and SOD activities in serum of rats in various groups (n=8,±s)
*P<0.01 compared with control group;△P<0.01 compared with model group.
Group Control Model Positive control Low dose of Astragali Radix High dose of Astragali Radix MDA[ρB/(g·L-1)]9.45±1.56 11.94±0.85*9.63±1.77△10.81±1.32△9.98±1.13△SIgA[ρB/(mg·L-1)]6.38±0.08 4.47±0.02*6.28±0.05△5.77±0.04△5.90±0.05△SOD[λB/(U·mL-1)]6.17±0.59 3.97±0.76*5.59±1.12△5.08±0.67△5.29±0.85△
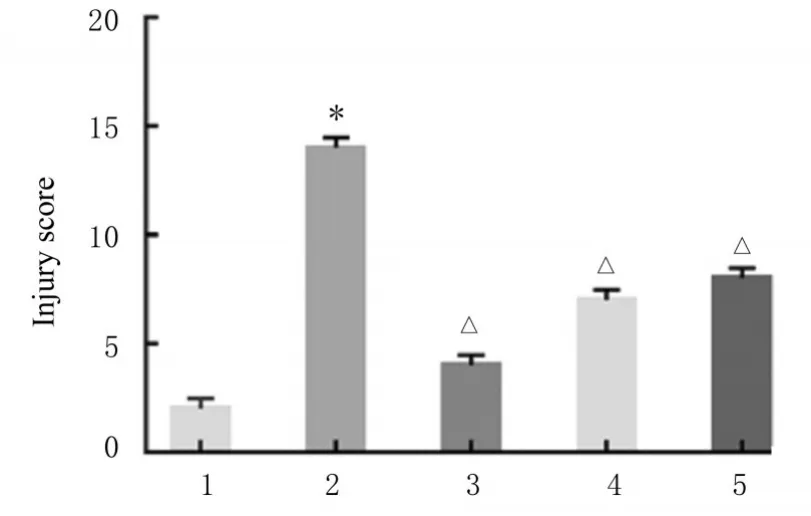
图3 各组大鼠结肠组织损伤评分Fig.3 Injury scores of colon tissue of rats in various groups
3 讨 论
腹泻是人们生活中最常见的疾病之一。采用中药针对肠道菌群失调和肠道炎症是治疗腹泻的一个直接策略[13]。研究[14]显示:慢性腹泻的发生发展与体内胃肠道运动激素水平有密切关联,胃肠运动激素水平变化会导致腹泻的发生。MTL和GAS是与腹泻密切相关的胃肠运动激素[15]。本研究结果显示:黄芪可以有效降低腹泻模型大鼠体内MTL水平,升高GAS水平,表明黄芪可以发挥改善肠道功能作用,治疗大黄所致大鼠腹泻。
本研究结果显示:低和高剂量黄芪组大鼠肠道中变形菌门和疣微菌门水平明显降低;黄芪可以有效降低腹泻模型大鼠结肠组织中TLR4、TRAF6、MyD88和NF-κB蛋白表达水平,降低腹泻模型大鼠血清中TNF-α、IL-1β和IL-6水平。在慢性腹泻的发生发展过程中,肠道菌群发挥着重要的作用,慢性腹泻患者伴随肠道菌群失衡[16]。研究[17]显示:慢性腹泻患者肠道中拟杆菌门水平明显降低,而变形菌门等革兰阴性菌水平升高。变形菌门是革兰阴性菌,包含多种与腹泻密切相关的肠道病菌[18]。变形菌门相关菌种的外膜由脂多糖组成[19-20]。当肠道内变形菌门等革兰阴性菌水平升高,其接触肠道上皮细胞,直接激活TLR4,过度的TLR4激 活 诱 导 宿 主 炎症 反 应[21]。TLR4在慢 性腹泻患者和大黄所致腹泻大鼠结肠组织中高度表达,被认为是肠道炎症发生和发展的促成因素。TLR4激活通过信号转导途径与MyD88相互作用,从而激活NF-κB并促进多种炎症因子的合成和释放[22]。提示黄芪可以通过降低变形菌门和疣微菌门水平,抑制TLR4/TRAF6/NF-κB信号通路相关蛋白表达,降低血清中TNF-α、IL-1β和IL-6水平,减少结肠组织中性粒细胞浸润,从而抑制肠道炎症,发挥黄芪治疗腹泻的作用。
研究[23]显示:黄芪可以明显降低腹泻模型大鼠体内MDA水平,升高SOD活性,且可以明显升高SIgA水平。当体内的氧化应激水平升高时,会促进肠道炎症和肠道屏障损伤,SIgA是肠道黏膜免疫中重要的免疫球蛋白,主要用于抵抗各种内源性共生细菌和外源性入侵病原体[23-24]。提示黄芪可以有效降低腹泻模型大鼠体内氧化应激水平,提高腹泻模型大鼠体内肠道黏膜免疫水平,发挥抑制肠道炎症的作用。
肠道发生炎症反应,往往会引起肠道屏障损伤,是肠道炎症能够引起腹泻的重要因素。研究[25-26]表明:肠道屏障的完整性主要与肠道屏障蛋白的正常活性有关,肠道紧密连接蛋白ZO-1和Occludin表达在腹泻相关疾病中明显下调,且受PAR-2和p38调 控。此外,PAR-2和p-p38可 以通过抑制MLCK激活和p-MLC表达调节紧密连接蛋白表达[27]。本研究结果显示:黄芪能上调大鼠肠道屏障蛋白ZO-1和Occludin表达,降低结肠组织中PAR-2表达水平,抑制p38磷酸化,进而抑制MLCK激活和p-MLC表达,提示黄芪可以防止结肠屏障蛋白降解,抑制肠道屏障损伤。
综上所述,黄芪可以有效治疗大黄引起的大鼠慢性腹泻,降低腹泻模型大鼠肠道炎症水平,上调肠道屏障蛋白表达,恢复肠道屏障损伤,其机制可能与降低肠道菌群中变形菌门和疣微菌门的比例,恢复肠道菌群组成,抑制TLR4/TRAF6/NF-κB信号通路相关蛋白表达有关。此外,黄芪可降低大鼠体内氧化应激水平,上调肠道内分泌型免疫球蛋白水平,提高肠道免疫水平,发挥治疗大黄所致大鼠慢性腹泻的作用。

