四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K相平衡研究
马玉军,王 晓,李淑雅,张付康,李 娟
(青海大学化工学院,青海西宁810016)
柴达木盆地拥有丰富的盐湖资源,钾、锂、硼的资源储量分别占全国的85%、80%和25%,是经济发展和资源合理利用的关键盐湖矿床[1]。盐湖尾闾区有着丰富的离子,以多种盐的形式存在于水及土壤中,以西台吉乃尔湖尾闾区水资源为例,存在Na+、K+、Li+、Mg2+、Cl-、SO42-、C及硼酸盐等,其中Na+含量最多[2]。随着科学技术的进步以及盐湖资源的开采利用,分离、提纯盐湖离子,合理利用资源,研究水盐相图作为理论依据非常关键。
硼及硼的化合物在超导、永磁[3]、颜料、造纸、医疗军工[4]等方面的应用越来越广。对硼离子及化合物的研究多以B4O72-为主[5-7],硼酸盐种类较多,根据配位数不同存在的形式有:偏硼酸盐(BO2-)、四硼酸盐(B4O72-)、五硼酸盐(B5O82-)、六硼酸盐(B6O102-)等。研究偏硼酸盐(BO2-)的相平衡,对盐湖开采利用有重要的指导意义。目前已经研究298.15[8]、308.15[9]、323.15 K[10]三元体系(NaCl+NaBO2+H2O)相平衡及物化性质,研究发现298.15 K 和308.15、323.15 K都有两个共饱和点,形成了同样的盐NaCl·NaBO2·2H2O,四元体系(NaCl+NaBO2+Na2CO3+H2O)298.15 K相平衡相关的文献从未报道。
1 实验部分
1.1 实验仪器与试剂
主要仪器:SHA-B 双功能水浴恒温振荡器;D8 Discover X 射线粉末衍射仪;DMA 4100 密度计;WAY-2S 阿贝折光仪;Smart1002UP 实验室超纯水机。
主要试剂:偏硼酸钠,99.8%;无水碳酸钠,99.9%;氯化钠,99.5%;新鲜去CO2、低电导率去离子水,实验室超纯水机制取新鲜水后再煮沸30 min。
1.2 实验方法
采用等温平衡溶解的方法进行相平衡研究,在三元饱和溶液中逐渐加入第二种盐,制备一系列饱和溶液。例如用氯化钠和偏硼酸钠配制了三元共饱和点后,加入第三种盐(碳酸钠),盛放于聚氯乙烯塑料瓶中,密封后放入振荡器中恒温振荡,温度控制为298.15 K±0.1 K,定期取瓶中上清液分析其中不同组分的含量,直至各组分溶解度恒定不变时,则溶液达到固液平衡。结果表明,该四元体系在10~15 d 内达到平衡,取平衡液相分析含量,测定物化性质(密度、折光率),平衡固相进行XRD分析。
BO2
-浓度的测定采用甘露醇转化-酸碱滴定法[11-12],甲基红和酚酞双指示剂滴定终点红色,相对不确定度为±0.05;氯离子浓度测定采用硝酸汞容量滴定法[13],即在二苯偶氮碳酰肼和溴酚蓝混合指示剂的作用下,用Hg(NO3)2溶液滴定至紫蓝色,相对不确定度为±0.04;碳酸根浓度测定采用酸碱滴定法[14],甲基红指示剂终点红色,相对不确定度为±0.05;钠离子浓度测定采用差减法。
1.3 计算方法
四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K平衡时,测定液相组成含量用Jänecke 干盐指数(J)的计算公式见式(1)~(4),平衡液相用质量分数(%)表示,计算公式见式(5)。
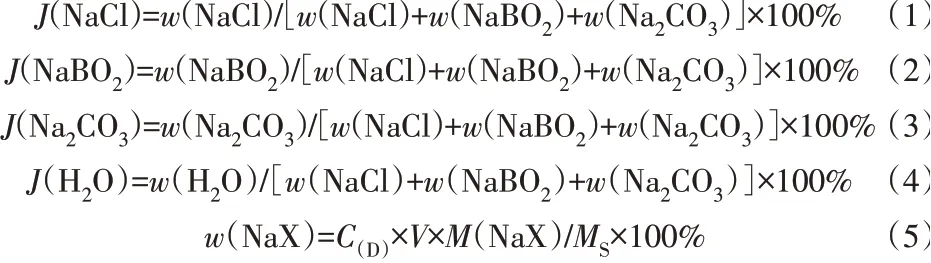
式中:C(D)为滴定液浓度,mol/L;M为NaX的相对分子质量;V为滴定消耗的体积,L;MS为平衡液相质量,g。
2 结果与讨论
2.1 稳定相平衡研究
实验测得四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K 平衡液相组成及相应的Jänecke 干盐指数(J)见表1,根据Jänecke干盐指数绘制了四元体系平衡时的干盐图见图1。从图1和表1可以看出,四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K 中形成了复盐NaCl·NaBO2·2H2O,没有产生固溶体,该体系298.15 K时相图包含2个共饱点(E1、E2)、5条溶解度曲线、4个结晶区。
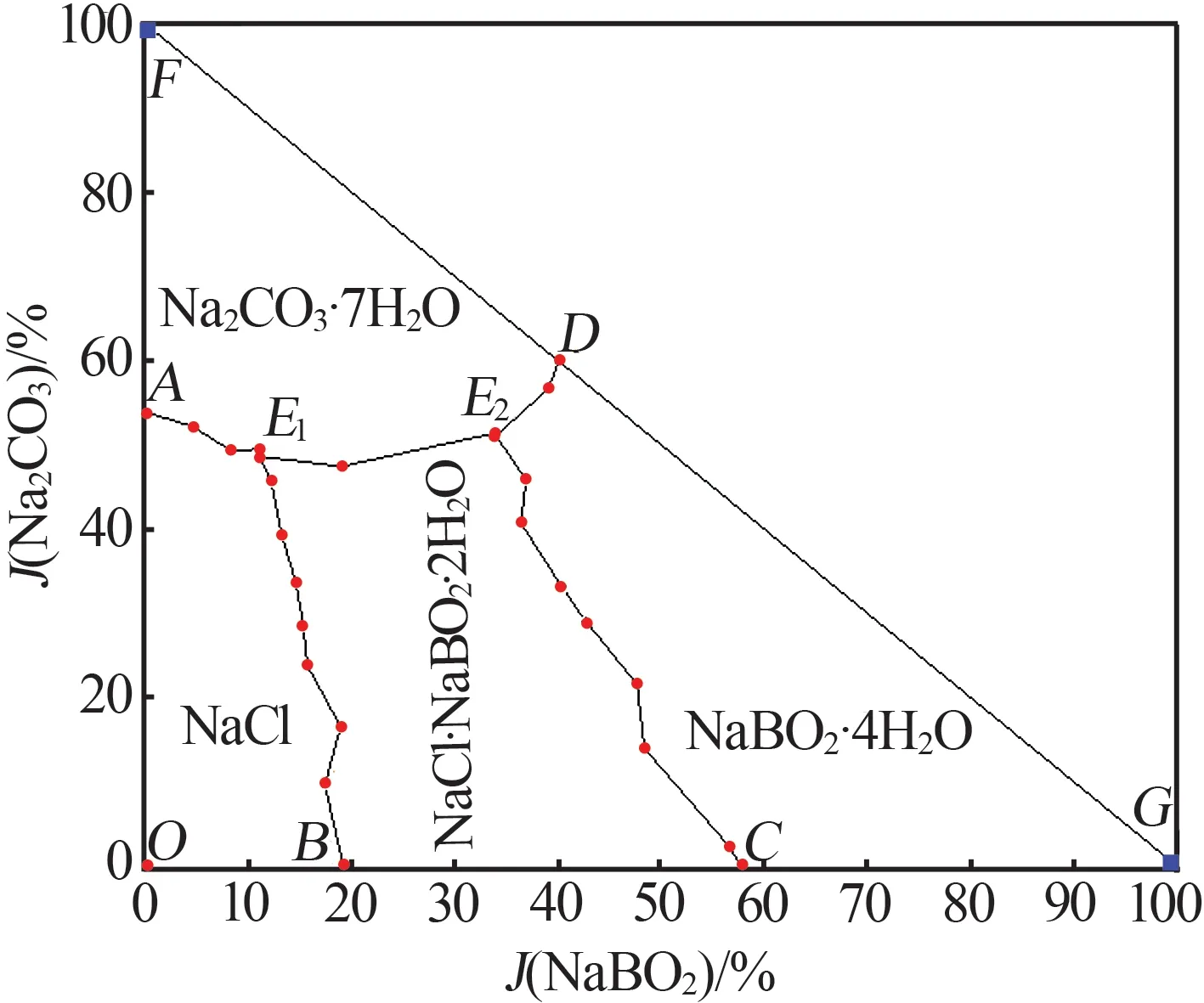
图1 四元体系(NaCl+NaBO2+Na2CO3+H2O)298.15 K时干基图Fig.1 Dry-salt phase diagram of the quaternary system(NaCl+NaBO2+Na2CO3+H2O)at 298.15 K
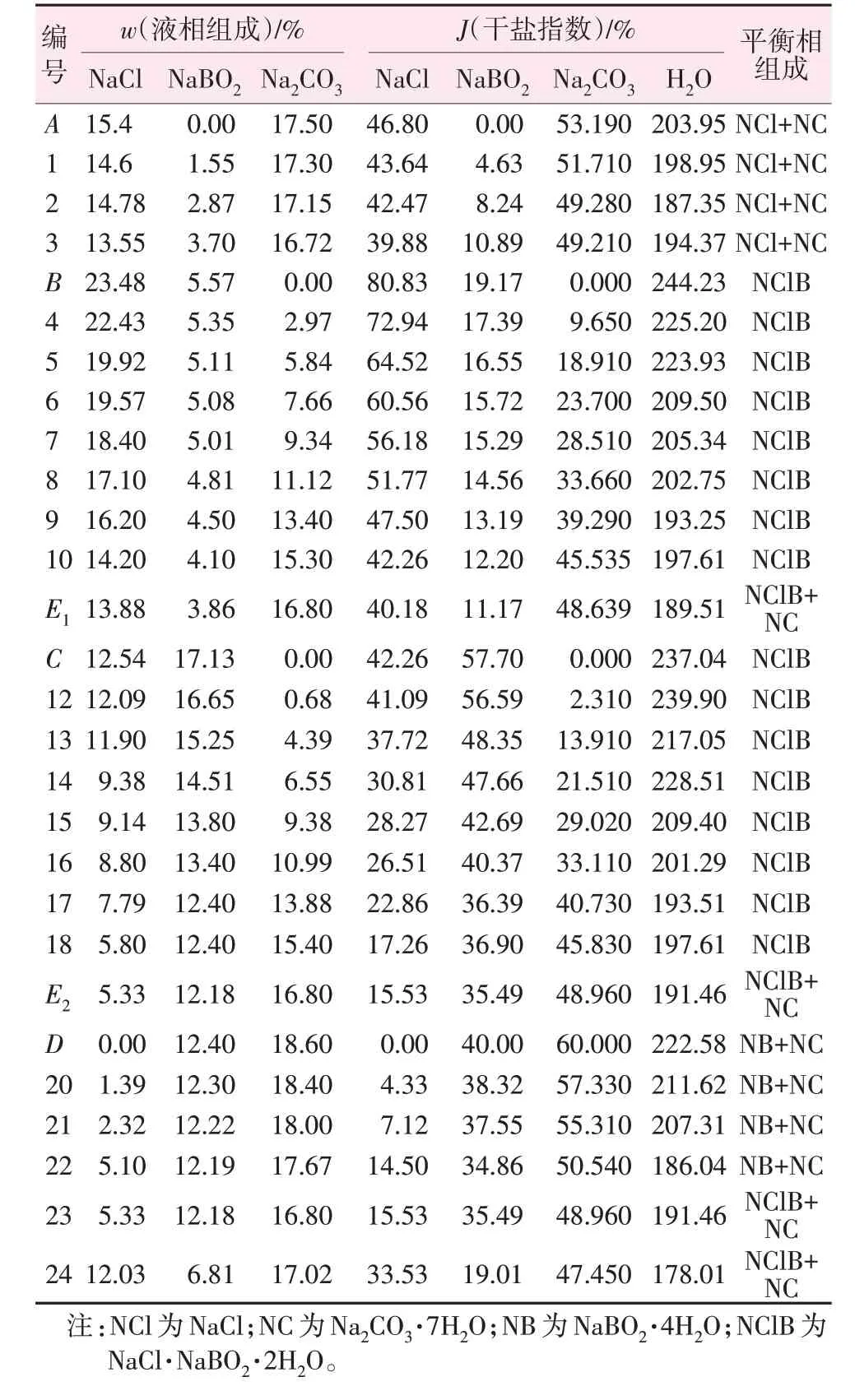
表1 四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K平衡液相组成及相应的干盐指数Table 1 Equilibrium liquid phase composition and corresponding dry salt index of quaternary system of NaCl+NaBO2+Na2CO3+H2O at 298.15 K
两个共饱点为E1、E2,其中E1平衡液相组成为
w(NaCl)=13.88%,w(NaBO2)=3.86%,w(Na2CO3)=16.8%;E2平 衡 液 相 组 成 为w(NaCl)=5.33%,w(NaBO2)=12.18%,w(Na2CO3)=16.8%;E1、E2平衡固相 组 成 均 为NaCl·NaBO2·2H2O 和Na2CO3·7H2O。5 条单变量溶解度曲线,AE1组成为NaCl 和Na2CO3·7H2O;BE1组 成 为NaCl·NaBO2·2H2O;CE2组 成 为NaCl·NaBO2·2H2O;DE2组 成 为NaCl 和NaBO2·4H2O;E1E2组 成 为NaCl·NaBO2·2H2O 和Na2CO3·7H2O。
4个结晶相区,相区AE1BO由固体NaCl组成;相区BCE1E2由固体复盐NaCl·NaBO2·2H2O组成;相区DGCE2由固体NaBO2·4H2O组成;相区AFE1E2D由固体Na2CO3·7H2O 组成。其中NaCl 相区面积最小,NaCl·NaBO2·2H2O相区面积最大。
实验所得共饱点E1、E2的平衡固相用XRD进行表征,与标准卡片对比结果见图2。从图2中可以看出平衡固相的峰位与标准图谱一致,证明E1、E2确实 为 该 四 元 体 系 的 共 饱 点(NaCl·NaBO2·2H2O+Na2CO3·7H2O)。
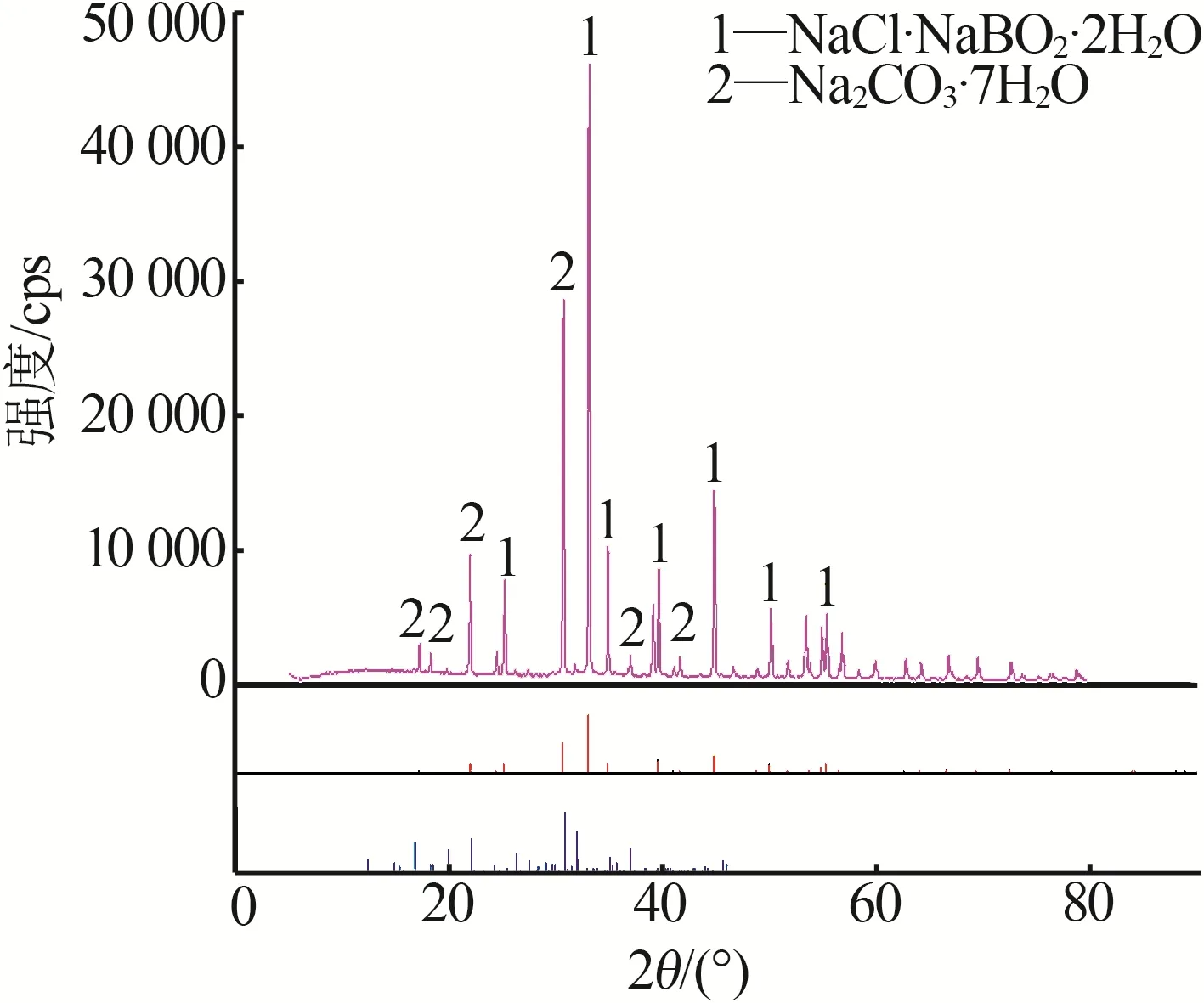
图2 四元体系NaCl+NaBO2+Na2CO3+H2O 298.15 K的E1、E2饱和点XRD谱图Fig.2 XRD patterns of the invariant points of E1,E2 in the quaternary system(NaCl+NaBO2+Na2CO3+H2O)at 298.15 K
2.2 稳定相平衡物化性质
对四元体系 NaCl+NaBO2+Na2CO3+H2O 在298.15 K的平衡液相测得物化性质数据见表2,绘制的物化性质-组成图见图3。
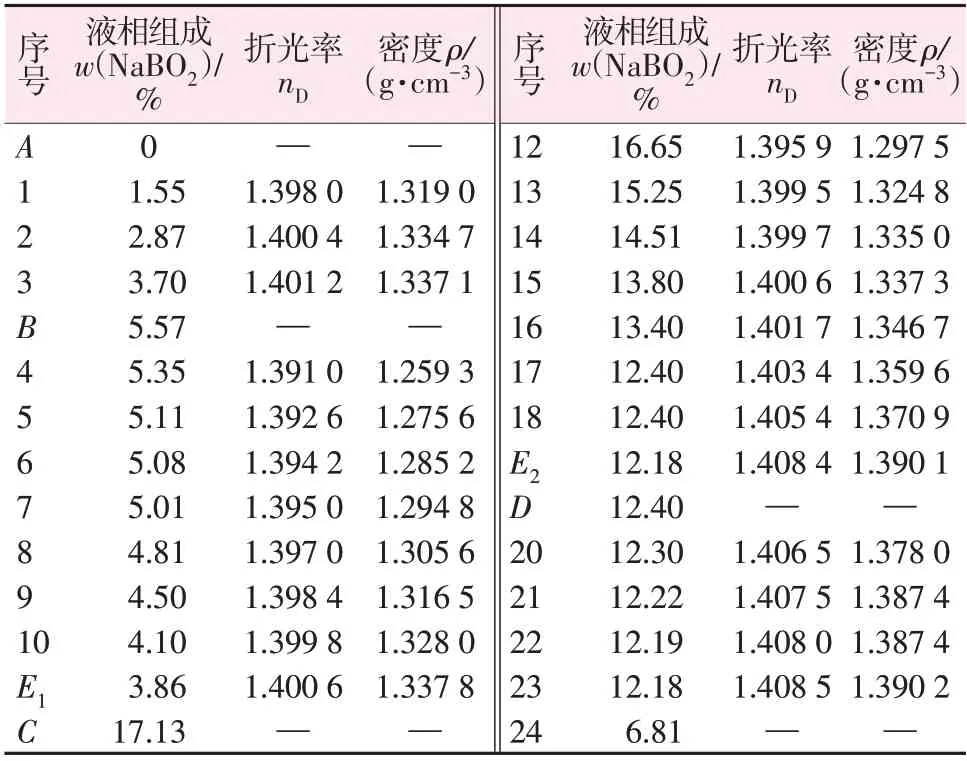
表2 四元体系NaCl+NaBO2+Na2CO3+H2O在298.15 K的物化性质Table 2 Physicochemical properties of quaternary system(NaCl+NaBO2+Na2CO3+H2O)at 298.15 K
图3a 为密度与J(NaBO2)关系图。从图3a 可以看出,A点到B点随着J(NaBO2)的增多,溶液密度逐渐增大,在E1点(共饱和点)处发生转折,转折后溶液密度逐渐降低,饱和点E1处的密度为1.337 8 g/cm3。D到C点,随着J(NaBO2)的减少,溶液密度逐渐增大,在E2(共饱和点)处达到最大值,饱和点E2最大值为1.390 1 g/cm3。
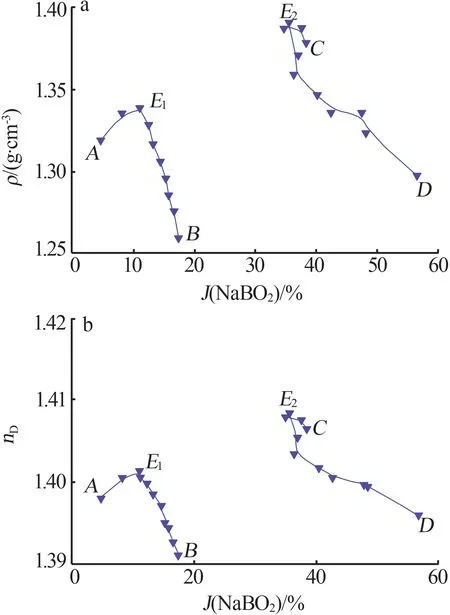
图3 298.15 K四元体系NaCl+NaBO2+Na2CO3+H2O密度(a)、折光率(b)物理化学性质组成图Fig.3 Physicochemical properties versus composition diagram of the quaternary system(NaCl+NaBO2+Na2CO3+H2O)at 298.15 K.(a)density versus J(NaBO2);(b)refractive index versus J(NaBO2)
图3b 是折光率nD与J(NaBO2)关系图。与密度的变化规律相近,A点到B点随着J(NaBO2)的增加,溶液折光率增大,在E1(共饱和点)处发生转折,转折后溶液折光率逐渐降低,饱和点E1处的折光率为1.400 6。D到C点,随着J(NaBO2)的减少,溶液折光率逐渐增大,在饱和点E2处发生转折,饱和点E2处的折光率最大,为1.408 4。
2.3 四元体系NaCl+NaBO2+Na2CO3+H2O在298.15 K相图应用
卤水盐析路线图见图4。由图4可知,H点为卤水的干基组成,当卤水饱和时NaBO2·4H2O首先析出;继续蒸发,液相由H点至S点,固相析出点为K点;当液相点达到S点时,Na2CO3·7H2O析出;继续蒸发,液相由S点至E2点时固相点由K移动至C点;当液相点移动至E2时,NaCl·NaBO2·2H2O开始析出,E2为相图的共饱和点,根据相律判断此点自由度为零,继续蒸发,液相点不动,直至蒸干。依靠相图预测盐析顺序对盐湖卤水生产工艺路线的定制具有指导意义。
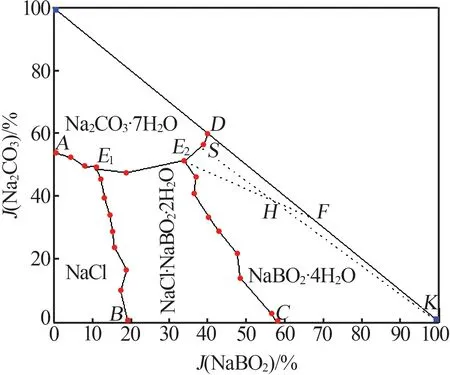
图4 卤水盐析路线图Fig.4 Diagram of salting out route of brine
3 结论
采用等温溶解平衡法研究了四元体系NaCl+NaBO2+Na2CO3+H2O 在298.15 K 下的相平衡。测定该体系液相各组分的平衡溶解度及折光率、密度,根据实验数据绘制了相应的干基图、水图和物化性质组成。研究发现四元体系(NaCl+NaBO2+Na2CO3+H2O)298.15 K 是有5 条单变量曲线,4 个结晶相区(NaCl、Na2CO3·7H2O、NaBO2·4H2O 和NaCl·NaBO2·2H2O)。两个共饱点,E1:w(NaCl)=5.33%,w(NaBO2)=12.18%,w(Na2CO3)=16.8%;E2:w(NaCl)=13.88%,
w(NaBO2)=3.86%,w(Na2CO3)=17.2%,由NaCl·NaBO2·2H2O 和Na2CO3·7H2O 固相共存。密度和折光率随着J(NaBO2)变化规律一致。

