临床中晚期糖尿病肾病进展的风险因素研究
何建强 余 姝 华 琴 徐丽华 巢 军 朱文芳 王泰娜 赵 丽
糖尿病肾脏病(diabetic kidney disease,DKD)已成为美国、日本和西欧等发达国家或地区终末期肾病(end-stage renal disease,ESRD)的首位病因[1]。在我国,DKD在ESRD的原发病因中仅次于原发性肾小球肾炎,且近年来呈上升趋势。例如,2015年以来DKD已成为江苏大学附属医院新进入肾脏替代治疗(renal replacement therapy, RRT)患者的首位病因[2]。
DKD患者在CKD1或2期时表现隐匿,临床症状不明显,易被忽视,往往在出现水肿、大量蛋白尿,甚至肾功能不全后才得到重视。目前,临床仍缺乏有效延缓晚期DKD患者肾功能损害进展的治疗方法[3]。因此,对CKD3至5期非透析DKD患者的预后及其危险因素分析更具有临床意义。本研究对2015年3月—2019年8月在江苏大学附属医院CKD管理门诊随诊并进入RRT的DKD患者进行了初步的分析探讨,为持续改进透析前管理,延缓CKD患者病情进展提供一定的依据。
1 对象与方法
1.1 研究对象 收集2015年3月—2019年8月在江苏大学附属医院CKD门诊随诊并进入RRT的71例DKD患者资料,均符合2012年改善全球肾脏疾病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)CKD管理临床实践指南中定义的标准。排除标准:①存在急性肾损伤;②恶性肿瘤;③未完善相关检查。本研究经医院伦理委员会审核并批准(批号:KY2021K1101),所有患者均签署知情同意书。
1.2 方法 以患者在CKD门诊第1次就诊时的资料作为基线资料,记录患者的年龄、性别、CKD分期、合并症、并发症、药物使用情况、随诊次数等一般资料,同时收集其基线血压、血红蛋白、血尿素氮、血肌酐、估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)、白蛋白、血脂、尿蛋白、全段甲状旁腺激素(intact parathroid hormone,iPTH)、电解质、FBG等结果。eGFR根据CKD-EPI 2009公式计算。
1.3 定义 患者于CKD门诊初次就诊时为入组时,患者初次行RRT时为入透时。患者由初次就诊进展至初次行RRT时间的中位数为中位病程。
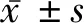
2 结 果
2.1 一般资料及实验室指标 纳入患者中男性患者48例(67.6%),年龄范围43岁~86岁,年龄为(63.93±10.31)岁,其中≥65岁34例(47.9%)。27例(38.0%)患者为CKD3期,31例(43.7%)为CKD4期,13例(18.3%)为CKD5期;43例(60.6%)的患者合并大量蛋白尿(24 h尿蛋白定量>3 g),62例(87.3%)合并高血压,42例(59.2%)合并冠心病;41例(57.7%)并发糖尿病性视网膜病变(diabetic retinopathy,DR);27例(38.0%)患者使用ACEI或ARB类药物,10例(14.1%)患者口服降糖药,56例(78.9%)使用胰岛素;52例(73.2%)患者随访频率≤4次/年。入透时患者的血红蛋白、血肌酐水平均显著高于入组时(P值均<0.05),血尿素氮、白蛋白水平和eGFR均显著高于入组时(P值均<0.05);两组间血压和其他实验室指标的差异均无统计学意义(P值均<0.05)。见表1。

表1 患者入组时与入透时的实验室指标的比较
2.2 DKD患者疾病进展及影响因素分析 患者进入透析治疗的中位病程为480(287,727) d,其中CKD 3期患者的中位病程为557(371,887) d,CKD 4期患者的中位病程为468(352, 584) d,CKD 5期患者的中位病程为212(136, 486) d。CKD3、4、5期患者进入RRT的中位病程的差异有统计学意义(χ2=7.035,P=0.03)。单因素Cox分析结果显示,冠心病、DR、胆固醇水平、24 h尿蛋白定量、未使用ACEI或ARB类药物及CKD分期是DKD进展的危险因素(P<0.1),而性别、年龄≥65岁、血红蛋白水平、白蛋白水平、三酰甘油水平和血压不是DKD进展的危险因素(P>0.1)。 进一步行多因素分析Cox分析显示,DR、胆固醇水平、24 h尿蛋白定量,以及未使用ACEI或ARB类药物是影响DKD进展的独立危险因素。见表2。

表2 DKD患者病程进展影响因素的Cox回归分析
3 讨 论
本研究发现,DKD患者在进入CKD3至5期后,进展至RRT的中位病程较短,仅为480 d,考虑可能与这部分患者于CKD门诊就诊时间过晚有关,患者均为CKD3期以上患者,4或5期患者占60%以上,因存在高钾及肾功能损害顾虑,使用ACEI/ARB类药物的患者仅占38.0%,60.6%的患者合并大量蛋白尿(24 h尿蛋白定量>3 g),87.3%的患者合并高血压,59.2%的患者合并冠心病,57.7%的患者并发DR。同时患者于CKD门诊随访频率较低,73.2%的患者随访频率≤4次/年。
糖尿病血管病变主要分为大血管病变和微血管病变,微血管病变的常见结局为DKD和DR,两者在组织结构、生理功能方面具有相近性,共同的发病机制导致两者可并存,病理上具有高度相似性,可互为对方的预测因子。Zhang等[4]于2018年对250例2型DKD患者进行分析,结果发现肾小球病变的严重程度与DR显著相关,DR是DKD进展为ESRD的独立危险因素,这与本研究的多因素分析结果一致。也有其他研究[5-6]结果表明,并发DR的DKD患者肾小球滤过率下降速度更快,进展至ESRD的病程更短,预后更差。
DKD起病隐匿,早期症状不易察觉,一旦进入显性蛋白尿期,其进展至ESRD的速度大约为其他肾脏病变的14倍。Vaidya等[7]指出蛋白尿是直接导致DKD患者肾功能恶化的危险因子,加速肾小球硬化,影响疾病预后。本研究也发现所有入组的DKD患者均有不同程度的蛋白尿,Cox回归分析显示24 h尿蛋白定量是DKD进展的危险因素。一直以来,DKD患者蛋白尿的治疗药物有限,ACEI和ARB可阻止CKD患者蛋白尿进展的作用在卡托普利(Collaborative)、氯沙坦(RENAAL)、厄贝沙坦(IRMA)和厄贝沙坦(IDNT)这4个经典药物的研究中均得到证实。本研究入组患者均为CKD3期以上,未使用ACEI或ARB类药物是病程进展的危险因素,所以即使在DKD进入CKD3期以后,若患者既往一直使用ACEI或ARB且患者依从性好,能够密切监测肾功能及电解质,建议勿停用此类药物或选择调整此类药物剂量以延缓肾脏病进展。
超过75%的2型糖尿病患者可发生糖尿病脂代谢异常,主要为混合型脂代谢异常[8]。本研究中大部分DKD患者都存在高脂血症,以TG和胆固醇水平均增高多见。脂质在肾脏沉积的结果是引起肾小球基底膜增厚,细胞外基质聚集,这些都进一步导致肾小球硬化和肾小管损伤,最终导致肾功能受损,是DKD进展的独立危险因素[9]。Ficociello等[10]也证实血清胆固醇水平升高是DKD进展的危险因素,与本研究结果一致。因此,调节血脂仍是目前治疗DKD的重要举措。目前的研究结果表明,DKD患者应尽早开始他汀类药物治疗,可改善蛋白尿和降低eGFR,所以在江苏大学附属医院CKD门诊中,若无禁忌证则应尽早使用他汀类药物以纠正患者脂质代谢紊乱,对延缓DKD进展具有积极作用。
通过对DKD患者病程进展危险因素进行分析,发现存在大量蛋白尿、多种合并症的晚期DKD患者可快速进展至ESRD,临床医师应加强宣教管理,提高患者对疾病的认知及随访依从性,并积极治疗各种并发症,做好RRT前的各项准备[11-12]。在今后的DKD患者管理工作中,通过多学科合作,早期对糖尿病患者肾脏并发症及DR进行筛查,可及时发现DKD,早期干预,同时注重对血脂的管理,科学合理使用ACEI或ARB类药物,实现全程管理和治疗,以延缓DKD的进展。

