中介素改善IgA肾病大鼠肾脏结构和功能以及微血管损伤
王宗隅,范琦强,赵 艳,王艳红,罗琰琨,周 芸
(1.山西医科大学第五临床医学院(山西省人民医院)肾内科,山西 太原 030012;2.肾脏病山西省重点实验室,山西 太原 030012;3.山西省实验动物基因工程研究中心,山西 太原 030012;4.山西医科大学微生物与免疫教研室,山西 太原 030001)
IgA肾病(IgA nephropathy,IgAN)是全球最常见的原发性肾小球肾炎,也是慢性肾脏病和终末期肾病的重要原因[1]。我国是IgAN的高发国家,约30%~40%的患者在确诊后20年内进行性发展为终末期肾脏病,最终只能依靠透析或肾移植治疗[1]。目前,IgAN的发病机制并不完全清楚,较为公认的是多重打击学说,与黏膜免疫的异常密切相关[2]。同时,IgAN血管病变发生率高,随疾病进展而加重,作为影响疾病预后的重要因素,受到广泛关注[3]。
中介素(intermedin,IMD),又称肾上腺髓质素,属于降钙素基因相关肽超家族成员,可通过该家族共同受体系统的不同亚型非选择性结合来发挥生物学效应[4]。研究提示[5],IMD在肾脏中有大量表达,其参与了血管内皮细胞的迁移、血管腔形成及血管新生,并抑制肾脏纤维化。本课题组前期研究发现,IgAN患者肾脏血管的丢失与IMD密切相关,且在不同病理分级或分期中呈现一定变化趋势,提示IMD在IgAN的进展中可能有一定作用[6]。因此,本研究通过构建IgAN大鼠模型,观察IMD对IgAN大鼠肾脏结构和功能以及微血管损伤的影响,以期为IgAN的非免疫治疗提供一定思路。
1 材料与方法
1.1 主要试剂大鼠中介素(IMD,杭州中肽生化公司,批号HITM002);牛血清白蛋白(bovine serum albumin,BSA,美国Sigma公司,批号V900933)、脂多糖(lipopolysaccharide,LPS,美国Sigma公司,批号L2880);四氯化碳(carbon tetrachloride,CCl4,上海罗恩试剂公司,批号R019799)、蓖麻油(上海罗恩试剂公司,批号R019726);微量渗透泵(美国Alzet公司,批号2004);HE染色、PAS染色(武汉赛维尔生物科技有限公司);一抗(武汉爱博泰克生物科技有限公司,批号A16640、A17910、A0697、A11492、A2125、A12303)及二抗(武汉博士德生物公司,批号SV0002-12);PCR引物设计合成(上海生工生物公司);PCR试剂盒(日本TaKaRa公司,批号RR047A,RR820A)。
1.2 实验动物SPF级♂SD大鼠,6周龄,共36只,体质量(200±20)g,购买并饲养于山西省人民医院实验动物中心,动物中心使用许可证号为SYXK(晋)2019-0003。本实验所用动物均符合山西省人民医院动物伦理审查标准。
1.3 方法
1.3.1IgA肾病大鼠模型的建立 采用口服牛血清白蛋白(BSA)+尾静脉注射脂多糖(LPS)+皮下注射四氯化碳(CCl4)的方法建立IgA肾病大鼠模型。BSA结晶粉末以蒸馏水稀释为100 g·L-1的浓度,按6 mL·kg-1的量,隔日灌胃,持续12周;LPS用0.9%生理盐水稀释成0.25 g·L-1的浓度,按1 mL·kg-1的量,于第6周、第8周、第10周、第12周尾静脉注射;CCl4和蓖麻油按每只0.1 mL+0.3 mL的量每周皮下注射1次,共12周。
1.3.2 实验动物分组及药物处理将36只大鼠随机分组如下:正常对照组(Control组)、IgA肾病组(IgAN组)、正常对照+IMD组(Control+IMD组)以及IgA肾病+IMD组(IgAN+IMD组),每组9只。IgAN组根据上述方法造模,Control组给予等量的生理盐水,12周末将Control组及IgAN组分别处死3只大鼠,留取肾组织,评估造模情况。IMD溶解后注入微量渗透泵,将麻醉大鼠,把泵埋入其背部的皮下,按100 ng·kg-1·h-1给药[7],持续4周。
1.3.3 肾功能相关指标检测在实验的第6、12和16周末,将各组大鼠分别放入代谢笼中,收集大鼠24 h的尿液,采用全自动尿液分析仪检测尿蛋白量。16周末经大鼠心尖部取血2~4 mL,离心后留取上清液,用全自动生化分析仪检测血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)。
1.3.4观察肾脏病理改变 肾组织用4%的多聚甲醛溶液来固定,待固定状态良好后,用酒精对组织进行脱水、石蜡包埋等。分别行HE、PAS染色后封片,在显微镜下观察、摄片。
1.3.5免疫荧光观察肾小球IgA沉积 肾组织进行连续切片,封闭、干燥后滴加FITC标记的羊抗鼠IgA抗体(1 ∶100)置于暗盒中4 ℃过夜,放置室温晾干并进行封片,在显微镜下观察、摄片。
1.3.6RT-PCR法检测血管损伤与修复相关细胞因子的mRNA表达 用TaKaRa试剂盒提取肾组织RNA,反转录获得cDNA后,进行RT-PCR扩增,检测各基因表达情况。以β-actin为内参,采用2-△△CT法计算每个基因的表达水平。引物序列见Tab 1。

Tab 1 Primer sequence of RT-PCR
1.3.7 Western blot检测血管损伤与修复相关细胞因子的蛋白表达将收集的肾脏组织加入100 μL的裂解液,超声波破碎组织20 s,后冰上静置30 min,低温高速离心15 min,取上清至新的EP管,BCA试剂盒检测蛋白浓度,调齐后低温保存备用。SDS-PAGE电泳约1.5 h,转膜2 h,脱脂牛奶封闭2 h,分别加入对应的一抗(1 ∶1 000),4 ℃过夜,TBST洗膜3次,二抗(1 ∶5 000)室温孵育2 h,TBST洗膜3次,ECL(A液 ∶B液=1 ∶1)化学发光液均匀滴于条带上,成像仪曝光,分析结果。

2 结果
2.1 中介素明显减少IgAN大鼠24 h尿蛋白水平造模前各组大鼠尿蛋白保持在较低水平。与Control组相比,IgAN组大鼠第6周已经出现少量尿蛋白,后显著升高,并持续至16周末(P<0.01);与IgAN组相比,IMD干预治疗后大鼠尿蛋白明显降低(P<0.01),见Tab 2。
2.2 中介素对IgAN大鼠肾脏功能的影响第16周末,与Control组相比,IgAN组大鼠Scr略微升高(P<0.05);与IgAN组相比,IMD干预治疗后大鼠Scr降低(P<0.05);各组大鼠BUN未见明显改变(P>0.05),见Fig 1。
2.3 中介素减轻IgAN大鼠肾脏病理损伤HE和PAS染色可见,Control组大鼠肾组织结构基本正常;IgAN组大鼠系膜细胞及基质增生,肾小管萎缩、管腔闭塞或扩张,周围可见结缔组织增生及淋巴细胞浸润;与IgAN组相比,IMD干预治疗后大鼠肾小球系膜细胞及基质减少,肾小管损害减轻,见Fig 2。
2.4 中介素减少IgAN大鼠肾小球IgA沉积荧光显微镜下,Control组大鼠肾小球系膜区未见IgA沉积;与Control组相比,IgAN组大鼠系膜区可见大量IgA沉积;与IgAN组相比,IMD干预治疗后大鼠系膜区IgA沉积减少,见Fig 3。
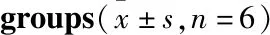
Tab 2 The urine protein quantification in different
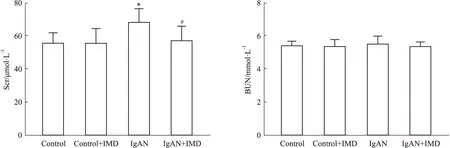
Fig 1 Levels of serum creatinine and blood urea nitrogen in different *P<0.05 vs control group;#P<0.05 vs IgAN group.
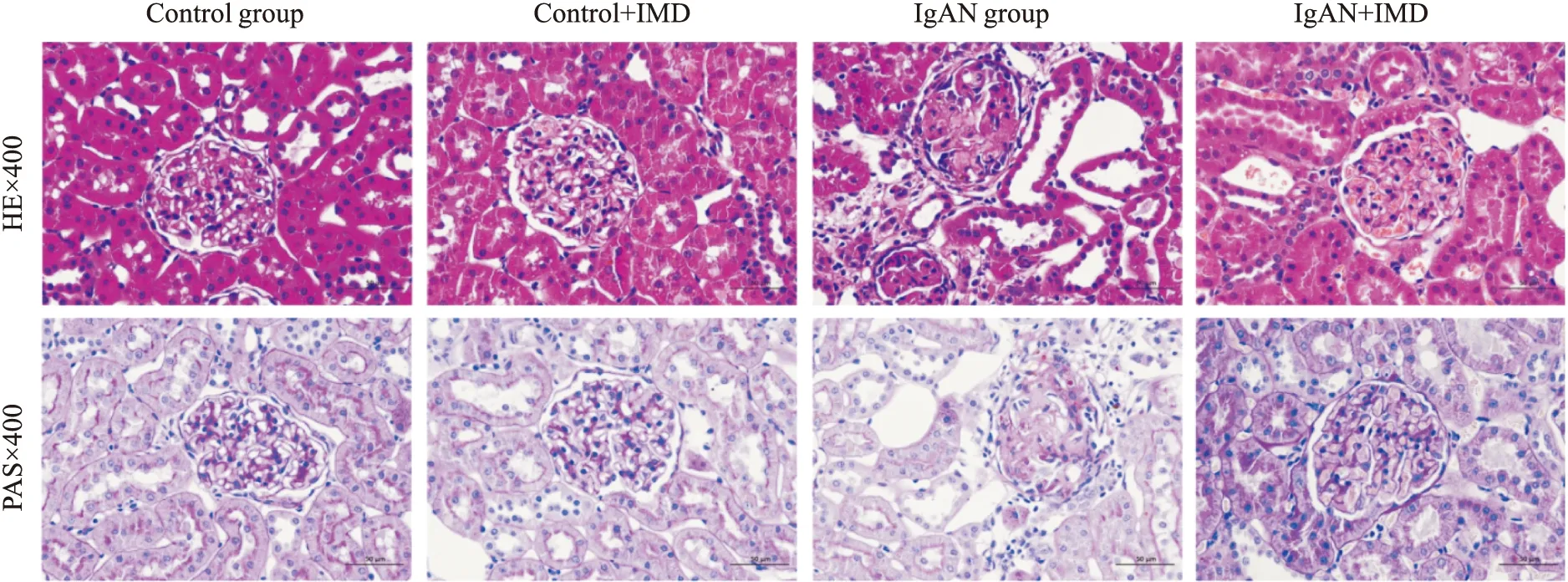
Fig 2 Changes of glomerular mesangial cells and matrix after intermedin intervention(×400)
Fig 3 IgA deposition in glomerular mesangial area after intermedin intervention(×400)
2.5 中介素对IgAN大鼠肾组织血管损伤与修复相关细胞因子表达的影响转化生长因子β1(transforming growth factor-β1,TGF-β1)、α平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)及骨形态发生蛋白(bone morphogenetic protein-7,BMP-7)反映肾脏纤维化的程度,E-钙黏蛋白(E-cadherin)、血小板反应蛋白1(thrombospondin-1,TSP-1)及血管内皮生长因子(vascular endothelial growth factor,VEGF)反映肾脏血管的生成与丢失。RT-PCR和Western blot结果显示,IgAN组TGF-β1、α-SMA、TSP-1的mRNA和蛋白表达均高于Control组(P<0.05),经IMD干预后,3者的表达均降低(P<0.05);IgAN组BMP-7、E-cadherin、VEGF的mRNA和蛋白表达均低于Control组(P<0.05),经IMD干预后,3者的表达均升高(P<0.05),见Fig 4,Fig 5。
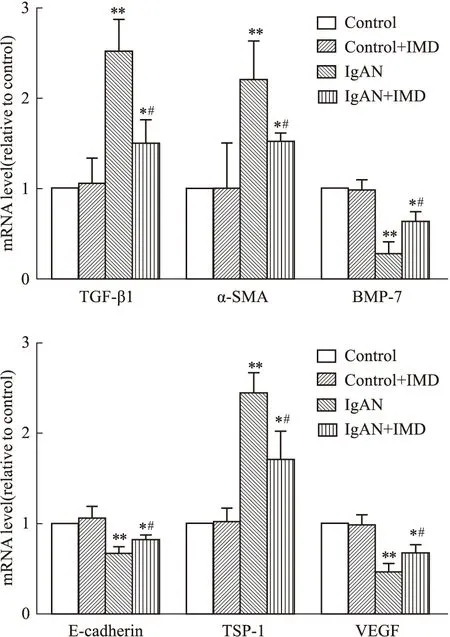
Fig 4 The mRNA levels of TGF-β1,α-SMA,BMP-7,E-cadherin, TSP-1 and VEGF after intermedin n=6)*P<0.05,**P<0.01 vs control group;#P<0.05 vs IgAN group.
3 讨论
IgAN的主要病理特征是以IgA为主的免疫复合物颗粒样或团块状沉积伴肾小球系膜细胞增生及系膜基质扩张[1]。尿蛋白是IgAN患者最常出现的临床症状,同时也是引起肾小管间质损害、导致肾功能进展的因素之一[1]。本研究采用国内最常用的方法,即联合牛血清白蛋白+脂多糖+四氯化碳建立IgAN大鼠模型[8-9]。免疫荧光可见IgAN组大鼠系膜区出现IgA沉积,HE和PAS染色可见系膜细胞及基质增生,尿蛋白定量结果显示其尿蛋白水平较对照组明显升高,符合IgAN的特点。经IMD干预后,大鼠尿蛋白水平下降,肾小球IgA沉积减少,系膜细胞及基质增生程度减轻,提示IMD对肾脏具有保护作用。本研究发现IgAN组大鼠血肌酐水平略高于对照组,而血尿素氮水平变化不明显,可能与造模期IgAN大鼠肾脏损伤不够严重有关。
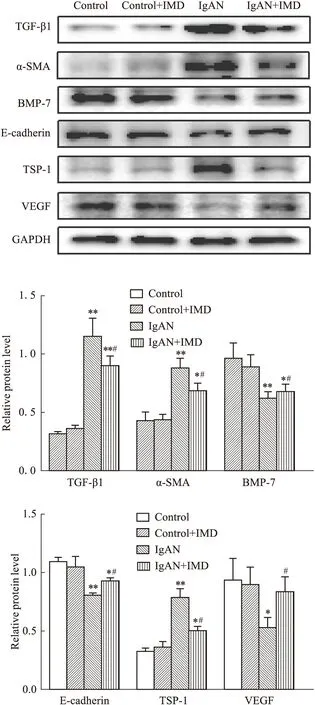
Fig 5 The protein levels of TGF-β1,α-SMA,BMP-7,E-cadherin, TSP-1 and VEGF after intermedin *P<0.05,**P<0.01 vs control group;#P<0.05 vs IgAN group.
IMD作为血管活性物质具有促进血管生成、维持血管正常形态和功能的作用[5],本研究进一步观察了IMD对血管损伤与修复相关细胞因子表达的影响。肾脏微血管病变与纤维化进展共存,当微血管减少时纤维化进行性加重。TGF-β1是肾纤维化的重要因子,也是肾微血管系统的关键介质,具有调节细胞外基质产生、诱导上皮间充质转分化等作用,可上调α-SMA的表达[10]。α-SMA是肌成纤维细胞的主要表型标志,当其表达增多时可引起组织纤维化、内皮功能障碍[11],进而导致肾组织缺血。BMP-7是TGF-β超家族成员,在肾脏主要分布在足细胞和肾小管上皮细胞中,其可通过抑制细胞外基质的产生发挥抗纤维化作用[12]。有研究表明[13],BMP-7可激活Smad1/5依赖性途径抑制TGF-β1诱导的α-SMA表达上调,同时减少E-cadherin的表达。本研究发现,与对照组相比,IgAN组TGF-β1与α-SMA的mRNA和蛋白表达水平均升高,BMP-7的mRNA和蛋白表达水平下降,经IMD干预后,TGF-β1与α-SMA的mRNA和蛋白表达水平下降,BMP-7的mRNA和蛋白表达水平则升高。由此推测,IMD可通过调节促纤维化因子与抗纤维化因子的表达来共同减轻肾脏纤维化,从而延缓IgAN的进展。
E-cadherin是钙依赖性的跨膜蛋白,参与内皮细胞间的黏附,在维持血管的极性和完整性方面具有关键作用,E-cadherin的减少或缺失也是上皮间充质转分化的重要特征[14]。VEGF作为血管生成的关键调节因子,具有促进内皮细胞迁移、增殖,增加血管通透性等作用[15]。TSP-1是一种细胞外基质蛋白,通过多种方式抑制新生血管的生成。研究表明,TSP-1能够抑制基质金属蛋白酶的活性来限制VEGF从细胞外基质释放,也可通过阻断VEGF的信号转导来抑制血管生成[16]。本研究发现[17],与对照组相比,IgAN组TSP-1的mRNA和蛋白表达水平均上升,而E-cadherin与VEGF的mRNA和蛋白表达水平均下降,经IMD干预后TSP-1的mRNA和蛋白表达水平下降,E-cadherin与VEGF的mRNA和蛋白表达水平均升高。既往研究发现[18],肾脏血管的丢失和纤维化均与VEGF和TSP-1的表达改变相关,而IMD可通过VEGF信号通路参与血管生成的调节。由此推测,IMD可通过上调VEGF的表达来调节促纤维化因子与抗纤维化因子的表达水平,同时上调E-cadherin的表达并减少TSP-1的表达来减轻肾脏微血管损伤和纤维化,起到保护肾脏的作用。
综上所述,IMD能够减少IgA在肾小球系膜区沉积,并调节血管损伤与修复相关细胞因子的表达来维持血管的功能,延缓IgAN进展,但其与免疫机制的相关关系仍需进一步研究阐明。

