STING激动剂释药系统的研究进展
张菁菁,冯 博,赵立波,梅 冬
(国家儿童医学中心,首都医科大学附属北京儿童医院药学部,北京 100045)
干扰素基因刺激因子(stimulator of interferon genes,STING)也称作MITA、ERIS、MPYS等,是目前药物研发领域非常受关注的靶点。STING激动剂可作为癌症、肥胖、肝损伤、病毒感染、糖脂代谢紊乱等多种疾病的新兴治疗药物,特别是在肿瘤的治疗上,STING激动剂可以激活机体内的固有免疫刺激和适应性免疫刺激,同时还能增强免疫细胞的抗肿瘤效应[1]。然而,市售和在研的STING激动剂大多呈负电性,与细胞表面的电荷性质相似,导致入胞困难,并且注射后容易被酶降解,或被快速代谢清除,限制了其临床转化与应用,因此,开发可克服这些缺点并可以靶向病灶的释药系统势在必行。
在本综述中,我们将讨论STING蛋白的结构和生物学功能,激活cGAS-STING通路的分子机制和生物学效应,此外,我们还总结了STING激动剂的分类和给药方式,并重点介绍了目前已报道的STING激动剂的递送系统,为STING激动剂释药系统的进一步研究提供参考。
1 STING生物学功能
STING是一种在某些微生物感染、自身免疫性疾病和癌症中被激活的细胞质衔接蛋白,由379个氨基酸组成,通过N端跨膜结构域(N-terminal transmembrane domain,NTD)锚定在细胞膜系统上,其C端为羧基末端结构域(carboxy-terminal domain,CTD),包括配体结合域(ligand binding domain,LBD)和C端尾部结构域(C terminal tail,CTT)。它是内质网中的跨膜蛋白,可通过招募、活化TANK结合激酶1(TANK-binding kinases 1,TBK1)以及下游的干扰素调控因子发挥生物学效应,在病原体(包括细菌和病毒)诱发的固有免疫、肿瘤细胞引起的抗肿瘤免疫以及自身细胞死亡导致的自身免疫中,发挥着关键作用。
STING是cGAS-STING信号通路中的关键蛋白。细胞稳态的破坏会导致细胞质DNA的积累,如内源性逆转录病毒、基因组不稳定性、DNA损伤、濒死细胞、受损线粒体、外泌体、DNA病毒、逆转录病毒和细菌等可导致双链DNA(double-stranded,dsDNA)的产生。这时环鸟苷单磷酸腺苷合成酶(cGAS)与dsDNA进行结合并被激活,二者以最小2 ∶2的比例生成多聚体,使cGAS的催化区域结构重新排布,进而将5′-三磷酸鸟苷(GTP)和5′-三磷酸腺苷(ATP)转化为环鸟苷酸-腺苷酸(cGAMP)。作为二级信使,cGAMP与其他环状二核苷酸(cyclic dinucleotides,CDNs)可以激活内质网定位的STING蛋白,激活的STING构象发生改变,从内质网易位到高尔基体,并在那里招募激酶,进一步激活下游的TBK1以及转录因子干扰素调节因子3(interferon regulatory factor 3,IRF3),诱导Ⅰ型干扰素(type I interferon,Ⅰ型IFN)的产生,并进一步激活抗肿瘤CD8+T细胞,这就是最经典的cGAS-STING-TBK1-IRF3-Ⅰ型IFN通路。除此之外,cGAS-STING信号通路的激活还可以促进肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)和白细胞介素6(interleukin 6,IL-6)等炎症因子的表达分泌,进而发挥多种生物学效应。
2 STING激动剂分类
STING激动剂按结构可以大致分为两种类型,一种是环状二核苷酸(cyclic dinucleotides,CDNs)及其衍生物,另一种是非CDNs的小分子化合物。
2.1 STING-核苷酸类激动剂CDNs是STING蛋白的激动剂,由环二鸟苷酸(c-di-GMP)、环二腺苷酸(c-di-AMP)、cGAMP组成,其中,cGAMP包含3′,3′-cGAMP,2′,3′-cGAMP,3′,5′-cGAMP和2′,5′-cGAMP。内源性CDNs为负电性的亲水小分子,不易进入细胞质,又易被外核苷酸焦磷酸酶/磷酸二酯酶(ecto-nucleotide pyrophosphatase /phosphodiesterase,ENPP1)快速降解失活,严重影响其药效发挥[2]。为了解决这些问题,可以对CDNs进行化学修饰,修饰位点主要集中在磷酸、碱基、核糖及核苷酸间的连接位置等。例如,Li等[3]发现3′-OH是ENPP1水解的关键基团,便对CDNs的磷酸基团进行修饰,合成了一系列2′,3′-cGAMP的抗水解硫代磷酸酯类似物,Katiban等[4]从合成出硫代磷酸酯类的CDNs中分离纯化得到单一构型的Rp,Rp-2′,3′-c-diAMPSS(ADU-S100),实验测得ADU-S100在THP-1(人髓系白血病单核细胞)中的活性明显高于2′,3′-cGAMP,对肿瘤生长有明显的抑制作用,并能抑制癌细胞的转移。ADU-S100是进入临床试验的第一个CDNs衍生物,而在ADU-S100的基础上对CDNs的核糖进行修饰,发现双氟取代的硫代磷酸酯类CDNs的活性相比ADU-S100又提高了数倍。
2.2 STING-非CDNs激动剂除了上述CDNs类的STING激动剂,还有一些非CDNs的小分子化合物也可以激活STING蛋白,按结构可以分为以下几种类别。
3 STING激动剂的临床转化
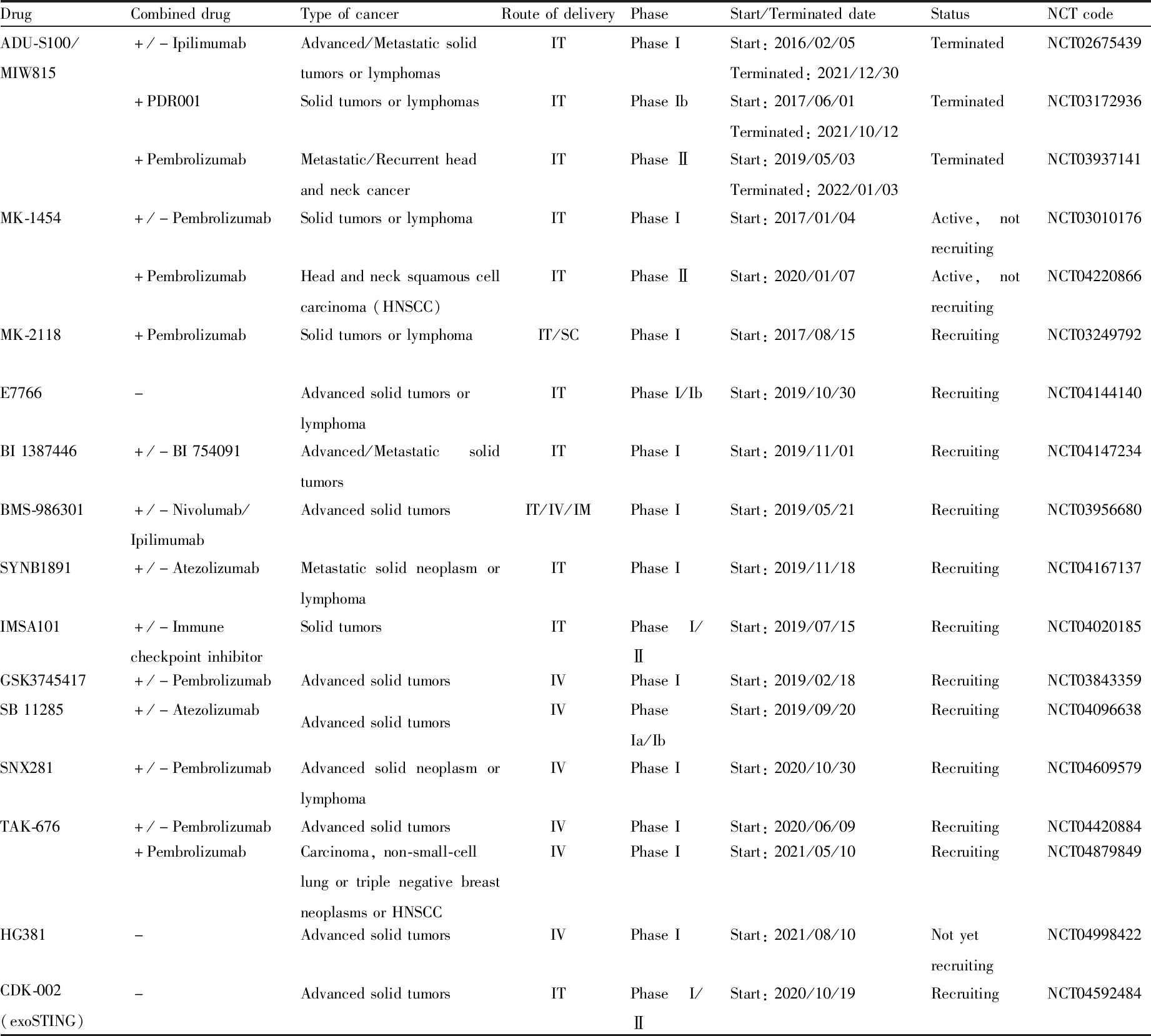
3.1 STING激动剂的临床试验利用STING激动剂激活cGAS-STING通路,可以促进肿瘤消退、延长荷瘤动物存活时间和增强免疫力。由于其在动物模型中表现出良好的抗肿瘤效果,目前,全球已有10多项临床研究正在进行中,下表总结了在研或已完成的STING激动剂相关的临床试验[11]。
这些已经在clinicaltrials网站上注册的临床研究大多处于受试者招募阶段或者正在进行中,仅一项“ADU-S100和Pembrolizumab在头颈癌中的疗效和安全性试验”(NCT03937141)报道了临床研究结果,该研究共纳入16名患转移或复发头颈癌的受试者,所有受试者均接受ADU-S100和Pembrolizumab单抗联合治疗,根据缓解评估标准进行评估,6名受试者表现出疾病缓解,其中5名为部分缓解,1名为完全缓解,总体来说没有观察到显著的抗头颈癌活性;该研究报道的全因死亡病例为6/16(37.50%),严重不良事件有应激性心肌病、细胞因子释放综合征、败血症和急性肾损伤等,其他(不包括严重)不良事件有疲劳、恶心、腹泻、贫血和体重减轻等,但由于本研究所有受试者均接受了联合治疗,无法判断这些不良事件的发生是否与ADU-S100相关[11]。
3.2 STING激动剂临床转化的瓶颈对于市售的CDNs类STING激动剂,大多具有以下特点,第一,CDNs本身带负电荷,具有水溶性,易在体内扩散且不易通过细胞膜;第二,CDNs易被膜ENPP1降解,易被代谢清除,血清半衰期较短;第三,给药后,患者体内药物浓度剧增,且波动极大,不能实现局部稳定的药物浓度,可能诱导炎症或自身免疫性疾病;第四,缺乏靶向性,难以靶向输送到特定免疫细胞亚群,易引起脱靶效应,导致过度刺激或自身免疫副作用等不良反应。这些特点抑制了STING激动剂巨大的抗肿瘤免疫能力,限制了其临床转化和应用[2]。目前,研究者们正通过对STING激动剂进行结构修饰或开发新型释药系统的方式尝试解决这些问题。
4 STING激动剂释药系统
4.1 传统给药方式STING激动剂的给药方式主要有两种,一种是瘤内注射给药,这种方式可以提高肿瘤局部的药物浓度,产生抗肿瘤效果,但具有一定局限性,如治疗的肿瘤类型有限,感染和不良反应风险较高,患者依从性较差等;另一种是全身给药,可以通过口服、腹腔和静脉注射等方式给药,一定程度上扩大了治疗范围,解决了部分瘤内给药的局限性。

Tab 1 Structural types and examples of non-CDNs STING agonist
Tab 2 Summary of STING agonist clinical trials
在一些临床相关肿瘤模型中,可通过瘤内注射STING激动剂来刺激有效的抗肿瘤免疫。目前的临床试验中,STING激动剂的给药方案大多为多次瘤内重复给药,治疗周期较长,甚至需要长达2年才能达到治疗效果。这样的给药方案使治疗范围局限在易于注射到的实体肿瘤类型,如黑色素瘤,然而,如血液肿瘤和恶性肿瘤则需要全身给药的方法。除此之外,长期的高给药频率可能会导致慢性注射疼痛,产生破坏肿瘤微环境(TME)和血管网络的风险,还可能会促进癌细胞的外渗和转移,增加感染风险和不良反应。再加上每次给药都需要进行医学检查,导致患者依从性较差,这些均可能导致治疗的失败。目前,已有学者将全身给药时治疗效果差或不良反应风险高的STING激动剂制成不同的给药剂型,以提高全身给药后STING激动剂的细胞摄取和肿瘤靶向疗效。
另外,一些非核苷酸型小分子STING激动剂可以直接进行全身给药。例如,MSA-2,具有独特的作用机制而优先靶向肿瘤组织,口服后,MSA-2单体与MSA-2的非共价二聚体平衡存在,在酸性的TME中,会发生可逆的非共价二聚反应,成为药理活性配体,进而激活STING蛋白[10]。diABZI可通过静脉注射全身给药,给药后在具有免疫活性的小鼠体内会产生很强的抗肿瘤活性,使肿瘤完全、持久消退[8]。SR-717,为直接的cGAMP模拟物,具有抗肿瘤活性,研究中通过腹腔注射进行全身给药,可解决瘤内给药的局限性,并在没有产生明显毒性的情况下使疗效阈值下降[5]。

Tab 3 Carrier types and examples of STING agonist nanoparticles
4.2 新型药物递释系统粒度大的递药载体一般是瘤内给药后在原位发挥作用,而粒度小的载体更容易向远端输送药物。研究STING激动剂的递药载体,需要实现两个目标:第一,在组织水平,载体能够驻留在肿瘤病变的周围进而发挥作用;第二,在细胞水平,药物递送载体可以穿过细胞膜到达内质网,并且保护它们在传输过程中不被核内体分解。据已有的文献报道,STING激动剂可制成纳米粒子(纳米复合物)、脂质体、外泌体和水凝胶等剂型,下面,我们将分别进行介绍。
4.2.1纳米粒(nanoparticles) 纳米载体已被用于各种分子佐剂的体内递送。利用纳米载体递药,可以避免药物的快速清除,延长STING激动剂在肿瘤内的停留时间,并使其更易跨越生物屏障,进而控制固有免疫和适应性免疫的激活,提高疗效[1]。纳米药物递释系统转运药物的形式取决于其形态和表面特征。由于CDNs的阴离子性质,通常使用阳离子纳米载体来增强CDNs的传递,但阳离子载体具有一定的细胞毒性,而采用可生物降解的材料可以减少与阳离子载体相关的毒性问题。除此之外,还可以利用环境响应型纳米载体来实现STING激动剂的智能递送。
4.2.2脂质体(liposomes,LPs) 脂质体是FDA批准的第一个纳米生物治疗药物,是一类由类脂质双分子层构成的微型泡囊体结构的载药体,其结构类似于细胞膜,生物相容性好,易与细胞融合,安全且无免疫原性,通过各种修饰可以实现药物的靶向传输和缓控释。脂质体类的药物递送载体已经研究了多年,目前在临床已经逐渐展开应用,与直接给药相比,脂质体递药载体能提高药物的细胞膜通透率,降低清除率,延长药物的作用时间,增加药物的稳定性,通过化学修饰还可以提高药物的包封率和载药量。
STING激动剂CDNs可作为疫苗佐剂通过脂质体给药。Cheng等[17]用氢化L-α-磷脂酰胆碱(大豆-PC)和1,2-二油酰-3-三甲基-氨丙烷(DOTAP)包覆cGAMP得到cGAMP Soy-PC-DOTAP脂质体,可增强固有免疫激活和抗肿瘤作用。特别是在程序性死亡配体1(PD-L1)不敏感的三阴性乳腺癌(TNBC)模型中,可以诱导多种炎症因子对抗癌症,如促炎细胞因子、一氧化氮和I型IFN等。Koshy等[18]采用DOTAP和胆固醇包载cGAMP,制备具有不同聚乙二醇(PEG)表面修饰率的阳离子脂质体,在抗原呈递细胞(APC)中进行的体外研究表明,相比于游离药物,脂质体明显改善了cGAMP的细胞摄取,将载cGAMP的脂质体注射到原位黑色素瘤中,可诱导肿瘤消退并产生免疫记忆。吸入含CDNs的脂质体可以有效克服免疫抑制,对抗肺癌转移。Liu等[19]采用两步水包油反相微乳液法和脂包覆法制备了含有cGAMP的磷脂酰丝氨酸包被脂质体(PS-coated-NP-cGAMP),被肺转移模型小鼠吸入后可使cGAMP迅速分布到双肺,随后被APC摄取。
STING激动剂还可以包载于脂质体中增加靶向递送,减少不良反应。Miyabe等[20]用一种具有很高融合性的pH敏感的脂质材料YSK05作为载体,包裹c-di-GMP得到c-di-GMP/YSK05脂质体,该脂质体可以将c-di-GMP转运到胞质中,促进抗原特异性细胞毒T细胞活性,抑制小鼠模型中肿瘤的生长。单纯注射c-di-GMP在淋巴/引流淋巴结(dLNs)中的吸收极少,反而迅速分布到血液中,导致全身炎症。Hanson等[21]将c-di-GMP包载在聚乙二醇化脂质纳米粒中得到NP-cdGMP,可定向将c-di-AMP输送到dLNs中,减少全身分布。
4.2.3外泌体(exosome) 外泌体是由细胞产生的被分泌到细胞外的囊泡体,包含核酸、蛋白质和细胞代谢产物等,可发挥生物学效应。外泌体作为载体具有比脂质体更优良的生物兼容性和稳定性,当暴露在炎性环境中,仍然具有较长的体内循环时间和良好的靶向性[22]。近年来,外泌体作为癌症治疗的药物载体被广泛研究。McAndrews等[23]报道使用外泌体可有效递送STING激动剂,并提高抗肿瘤免疫能力抑制肿瘤生长。与游离药物相比,包载cGAMP的外泌体载体iExoSTINGa在APC中选择性靶向STING通路,具有更强的抑制B16F10小鼠黑色素瘤生长的效力。Jang等[24]用外源的工程化细胞外囊泡(EV)装载CDN,得到exoSTING,该载体利用EV的自然生物学特性,在肿瘤细胞和APC之间实现信号传递,增强了CDN的效力,延长了药物的肿瘤驻留时间,并且,在治疗有效剂量下的exoSTING不会诱导全身炎性细胞因子风暴,从而扩宽了STING激动剂的治疗窗。目前,该给药系统已经在开展一项“CDK-002(exoSTING)在晚期/转移性、复发性、可注射实体瘤受试者中的首次人体研究”的临床试验,正在进行受试者招募中(NCT04592484)。
4.2.4水凝胶(hydrogels) 水凝胶可作为局部释放药物的载体,可以进行多功能设计,实现疾病触发的原位组装、水凝胶程序降解和持续的药物释放。基于透明质酸(hyaluronic acid,HA)的水凝胶支架在递送免疫调节药物方面具有生物相容性和控制药物释放的生物学优势。Lee等[25]以线性聚乙烯亚胺(LPEI)/HA水凝胶为原料,通过反相油包水(W/O)乳液/交联的方式包裹cGAMP,得到了LH/cGAMP凝胶,可以作为安全有效的疫苗接种和免疫治疗佐剂。Matrigel是一种包含层粘连蛋白和胶原蛋白IV的热响应水凝胶,易溶于水,可吸收水溶性物质,在体温下形成凝胶状固体,降解速度快。Baird等[26]将STING配体与Matrigel结合后,将水凝胶送入头颈部鳞状细胞癌小鼠模型的次全切除腔中,实现了局部肿瘤的治愈。Leach等[27]开发了一种可注射的环双核肽负载多结构域肽水凝胶,称之为STINGel,可定位并控制CDNs的肿瘤内递送,与CDNs单药注射治疗相比,显著提高了小鼠口腔癌模型的总体生存率。
4.3 其他缓控释体系除了上述的递送体系之外,也有研究报道基于微材料的药物递送系统,即采用微米级别的粒子(MP)作为递送载体来实现STING激动剂的智能递送。例如,Junkins等[28]使用电喷雾法将cGAMP包载于酸敏感的乙酰化右旋糖酐(Ace-DE)聚合微粒子(MPs)中,得到Ace-DEX cGAMP MPs,与可溶性cGAMP相比,在体外增强了近1 000 倍的Ⅰ型IFN应答,在体内增强了50倍的应答。
脉冲给药系统是一种定时定位可控性强的给药系统,可以在预定时间快速释放有效治疗剂量的药物,可用于时辰节律性疾病的治疗,能够弥补传统制剂的不足。Lu等[29]开发了聚乳酸-羟基乙酸(PLGA)微粒子用于肿瘤免疫治疗STING激动剂的长期脉冲释放。微合成PLGA颗粒作为载体材料装载cGAMP得到PLGA-MPs,它可以停留在注射部位,并在预定的时间点以可编程的脉冲序列释放包载的STING激动剂,模拟数天至数周的多次注射,可以减少注射次数,降低多次注射导致的肿瘤转移风险。
5 总结与展望
STING蛋白自被发现便引发了广泛关注,STING激动剂也被众多学者所研究。研究表明STING激动剂对多种疾病表现出治疗潜力,但大部分STING激动剂具有亲水性、易酶解性、不易入胞、半衰期短和缺乏靶向性等特点,限制了其临床转化。因此,利用合适的药物递送系统,如纳米粒(纳米复合物)、脂质体、外泌体和水凝胶等,递送STING激动剂可以增强其治疗效果。但现阶段这些释药系统绝大多数停留在临床前研究阶段,有多方面的原因:一是载体的安全性难以确保,载体的生物相容性和潜在安全问题的高度不可预测性,给这些新型释药系统的转化带来了很大的挑战;二是载药体系临床前安全评估的局限性,载药体系的理化性质通常是基于简化的模型来设计和确定的,从动物到人体的药物代谢动力学、生物分布、生物相容性和安全性是不完全对等的,无法进行准确推算;三是载药体系从实验室到中试放大也面临着一些困境,对于复杂的载药体系而言,其批量生产对制药企业的生产单元和制造工艺提出了更高的要求和挑战,当涉及多个步骤或复杂工艺时,其大规模和重复性地制备将更加困难[30]。
总之,STING激动剂释药系统的研究开发,为STING激动剂单药治疗中存在的不足提供了解决方案,但要将STING激动剂释药系统进行临床转化,仍有许多问题亟待解决,对此我们还有很长的路要走。目前,囊泡包裹的STING激动剂exoSTING正在开展临床Ⅰ期和Ⅱ期试验,为STING激动剂的新型释药系统向临床转化迈出了第一步,相信未来随着医药科学的不断发展,STING激动剂释药系统的研究会更加广泛和完善,并为临床上肿瘤的治疗带来新的契机。

