2396株肠球菌属细菌的临床分布及耐药性变迁
王丹 林志强 阮永春 周宜庆 李明晖
(浙江大学绍兴医院 绍兴市人民医院,绍兴 312000)
肠球菌是一类广泛存在于土壤、植物以及人类和动物胃肠道中的革兰阳性球菌,它是人类及动物肠道微生物组的核心成员,维持着机体微生态环境的稳定。从医院获得性感染患者中分离到的常见微生物中,肠球菌排名基本在第2~3位[1]。随着抗生素的广泛应用,由于肠球菌对抗生素的敏感性下降,导致了耐药菌的大量出现,其引起疾病挑战日益加剧。耐万古霉素肠球菌(vancomycin resistantEnterococcus,VRE)自20世纪80年代中期被发现后,随即在全球蔓延,甚至在一些医院发现多达80%的屎肠球菌分离株对万古霉素耐药[2]。耐药肠球菌的产生不仅加大了临床抗感染工作的难度,而且导致大量社会医疗资源被占用、耗损,促使其成为了一个需迫切解决的重要公共卫生问题。
为了解本院肠球菌的耐药现状以及近年来细菌耐药性的动态变化,本研究收集2015年1月—2020年12月本院住院患者临床分离的肠球菌实验室资料及相关的临床信息,进行回顾性分析,通过对本院肠球菌的感染情况、耐药菌的临床分布特点及耐药趋势变迁分析,为临床合理使用抗感染药物提供有力依据,有效减少耐药菌的产生。
1 材料与方法
1.1 菌株来源
收集2015年1月—2020年12月我院各类临床标本中检出的所有肠球菌属菌株,标本均由我院临检中心微生物室参照美国临床和实验室标准化协会推荐的药敏试验要求检出并审核,且所有的标本采集符合我院临床检验标本采集规范,同一患者同一部位检出的重复株以第1次计算。
1.2 仪器
药敏纸片由Oxoid公司提供;E试验条由Bio-Merieux公司提供;BioMerieux全自动微生物鉴定仪Vitek 2 Compact。
1.3 实验方法
运用法国Bio- Merieux全自动微生物鉴定仪进行菌株鉴定以及最低抑菌浓度检测,采用纸片法或自动化仪器法进行抗菌药物耐药性检测,质控菌株:粪肠球菌ATCC29212。药敏试验参照美国临床和实验室标准化协会推荐的药敏试验方法进行并判读结果,其中替加环素的判断标准按美国食品药品监督管理局文件标准。用MH培养基进行药敏试验,涂布完成后将接种好的平板在15 min内放置35℃孵育18~24 h。四环素、替考拉宁、氨苄西林、高浓度庆大霉素、环丙沙星、左氧氟沙星、红霉素和万古霉素常规采用K-B法药敏试验。对万古霉素、利奈唑胺、替考拉宁的纸片或自动化检测为不敏感菌株时,则采用万古霉素、利奈唑胺、替考拉宁E试验条测试MIC值确认。
1.4 统计学方法
运用SPSS 21软件对数据进行统计学分析,计数资料以例数或百分比表示,组间率的比较采用χ2检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 肠球菌属菌种分布
2015年1月—2020年12月我院共检出肠球菌2396株,包括粪肠球菌(E.faecalis)11204株,屎肠球菌874株(E.faccium),鹑鸡肠球菌(E.gallinarum)123株,鸟肠球菌(E.avium)70株,铅黄肠球菌(E.casselifavus)76株,海氏肠球菌(E.hirae)17株;棉子糖肠球菌(E.raffinosus)16株;耐久肠球菌(E.durans)15株;哥伦比亚肠球菌(E.columbae)1株;分布以粪肠球菌和屎肠球菌为主,粪肠球菌占50.25%,屎肠球菌占36.48%,鹑鸡肠球菌占5.13%,而海氏肠球菌、棉子糖肠球菌、耐久肠球菌 以及哥伦比亚肠球菌占比均不足1%,见表1。
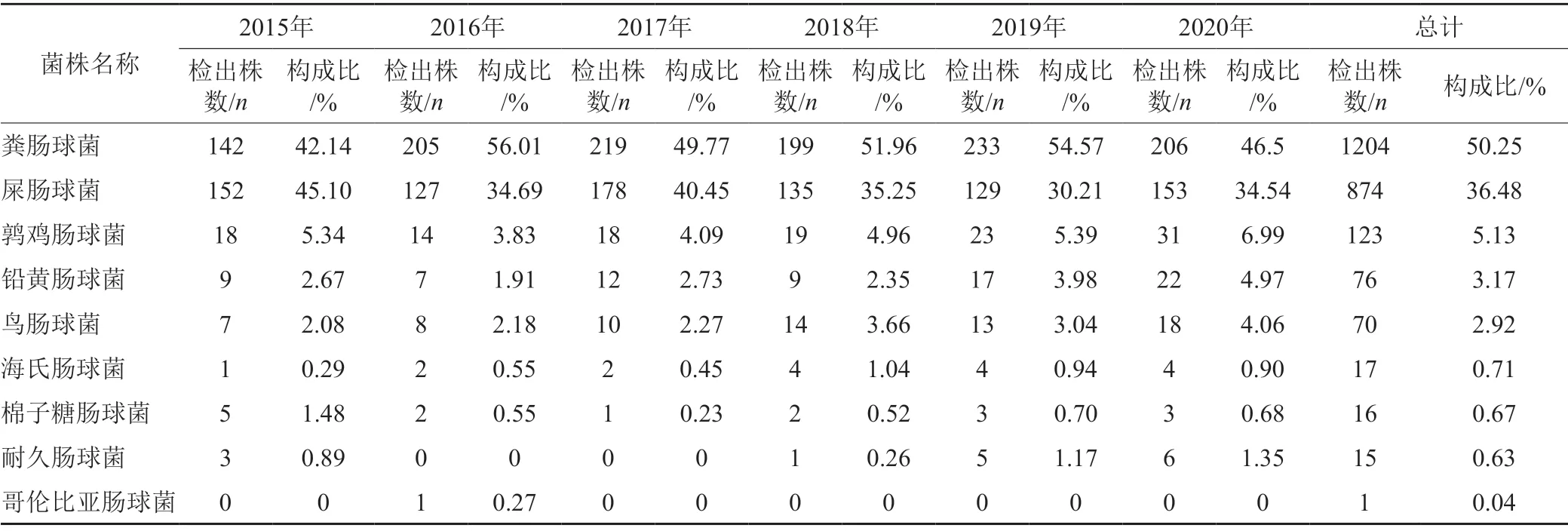
表1 2015—2020年分离肠球菌属菌种基本情况Tab.1 Basic information of Enterococcus strains isolated from 2015 to 2020
2.2 肠球菌属临床标本分布情况
2396株肠球菌临床分离标本中尿液共1070 株(占44.65%),胆汁747株(占31.17%),引流液263株(占10.97%),血液97株(占4.05%),分泌物67株(占2.79%),脓液54株(占2.25%),腹水27株(占1.13%);而导管、痰液、胸水、脑脊液、前列腺液、关节液等检出菌株少,占比不足0.5%。尿液标本所占比例逐年下降,脓液、胆汁、引流液标本所占比例上升。分离肠球菌属临床科室以外科为主,共1662株(占69.36%),内科462株(占19.28%),ICU、急诊183株(占7.64%),儿科及妇科占比不足5%,见表2。
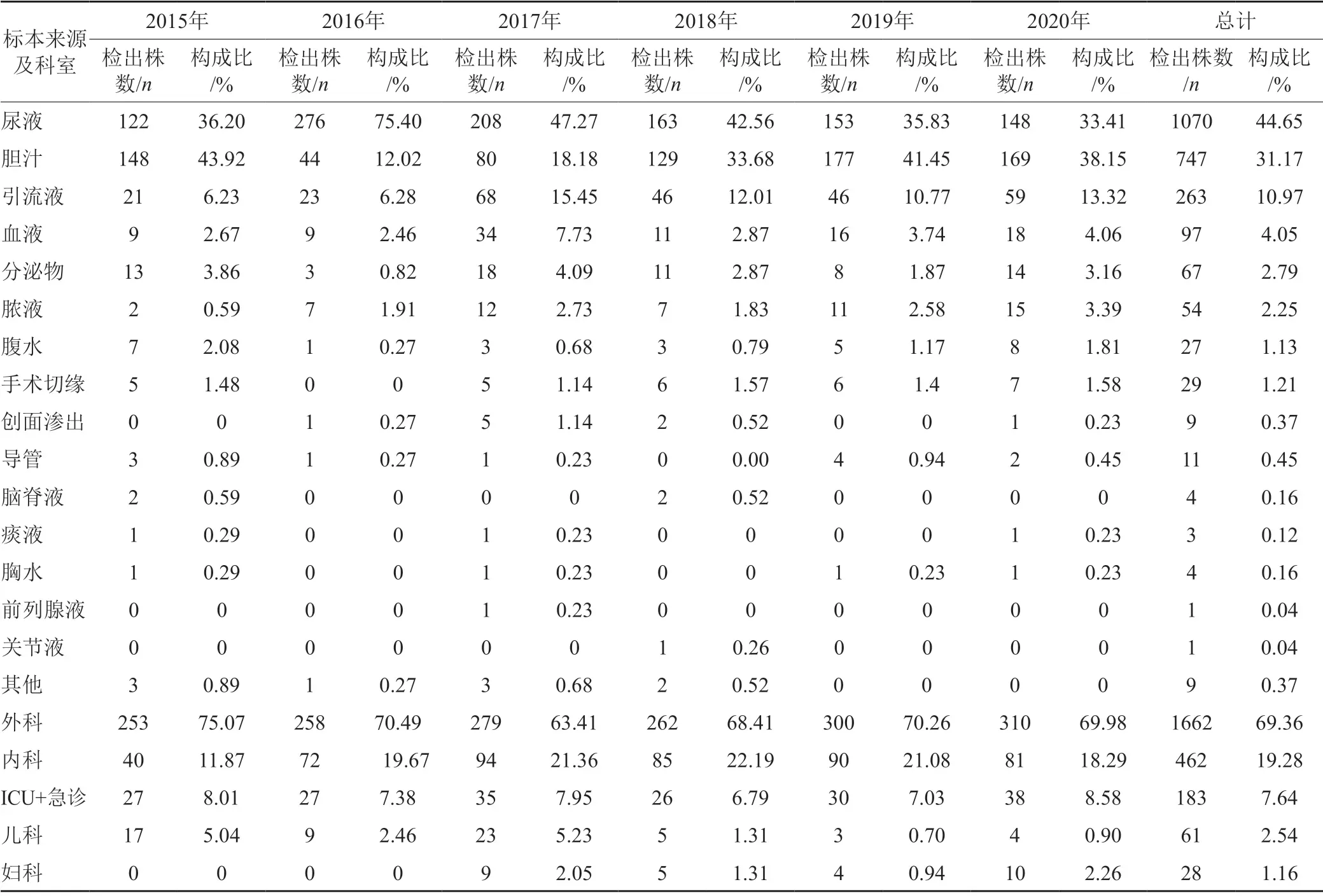
表2 2015—2020年肠球菌属临床标本及科室分布Tab.2 Clinical specimens and department distribution of Enterococcus from 2015 to 2020
2.3 肠球菌对不同抗生素的药敏情况
2015年1月—2020年12月屎肠球菌对左氧氟沙星耐药率高于75%,对氨苄西林、红霉素的耐药率高于80%,对利奈唑胺、喹努普汀/达福普汀耐药率低于10%,对替加环素、替考拉宁、万古霉素耐药率低于5%。6年来屎肠球菌中共检出VRE 9株,利奈唑胺耐药株35株,替加环素耐药株6株,替考拉宁耐药株16株,高浓度链霉素耐药率由59.2%下降至28.7%,呈现逐年下降趋势(P<0.001),高浓度庆大霉素耐药率从61.2%下降至28.8%(P<0.001),但呋喃妥因耐药率由46.6%上升至61.5%(P<0.05),见表3。
2015—2020年粪肠球菌对喹努普汀/达福普汀耐药率均高于70%,对四环素耐药率高于48%,对高浓度庆大霉素耐药率高于20%,而环丙沙星、莫西沙星、左氧氟沙星、氨苄西林和青霉素G耐药率则低于25%,呋喃妥因、替加环素和万古霉素耐药率均低于4%。所有粪肠球菌中共检出耐万古霉素菌株5株,替加环素耐药株4株,见表3。纵观6年整体耐药率显示屎肠球菌对高浓度链霉素、喹诺酮类、氨苄西林、青霉素G、呋喃妥因、红霉素耐药率明显高于粪肠球菌(P<0.001),而粪肠球菌对四环素、喹努普汀/达福普汀的6年整体耐药率高于屎肠球菌(P<0.001)。

表3 屎肠球菌和粪肠球菌对抗菌药物的耐药率Tab.3 Drug resistance rate of E.faecium and E.faecalis to antibiotics
2015—2020年铅黄肠球菌对万古霉素耐药率达98%以上,红霉素耐药率高于90%,而对四环素、利奈唑胺耐药率均低于15%,环丙沙星、莫西沙星、氨苄西林、呋喃妥因耐药率均低于5%,所有菌株中未检出替加环素以及高浓度庆大霉素耐药株;鹑鸡肠球菌对红霉素、万古霉素耐药率高于80%,对喹努普汀/达福普汀耐药率高于50%,而对高浓度庆大霉素、莫西沙星、环丙沙星、氨苄西林、高浓度链霉素、呋喃妥因耐药率均低于30%,对利奈唑胺耐药率则低于10%,菌株中亦未检出替加环素耐药株;鸟肠球菌对四环素、氨苄西林耐药率高于50%,对利奈唑胺、莫西沙星、环丙沙星、替加环素和万古霉素耐药率低于10%,所有检出鸟肠球菌菌株中发现耐替加环素菌株1株,见图1。其他肠球菌属分离出菌株数少,6年来不足20株,无明显代表意义,故对其药敏试验数据不作统计和分析。
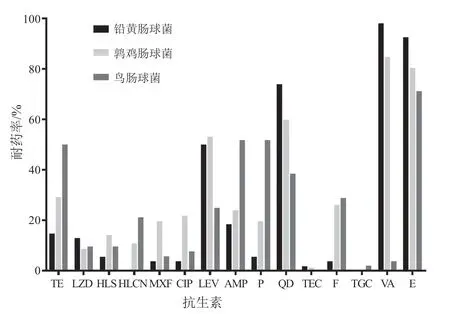
图1 2015-2020年其他肠球菌属对不同抗菌药物的耐药率Fig.1 Different antibiotic resistance rates of other Enterococcus genera
3 讨论
肠球菌是革兰阳性、兼性厌氧球菌,可在10℃~45℃环境生长,亦能在pH4.4~9.6范围内生长,在6.5% NaCl的高盐介质中也能生长[3]。肠球菌是人类和动物的共生菌群,以前被认为是临床影响最小的微生物,现在已成为人类常见的机会致病菌[1]。作为最常见的院内病原体之一,肠球菌可引起严重的感染和疾病,如心内膜炎、菌血症、泌尿系统、腹腔和盆腔感染、中枢神经系统感染等。纵观中国细菌耐药性监测网肠球菌检出率呈逐年增加趋势,从2015年检出肠球菌共7876株,2016年检出12759株肠球菌,2017年检出16043株,到2018年检出肠球菌株数高达18717株[4-7]。另一项研究关于2014—2018年加拿大70所医院100万住院治疗的患者回顾性分析结果表明,肠球菌检出率显著增加,其中VRE感染增加了148%[8]。这些结果的出现与近年抗菌药物的不合理应用、侵入性操作的大量开展以及免疫抑制人群增多等诸多因素息息相关。中国细菌耐药监测网显示逐年增多的肠球菌属检出均以屎肠球菌为主[4-7],2015年检出肠球菌菌株中粪肠球菌、屎肠球菌分别占42.7%和50.1%,两者比例相当,2018年检出粪肠球菌、屎肠球菌分别占肠球菌株39.5%和52.8%,屎肠球菌检出比例显著上升。然而在我院连续6年检出的2396株肠球菌中粪肠球菌占50.25%,屎肠球菌占36.48%,构成比虽与全国细菌耐药监测网数据相近,但结果仍以粪肠球菌为主,考虑可能与我院肠球菌属检出标本大部分来源于外科(占69.36%),患者诊治的疾病迥异以及对抗生素需求不同等因素有关。随着导管、支架等侵入性治疗在临床被越来越多的应用,肠球菌属仍是引起尿路感染的第2大病原菌[3]。在本研究中,2396株肠球菌有1070株分离自临床尿液标本,占比44.65%,分析原因首先考虑肠球菌是泌尿道的定植菌,其次尿路感染的诊断绝大部分来自于中段尿培养提供的微生物证据,因此在尿路感染中肠球菌属仍是重要的病原菌。但针对尿路感染患者的经验性抗生素治疗时,仍应综合评估患者情况决定是否覆盖肠球菌。临床上呼吸系统、脑脊液、前列腺和骨关节等不是肠球菌的常见定植部位,故上述部位检出肠球菌菌株少,本研究检出菌株分布结果也与之相符。
我院临床分离的肠球菌对替加环素、替考拉宁、利奈唑胺和万古霉素普遍敏感,但铅黄肠球菌对万古霉素耐药率达98%,鹑鸡肠球菌耐药率高达85%,分析与这两种菌属都携带相同染色体基因簇,参与了vanC和vanT基因编码合成的肽聚糖前体有关[9],因此在治疗这两种细菌引起的疾病时应避免使用万古霉素,通过合理选择抗生素以积极遏制耐药菌播散。另铅黄肠球菌对呋喃妥因耐药率低于5%,这与张娜等[10]的研究结果一致,呋喃妥因在尿液中药物浓度较高,细菌耐药率低,故可作为上述细菌引起尿路感染的经验治疗。鸟肠球菌对莫西沙星、环丙沙星、利奈唑胺、替加环素和万古霉素耐药率低,但也已检出替加环素、万古霉素耐药株,临床应引起高度重视。耐万古霉素屎肠球菌、粪肠球菌株经耐药表型检测或PCR检测出常见的耐药基因为vanA、vanB、vanM型,而其中vanA介导的耐药性通常高于其他类型,并可引起细菌对替考拉宁的交叉耐药。目前研究者已发现vanA基因簇可跨越种属转移的质粒和转座子播散至其他菌种,包括耐甲氧西林的金黄色葡萄球菌(MRSA)的临床分离株等,这些发现都强烈显示耐万古霉素的基因簇可以跨越菌种屏障传播,更深刻地提醒我们需积极阻止抗菌药物的滥用,限制抗生素的选择[11-12]。屎肠球菌被发现对多种抗生素有耐药性,这一特点使其能在敏感微生物被抗生素清除时仍继续存活并增殖,同时也是屎肠球菌能在院内感染中获得一席之地的重要原因。在本研究中,我院检出的屎肠球菌对喹诺酮类、氨苄西林、红霉素、呋喃妥因、高浓度链霉素和高浓度庆大霉素的耐药率6年来持续处于高水平,但有逐年下降趋势,提示近年临床抗菌药物使用合理,但基于总体的高水平耐药率以及对多种抗生素耐药的特点仍建议抗感染治疗屎肠球菌时避免使用上述药物。新型链阳菌素喹努普汀/达福普汀对其耐药率6年来均低于10%,提示临床该药可用于治疗屎肠球菌引起的感染性疾病,但仍需注意药物不良反应。我院检测出的粪肠球菌对喹诺酮类、青霉素G、氨苄西林和呋喃妥因总体耐药率低,仍可作为治疗粪肠球菌感染的首选药物。虽然对高浓度链霉素、高浓度庆大霉素耐药率高于20%,但值得庆幸的是,粪肠球菌对两者的耐药率呈逐年下降的变化,如临床需要,亦可考虑氨苄西林联合庆大霉素治疗该菌,但方案应结合感染部位进行综合选择。越来越多研究发现肠球菌可通过接合的方式,从质粒、转座子、大片断的染色体DNA等途径获取新的耐药基因[13],使定植菌群获得更强的耐药性,基于此希望在工作中尽可能根据药敏情况合理选择抗生素,避免细菌耐药性的出现。从我院连续6年的耐药率分析,除四环素、喹努普汀/达福普汀外,粪肠球菌整体耐药率低于屎肠球菌,而对于利奈唑胺、替加环素及万古霉素两者整体耐药率无明显变化。不同肠球菌属细菌对不同抗生素耐药率不同,即便同一种抗生素对不同的肠球菌属细菌耐药率也存在明显差异,在临床治疗过程中,应根据细菌临床分布特点以及本院的耐药性变迁合理选择抗生素,防止耐药菌的进一步增长。

