脐血来源NK细胞的体外扩增及其抗肿瘤细胞活性的研究
韩强,张志刚,刘坤,朱贤兑,金媛媛,张志斐,杨兆勇
·论著·
脐血来源NK细胞的体外扩增及其抗肿瘤细胞活性的研究
韩强*,张志刚*,刘坤,朱贤兑,金媛媛,张志斐,杨兆勇
063210 唐山,华北理工大学药学院(韩强、刘坤、朱贤兑、张志斐);061000 沧州,沧州市人民医院病理科(张志刚);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所代谢工程室(金媛媛、杨兆勇)
研究脐血单个核细胞来源 NK 细胞的培养方法及其对不同类型肿瘤细胞的杀伤活性。自脐静脉消毒后全封闭采集脐血,肝素抗凝,分离单个核细胞,用 NK细胞培养基培养 14 d,流式细胞仪检测其表面标志,并使用 RTCA 实时无标记细胞分析技术检测细胞增殖曲线,观察 NK 效应细胞按效靶比 1:1、5:1 与 10:1 对肿瘤细胞的杀伤作用。培养 14 d 的脐血单个核细胞,细胞总数扩增 294 倍,其中 NK 细胞扩增5580 倍。NK 细胞 CD3-CD56+阳性率为 97.93%,与杀伤功能相关的重要分子 CD16、NKG2D、NKp30、NKp44 的表达阳性率均在 95% 以上。对 A549 肺癌细胞株作用 6 h 的杀伤活性,在 1:1 ~ 10:1 效靶比范围内,随着效靶比增加,杀伤活性从(78.16 ± 2.41)% 逐渐增强到(95.71 ± 3.21)%;并且在效靶比 1:1 的情况下,随着作用时间从 6 h 延长到 24 h,杀伤活性也从(78.16 ± 2.41)% 逐渐增强到(96.33 ± 2.15)%。建立了无需分选细胞、无需滋养层细胞、操作简单、通用性强的脐血 NK 细胞培养方法,获得的 NK 细胞纯度高,对肿瘤细胞的杀伤作用强。
自然杀伤细胞; 脐血; 表面标志; 实时无标记动态细胞分析技术; 体外扩增; 抗肿瘤
自然杀伤细胞(natural killer cell,NK 细胞)是区别于特异性免疫,在人体内执行非特异性免疫功能的一类大颗粒淋巴细胞群,可以监视并且对体内衰老、感染和畸变细胞进行快速清除[1]。目前有多种途径能够获得 NK 细胞,较为成熟的来源有脐带血、外周血等;也有通过基因编辑如诱导多能干细胞来进行 NK 细胞制备。使用脐带血制备的 NK 细胞有许多优势,例如不需要基因编辑,相较于外周血制备的 NK 细胞,脐带血制备的 NK 细胞具有较低的免疫原性等。基于异体回输 NK 细胞的免疫疗法已被证明在人体内几乎不会发生严重排异反应[2],经过特定方式诱导培养的脐带血 NK 细胞能够满足数十次临床回输需求,展现了脐带血 NK 细胞较强的体外扩增能力。
本研究探索了一种简单、稳定的脐带血来源 NK 细胞的体外大规模扩增方法,并且对获得的高活性 NK 细胞进行了体外实体肿瘤细胞杀伤作用研究,以期为 NK 细胞治疗实体瘤提供理论依据。
1 材料与方法
1.1 材料
A549 和 HCT8 细胞购自中国医学科学院基础医学研究所细胞中心;X-VIVO 培养基购自瑞士 Lonza 公司;二氧化碳培养箱、离心机与AIM V CTS 无血清淋巴细胞培养基(RUO)均购自美国 Thermo Fisher Scientific 公司;胎牛血清购自美国 Gibco 公司;淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;APC anti-human CD56、FITC anti-human CD3、PE anti-human CD16、PE-anti-human CD337(NKp30)、PE-anti-human CD336(NKp44)、PE anti-human CD314(NKG2D)单克隆抗体购自美国 Biolegend 公司;IL-2 购自美国 PeproTech 公司;E-Plate 16 PET 和实时无标记细胞功能分析仪购自美国 Agilent 公司;倒置荧光显微镜购自日本 Olympus 公司;流式细胞仪购自美国 BD 公司。
1.2 方法
1.2.1 细胞培养
⑴A549 和 HCT8 细胞:用含有 10% 胎牛血清(FBS)的 RPMI-1640 培养基培养传代,每2 ~ 3 天换液一次。
⑵脐血单个核细胞分离:在产妇知情同意情况下,采集足月妊娠产妇经产道或剖宫产分娩的胎儿脐静脉血(伦理审批件号:CGYJ-BD-080-V2),经 3000 r/min 离心 10 min,取上层血浆放入水浴锅中 56 ℃加热 30 min 以灭活补体,将灭活后的血浆经 3000 r/min 离心 10 min,保留上层血浆备用。使用生理盐水对下层血细胞进行等体积稀释,使用 1 体积淋巴分离液对 2 体积血细胞进行分离以获得脐血单个核细胞,之后使用生理盐水清洗 2 次。
⑶ NK 细胞体外扩增:在无血清淋巴细胞培养基(RUO)中加入 10% 自体血浆、2000 IU/ml 重组人 IL-2、25 ng/ml 重组人IL-15 和 NK 细胞活化因子(实验室自研,成分主要涉及小分子抑制剂和蛋白类活性因子)配置成完全培养基 1。使用完全培养基 1 接种细胞,数量为(1 ~ 3)× 106个/ml。细胞置于 37 ℃、5% CO2饱和湿度环境中培养 4 d 后离心弃去上层培养基。用包含 2000 IU/ml 重组人 IL-2 的 X-VIVO 完全培养基 2 重悬细胞,调整细胞数量为 1 × 106个/ml 后置于细胞培养箱中继续培养,依据细胞生长情况补充新鲜 X-VIVO 完全培养基 2。当细胞培养至 14 d 左右,收获细胞进行表型鉴定并进行后续实验。
1.2.2 流式细胞术检测 取 1 × 106个 NK 细胞进行表型检测,1500 r/min 离心 3 min。弃去离心管内上层培养液后使用 5 ml PBS 重悬下层细胞,再次进行离心后弃去上层 PBS 液。使用 300 μl PBS 重悬细胞,对照管和试验管每管加入 50 μl 细胞悬液,试验管加入 CD56-APC、CD3-FITC、CD16-PE、NKG2D-PE、NKp44-PE 和 NKp30-PE 单克隆抗体,避光孵育 15 min 后每管使用 1 ml PBS 离心洗去未结合的抗体,150 μl PBS 重悬细胞,上机进行 NK 细胞表型分析。
1.2.3 实时无标记动态细胞分析技术检测 NK 细胞对肿瘤细胞的杀伤作用 将状态良好的肿瘤细胞在实验前一天进行铺板,以处在对数生长期为宜。离心消化细胞,使用完全培养基调整肿瘤细胞数量至 1 × 104个/孔接种于 E-Plate 16 板中,置于实时无标记动态细胞分析(RTCA)仪实时动态监测细胞增殖曲线。
第二天配制合适的 NK 细胞浓度,取出 E-Plate 16 板,按相同体积加入不同效靶比 NK 细胞,对照组加入等体积培养基,使用 RTCA技术进行实时监测,观察 NK 细胞对肿瘤细胞的杀伤作用。
1.3 统计学处理
使用 SPSS20.0 软件进行单因素方差分析,< 0.05 为差异具有统计学意义。
2 结果
2.1 NK 细胞培养及表型鉴定
对脐带血提取出的单个核细胞进行培养。培养前 4 天细胞增殖较慢,细胞由分散的单个细胞逐渐生长成为包含数个细胞的细胞团。细胞培养至第 7 天后开始进入大量扩增时期。培养至第 14 天,每 20 ml 脐血,细胞总数从 2.03 × 107个扩增至 5.98 × 109个,扩增 294 倍;NK 细胞从1.05 × 106个扩增至 5.86 × 109个,扩增 5580 倍(图 1)。表型为 CD3-CD56+的 NK 细胞由培养前的 5.18% 增加到培养后的 97.93%(图 2)。
该结果表明,单个核细胞已基本诱导成 NK 细胞。扩增后 NK 细胞表面活化性受体 CD16、NKp44、NKp30 和 NKG2D 的表达均大于 95%,表明扩增后 NK 细胞具有较好的活化程度(图 3)。

图 1 NK 细胞培养扩增情况(A)与显微镜下形态(200 ×)(B)
Figure 1 Amplification (A) and microscopic morphology (B) of NK cells (200 ×)
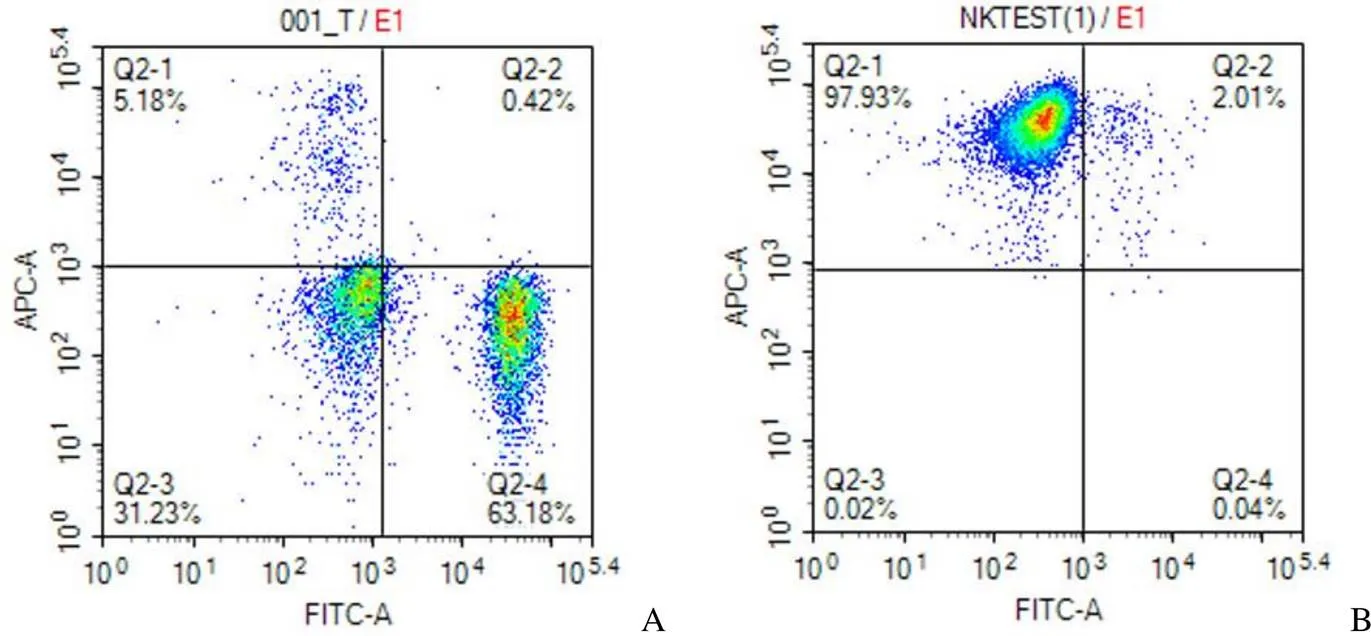
图 2 培养前(A)和培养 14 天后(B)流式细胞术检测 NK 细胞纯度
Figure 2 The purity of NK cells was detected by flow cytometry before (A) and 14 days after culture (B)

图 3 NK 细胞表达 CD16(A)和 NKG2D(B)、NKp30(C)、NKp44(D)等活化性受体情况
Figure 3 Expression of CD16 (A), NKG2D (B), NKp30 (C) and NKp44 (D) activated receptors in NK cells
2.2 NK 细胞对肿瘤细胞的杀伤活性
以培养 14 d 的 NK 细胞为效应细胞,肺癌细胞株 A549 和结肠癌细胞株 HCT8 为靶细胞,验证 NK 细胞对实体肿瘤细胞的杀伤活性。以 A549 细胞为靶细胞时,随着作用时间的延长和效靶比的提高,杀伤作用逐渐增强。以作用 6 h 的杀伤活性为例,在 1:1 ~ 10:1 效靶比范围内,随着效靶比增加,NK 对肿瘤细胞杀伤活性从(78.16 ± 2.41)%逐渐增强到(95.71 ± 3.21)%;并且在效靶比 1:1 的情况下,随着作用时间从 6 h 延长到 24 h,杀伤活性也从(78.16 ± 2.41)% 逐渐增强到(96.33 ± 2.15)%,说明 NK 细胞对 A549 的杀伤活性具有时间和剂量依赖性(图 4)。以 HCT8 细胞为靶细胞时,杀伤活性随效靶比的提高,增强效果虽然不明显,但即使在 1:1 效靶比的情况,NK 细胞对 HCT8 细胞的杀伤作用已非常显著(图 5),说明与 A549 相比,NK 细胞对 HCT8 细胞的杀伤活性更强,因此可在更低效靶比的条件下,进一步考察 NK 细胞对 HCT8 的杀伤活性。

图 4 NK 细胞对肺癌细胞株 A549 杀伤作用(与效靶比1:1 组相比,*P < 0.05;与作用6 h 组相比,#P < 0.05)
Figure 4 Killing effect of NK cells on lung cancer cell line A549 (Compared with the effect-target ratio 1:1 group,*< 0.05;Compared with the 6 h group,#< 0.05)

图 5 NK 细胞对结肠癌细胞株 HCT8 杀伤作用
Figure 5 Killing effect of NK cells on colon cancer cell line HCT8
3 讨论
近些年,肿瘤的免疫治疗成为继常规手术、放化疗之后的新兴治疗方法。细胞治疗作为免疫治疗的重要组成部分,其原理为依据人体的非特异性免疫作用,启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应。细胞治疗通过给患者回输体外扩增的具有高活性的免疫细胞[3-4],增加免疫系统对肿瘤细胞的清除能力。
作为人体抗肿瘤的主力军,NK 细胞能够通过多种途径发挥作用,包括颗粒酶与穿孔素途径、细胞因子途径、Fas/FasL 途径、ADCC 途径等。同时,NK 细胞还能够通过分泌某些细胞因子来促进调节性 T 细胞凋亡、招募树突状细胞增强肿瘤细胞周围的免疫细胞浸润等方式调节免疫功能[5-6]。
基于回输 NK 细胞的免疫治疗要求,NK 细胞的数量应充足、活性应稳定。因此,通过特定培养方式获得大量且稳定的 NK 细胞是开展临床试验的前提。现阶段开展免疫细胞回输治疗成本较高,通过不断优化现有细胞制备工艺,探索新的细胞制备工艺,尽可能降低生产成本依然十分重要。目前,关于 NK 细胞培养主要有以下两种方式:一是使用辐照后基因工程改造过的细胞(一般为肿瘤细胞系)作为饲养层细胞与 NK 细胞进行共培养,在饲养细胞的作用下可使 NK 细胞增殖至数万倍,纯度在 90% 左右。但饲养细胞的存在会增加细胞产品的使用风险[7-9];二是首先通过流式细胞仪或者磁珠分选仪分选富集造血干细胞,在 NK 细胞的培养过程中加入 SCF、TPO、IL-7、Flt3L、IL-2 和 IL-15 等细胞因子刺激造血干细胞的分化以及 NK 细胞的大量增殖[10-13]。目前 NK 细胞扩增体系正在朝着无需预先分选、无需饲养层细胞、无需血清的方向发展[14]。
国外有研究通过使用磁珠分选技术在脐带血中分离出以 CD34+为主的造血干细胞,经过 40 d 左右培养后,细胞扩增超过 2000 倍,所得到的 NK 细胞纯度能够达到 90% 以上[15]。也有研究建立了以胚胎干细胞为起点的 NK 细胞培养体系,经过 30 d 左右的培养得到纯度超过 90% 的 NK 细胞[16-17]。使用商品化试剂盒培养 50 ml 脐血中提取出的单个核细胞,在 14 d 左右单个核细胞扩增 213 倍,表型为 CD3-CD56+的 NK 细胞占比为 76.4%[18]。本研究通过使用实验室自研的 NK 细胞活化因子,体外培养单个核细胞 14 d 即可获得纯度高达 98%,扩增倍数超过 5000 倍的 NK 细胞,且 NK 细胞表面多种激活性受体表达量均在 95% 以上,表明该培养方法优于已有文献报道方法。在体外实验中,也验证了扩增的 NK 细胞对某些实体瘤细胞具有较强的杀伤活性。
本实验成功探索出一种可在体外大规模培养 NK 细胞的方法,无需滋养层细胞,无需分选,直接诱导脐血单个核细胞成高纯度的 NK 细胞,并且培养出来的 NK 细胞高度活化,对肺癌细胞和结肠癌细胞均具有显著的杀伤活性,杀伤作用随效靶比和作用时间的增加而增强。本研究为脐血源 NK 细胞的临床研究和应用奠定了实验基础。
[1] van Erp EA, van Kampen MR, van Kasteren PB, et al. Viral infection of human natural killer cells. Viruses, 2019, 11(3):243.
[2] Fang F, Xiao WH, Tian ZG. Development of NK cell-based tumor immunotherapy. Chin J Immunol, 2019, 35(9):1025-1030. (in Chinese)
方芳, 肖卫华, 田志刚. NK细胞肿瘤免疫治疗的研究进展. 中国免疫学杂志, 2019, 35(9):1025-1030.
[3] Wang Y, Wang W, Shen C, et al. NKG2D modulates aggravation of liver inflammation by activating NK cells in HBV infection. Sci Rep, 2017, 7(1):88.
[4] Messaoudene M, Frazao A, Gavlovsky PJ, et al. Patient’s natural killer cells in the era of targeted therapies: role for tumor killers. Front Immunol, 2017, 8:683.
[5] Overacre-Delgoffe AE, Chikina M, Dadey RE, et al. Interferon-γ drives Treg fragility to promote anti-tumor immunity. Cell, 2017, 169(6):1130-1141.
[6] Böttcher JP, Bonavita E, Chakravarty P, et al. NK cells stimulate recruitment of cDC1 into the tumor microenvironment promoting cancer immune control. Cell, 2018, 172(5):1022-1037, e14.
[7] Phan MT, Lee SH, Kim SK, et al. Expansion of NK cells using genetically engineered k562feeder cells. Methods Mol Biol, 2016, 1441:167-174.
[8] Cheng HY, Ye X, Ma RQ, et al. Experiment research of natural killer cells amplification in vitro and the killing effect on ovarian cancercells. Chin J Obstet Gynecol, 2017, 52(8):545-550. (in Chinese)
程洪艳, 叶雪, 马瑞琼, 等. 自然杀伤细胞的体外扩增及对卵巢上皮性癌细胞杀伤作用的实验研究. 中华妇产科杂志, 2017, 52(8): 545-550.
[9] Lapteva N, Durett AG, Sun J, et al. Large-scale ex vivo expansion and characterization of natural killer cells for clinical applications. Cytotherapy, 2012, 14(9):1131-1143.
[10] Luhm J, Brand JM, Koritke P, et al. Large-scale generation of natural killer lymphocytes for clinical application. J Hematother Stem Cell Res, 2002, 11(4):651-657.
[11] Childs RW, Berg M. Bringing natural killer cells to the clinic: ex vivo manipulation. Hematology Am Soc Hematol Educ Program, 2013, 2013(1):234-246.
[12] Granzin M, Wagner J, Köhl U, et al. Shaping of naturalkiller cell antitumor activity by ex vivo cultivation. Front Immunol, 2017, 8:458.
[13] Wagner J, Pfannenstiel V, Waldmann A, et al. A two-phase expansion protocol combining interleukin (IL)-15and IL-21improves natural killer cell proliferation and cytotoxicity against rhabdomyosarcoma. Front Immunol, 2017, 8:676.
[14] Lupo KB, Moon JI, Chambers AM, et al. Differentiation of natural killer cells from induced pluripotent stem cells under defined, serum- and feeder-free conditions. Cytotherapy, 2021, 23(10):939-952.
[15] Pittari G, Filippini P, Gentilcore G, et al. Revving up natural killer cells and cytokine-induced killer cells against hematological malignancies. Front Immunol, 2015, 6:230.
[16] Knorr DA, Ni Z, Hermanson D, et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med, 2013, 2(4):274-283.
[17] Hermanson DL, Bendzick L, Pribyl L, et al. Induced pluripotent stem cell-derived natural killer cells for treatment of ovarian cancer. Stem Cells, 2016, 34(1):93-101.
[18] Zuo FQ, Cheng W, Deng AY, et al. Statistical analysis on quality of large-scale culture of blood NK cells from different sources. Med J West China, 2020, 32(8):1238-1240, cover 3. (in Chinese)
左凤琼, 程威, 邓安彦, 等. 不同来源血液NK细胞大体系培养质量统计分析. 西部医学, 2020, 32(8):1238-1240,封3.
Efficient expansion of NK cells derived from cord bloodand their killing activity of tumor cells
HAN Qiang, ZHANG Zhi-gang, LIU Kun, ZHU Xian-dui, JIN Yuan-yuan, ZHANG Zhi-fei, YANG Zhao-yong
Author Affiliations: School of Pharmacy, North China University of Science and Technology, Tangshan 063210, China (HAN Qiang, LIU Kun, ZHU Xian-dui, ZHANG Zhi-fei); Department of Pathology, Cangzhou People's Hospital, Hebei 061000, China(ZHANG Zhi-gang); Department of Microbial Pathway Engineering, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (JIN Yuan-yuan, YANG Zhao-yong)
To study the culture method of NK cells derived from cord blood mononuclear cells and their killing activity of different types of tumor cells.After disinfection of umbilical vein, umbilical cord blood was collected completely and anticoagulated with heparin, then the umbilical cord blood mononuclear cells were isolated and cultured in NK cell culture medium for 14 days. Their surface markers were detected by flow cytometry. The cell proliferation curve and the killing effects of NK effector cells on tumor cells were examined according to the effective target ratio of 1:1, 5:1 and 10:1 by RTCA real-time unlabeled cell analysis technology.Cord blood mononuclear cells cultured for 14 days expanded 294 times in total, including 5580 times in NK cells. The positive rate of CD3-CD56+cell subsets of NK cells cultured for 14 days was 97.93%, and the positive rate of CD16, NKG2D, NKp30 and NKp44 importantly for killing function were more than 95%. When the NK-killing activity of A549 lung cancer cell line for 6 h was in the range of 1:1 - 10:1 of effector: target ratio, the killing activity gradually increased from (78.16 ± 2.41)% to (95.71 ± 3.21)% with the increase of the ratio; The killing activity increased from (78.16 ± 2.41)% to (96.33 ± 2.15)% with the extension of action time from 6 h to 24 h when the effective target ratio was 1:1.This method does not need cell sorting and trophoblast cells. It has the advantages of simple operation, strong universality, high purity of cultured umbilical cord blood NK cells and strong lethality to tumor cells.
natural killer cell; cord blood; surface marking; real time cellular analysis; in vitro amplification; anti-tumor
JIN Yuan-yuan, Email: jinyuanyuan@imb.pumc.edu.cn; ZHANG Zhi-fei, Email: zhangzhifeifei7208@ 163.com
10.3969/j.issn.1673-713X.2022.05.004
河北省自然科学基金(B2020209001);国家自然科学基金面上项目(81872782)
金媛媛,Email:jinyuanyuan@imb.pumc.edu.cn;张志斐,Email:zhangzhifeifei7208@163.com
2022-02-07
*同为第一作者

