酶解苹果渣中多糖的结构分析及其体外抗氧化活性
常相娜, 陈雪峰, 苏 瑶
(陕西科技大学 食品科学与工程学院, 陕西 西安 710021)
0 引言
我国是苹果生产大国,苹果汁出口量巨大[1],每年产生数百万吨苹果汁加工副产品--苹果渣(Apple pomace,AP)[2].尽管AP富含黄酮、多酚、多糖等活性成分[3],但局限于利用方法有限,大多数AP依然作为废物丢弃,未得到充分有效利用,造成资源浪费与环境污染[4].因此,探讨高附加值利用AP及其活性成分有着显著的社会价值和潜在的经济效益.多糖在植物中广泛的存在,发挥支撑组织或储存营养的功能.近年来,由于植物多糖具有多种生物活性,如抗氧化[5,6]、抗炎[7,8]、抗癌[9]及免疫调节[9]等作用,且具有安全无毒的特性[10],故受到越来越多的关注,已逐步开发应用在医药、保健食品等行业.正因如此,作为AP中主要活性成分之一的苹果渣多糖(Polysaccharide from apple pomace,PAP)受到了研究人员的关注.Sun等[11]先将AP预压处理后,分离获得的PAP进行研究,表明PAP具有良好的抗氧化活性;Li等[12]研究证实PAP至少部分通过调节肠道菌群失调和Wnt通路阻止了ICR小鼠发生结肠炎相关的大肠癌;Chen等[13]研究发现PAP可以成功地改善与肥胖相关的肝代谢紊乱;Wang等[14]研究表明PAP可显著缓解与营养不良相关的肠道通透性和慢性炎症.上述研究表明PAP具有抗氧化、抗肿瘤、改善肝功能及营养不良等多种生物活性.
酶解法提取多糖具有条件温和、杂质易于去除、产率高等优点[15],是提取果渣多糖的常用方法之一.已有研究表明不同的提取方法对多糖收率、结构与活性都会产生影响[16,17],而关于酶解苹果渣中的多糖与非酶解苹果渣多糖在结构与活性上的差异尚未见相关报道.本文采用实验室前期研究获得的复合酶酶解苹果渣优化工艺,进行苹果渣多糖提取,所得酶解苹果渣多糖(Polysaccharides from enzymatic Apple Pomace,PEAP)对比非酶解处理PAP,分析理化特性及结构变化、评价抗氧化活性,探讨结构与抗氧化活性之间的关系.
1 材料与方法
1.1 材料与试剂
苹果渣(40目),陕西省海升果业发展股份有限公司;葡萄糖、果糖、阿拉伯糖、岩藻糖、半乳糖、甘露糖、核糖、木糖、葡萄糖醛酸、甘露糖醛酸,上述单糖标准品购于西格玛奥德里奇公司;氢氧化钠(色谱纯)、醋酸钠(色谱纯)购于于西格玛奥德里奇公司;三氟乙酸(色谱纯)、甲醇(色谱纯)购于德国CNW科技公司;牛血清蛋白(标准品)购于上海阿拉丁生化科技股份有限公司;其他均为国产分析纯试剂.
1.2 仪器与设备
ICS5000离子色谱,Thermo Fisher Scientific有限公司;ELEOS System凝胶色谱仪,Wyatt有限公司; VECTOR-22傅里叶红外光谱分析仪,德国Bruker公司;SPI3800N原子力显微镜,日本精工仪器公司;FD-ID-50冷冻干燥器,上海比朗仪器制造有限公司;Varioskan flash多功能酶标仪,美国赛默飞世尔科技有限公司;CT15RT台式冷冻离心机,青岛科易仪器有限公司.
1.3 实验方法
1.3.1 酶解苹果渣多糖的制备
工艺流程:苹果渣→预处理→酶解→灭酶→过滤→浓缩→除蛋白→醇沉→抽滤→干燥→样品
操作要点:将4倍体积的蒸馏水加入除杂粉碎后AP中,常温下搅拌30 min,过滤后所得滤渣用温水冲洗两遍,60 ℃干燥后过40目筛.称预处理后原料AP 10.0 g,按料液比1∶20(g/mL)加入pH值为5.1的缓冲盐溶液,添加复合酶(纤维素酶20 U/g;果胶酶80 U/g),置于44 ℃下,经2 h溶胀后于转速为100 r/min的恒温振荡水浴中5.5 h,然后样品通过90 ℃水浴进行10 min灭酶.然后过滤取上清液,将其浓缩至原体积的1/2,经反复冻融三次除蛋白后,缓缓加入4倍体积的95%乙醇,搅匀,4 ℃静置24 h进行醇沉.离心得沉淀,用适量水溶解后透析48 h,后冻干得PEAP.同时设有不加酶、其他操作一致的对照实验组,得PAP.收率由公式(1)计算:

(1)
1.3.2 总多糖含量和总蛋白含量测定
总多糖含量采用苯酚-硫酸法测定;总蛋白含量采用考马斯亮蓝法测定.
1.3.3 傅里叶-红外(FT-IR)光谱分析
称取多糖样品1 mg,按1∶150的比例将多糖样品与溴化钾共研混匀后压制成片,扫描波长在4 000 cm-1~400 cm-1区间范围内的红外谱图.
1.3.4 分子量测定
采用凝胶色谱分析多糖样品的分子量分布.将PAP与PEAP制成1 mg/mL样品,过0.22 μm水膜,待测.色谱条件如下:色谱柱:串联Shodex-OHpak SB-806HQ和SB-803HQ(300×8 mm,6 μm);流动相:200 mg/L NaN3水溶液;流速:1 mL/min;柱温:40 ℃;进样量:500 μL.
1.3.5 单糖组成分析
精确称量多糖样品5 mg(±0.05 mg)置于色谱瓶中,加入配置好的三氟乙酸溶液,121 ℃加热2 h.通氮气,吹干.加入甲醇清洗,再吹干,重复甲醇清洗2~3次.加入无菌水溶解,转入色谱瓶待测.采用高效阴离子交换色谱分析PAP与PEAP的单糖组成.色谱条件如下:色谱柱为DionexTMCarboPacTMPA200 (Thermo Fisher Scientific);检测器:电化学检测器/脉冲安培检测器;流动相:A相为超纯H2O、B相为100 mM NaOH、C相为100 mM NaOH/200 mM NaAC;流速:0.5 mL/min;进样量:5 μL.
1.3.6 原子力显微镜(AFM)观察
将待测样品溶解在去离子水中配制成10 μg/mL溶液,并在室温下轻轻搅拌4 h.将测试样品滴在云母载体表面,室温常压下干燥.采用原子力显微镜仪器在常温常压下、标准氮化硅针尖接触模式拍摄AFM图像.
1.3.7 体外抗氧化活性
(1)羟基自由基(·OH)清除活性
采用改进的Fenton反应评价PAP与PEAP的·OH清除率[18],准确吸取不同浓度样品溶液1.0 mL、4.5 mmol/L FeSO4 1 mL、4.5 mmol/L 水杨酸-乙醇1 mL,混匀后加4.4 mmol/L H2O21 mL启动Fenton反应,以维生素C(vitamin C,Vc)为对照,37 ℃水浴30 min 后8 000 r/min 离心3 min,于510 nm下测定吸光度.·OH清除率由公式(2)计算:

(2)
式(2)中:As为样品吸光值,As0为样品本底吸光值,A0为空白对照吸光值.
(2)超氧阴离子(O2-·)清除能力
以Vc为对照,通过邻苯三酚自氧化法测定O2-·清除能力.准确吸取pH 7.3、0.1 mol/L Tris-HCl 缓冲液2.0 mL,0.1 mL不同浓度PAP与PEAP样品(对照为0.1 mL蒸馏水),上述溶液混匀,25 ℃水浴20 min,立即加入预热的25 ℃ 60 mmol/L邻苯三酚 0.1 mL(采用10 mmol/L HCl 配制,空白对照为10 mmol/L HCl),快速摇匀,319 nm下每隔30 s测定吸光度,计算线性范围内每分钟吸光度的增加值,然后计算清除率.O2-·清除率由公式 (3)计算:

(3)
式(3)中:ΔA0为邻苯三酚自氧化速率,ΔA为加入样品后邻苯三酚的自氧化速率.
(3)1,1-二苯基-2-三硝基苯肼(DPPH·)清除活性
DPPH·是一种稳定的自由基化合物,在517 nm处具有最大吸收.它广泛用于测定抗氧化剂清除自由基的能力.参照Zhao等[19]方法并加以改进.准确吸取不同浓度PAP与PEAP样品溶液1.0 mL,加入0.03 mg/mL DPPH 溶液4.5 mL,摇匀,37 ℃水浴30 min后,在517 nm 下测定吸光值.以Vc为对照.DPPH·清除率由公式(4)计算:

(4)
式(4)中:As为样品吸光值,As0为样品本底吸光值,A0为空白对照吸光值.
(4)ABTS+·自由基清除能力
取配制ABTS+·工作液,使其在734 nm下测定的吸光值保持在0.7±0.02.取80 μL不同浓度的PAP与PEAP溶液和4 mL ABTS+·工作液,震荡混匀,在30 ℃水浴中反应15 min,在734 nm下测吸光值As.以Vc为阳性对照[20].ABTS+清除率由公式(5)计算:

(5)
式(5)中:As为样品吸光值,As0为样品本底吸光值,A0为空白对照吸光值.
1.4 数据统计分析
样品均平行测定3次,结果采用平均值±标准差表示,使用SPSS22.0软件进行独立样本t检验对数据进行统计分析.p<0.05为有显著性差异,p<0.01为有极显著性差异.
2 结果与讨论
2.1 苹果渣多糖制备及含量分析
多糖的收率及含量组成结果如表1所示.PEAP的收率为16.17%,显著高于PAP的收率(p<0.01).这是因为在复合酶中纤维素酶作用于细胞壁上的主要成分纤维素,使果渣结构组织变得较疏松,亲水性相对好些的果胶能够更充分的与复合酶中果胶酶接触并溶出,所以经复合酶酶解后AP的多糖收率显著提高.已有研究表明,复合酶处理后的刺梨果渣[15]和红枣渣[21]中多糖的提取率同样都有明显提升.PEAP中总多糖含量为70.90%较PAP高4.47%,而两者的总蛋白含量接近,PEAP为4.05%、PAP为3.90%,没有显著性差异.

表1 多糖收率及含量组成分析
2.2 FT-IR光谱分析
PAP与PEAP的红外特征吸收光谱如图1所示.PAP的光谱吸收带与PEAP基本一致.这与单糖分析一致的结果吻合.红外谱图的差异主要体现在官能团的透射强度上,产生原因为不同单糖类型含量不同.最为典型的是在1 600 cm-1处的峰是酯羰基(COOR)和羧酸根离子拉伸振动带(COO-)[22],反应的是多糖中的糖醛酸的含量,PEAP的透射率远高于PAP的透射率,说明PEAP中糖醛酸含量高于PAP中的糖醛酸含量.这点与单糖分析结果一致.PEAP与PAP红外光谱峰的具体归属如下:在3 600~3 200 cm-1波数范围内的宽峰是O-H的拉伸振动,红外光谱中约3 442.78 cm-1(PAP)和3 440.85 cm-1(PEAP)的谱带强度是由于多糖的羟基伸缩振动所致,而且它们的谱带范围很宽[23].2 941.31 cm-1(PAP)和2 939.38 cm-1(PEAP)是由C-H拉伸振动引起的[24].1 600 cm-1处的峰是酯羰基(COOR)和羧酸根离子拉伸振动带(COO-).波数范围1 419~1 200 cm-1的峰是由C-H的弯曲振动引起的,1 150 cm-1、1 100 cm-1和1 020 cm-1的峰是半乳糖醛酸在多糖中的主要吸收区[25].PAP和PEAP分别在1143.74 cm-1、1 097.45 cm-1和1 020.3 cm-1和1 145.67 cm-1、1 101.3 cm-1和1 018.37 cm-1处出现强峰,表明PAP和PEAP富含醛酸.上述分析进一步证实PAP和PEAP是富含糖醛酸的酸性多糖,这与单糖数据一致.
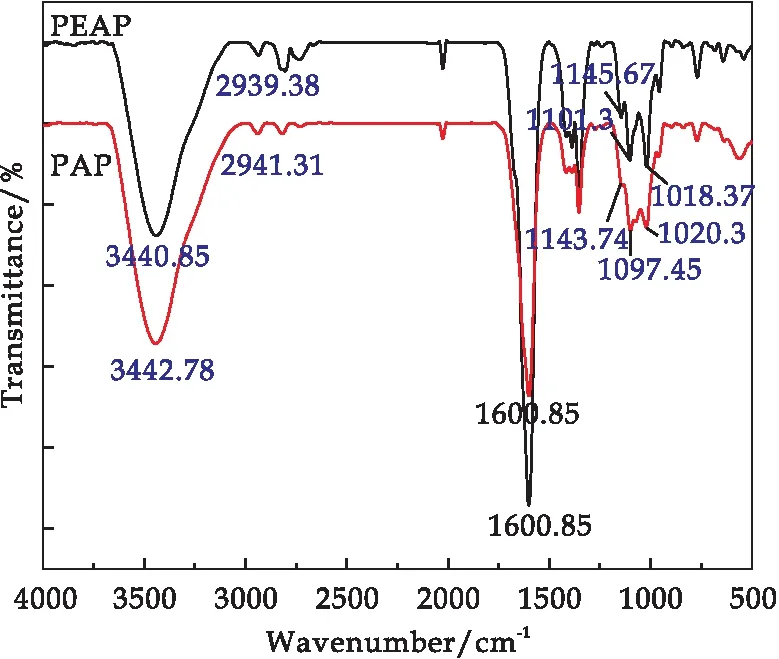
图1 PAP与PEAP的FT-IR图谱
2.3 分子量分布
PAP与PEAP分子量分布如表2所示.PAP的主Mw大于50 kda,其中200≥Mw≥50 kDa占PAP的93.9%,而PEAP的主Mw处于50≥Mw≥4 kDa区间,占EAPP的92.1%.研究表明,PAP的分子量大于PEAP的分子量,这归因于纤维素酶与果胶酶复合酶解的作用.现有研究表明多糖分子量与其生物活性密切相关[26].分子量过大,分子的体积也大,阻碍其进入生物体发挥活性,并且与分子量相关的特性黏度、溶解性及多糖分子的高级结构的变化都可能影响多糖生物活性;但多糖分子过小时,则可能无法形成有活性的空间结构造成活性降低甚至消失.本研究中PAP与PEAP的分子量有着明显的变化,可预见两者在活性方面表现会不尽相同.

表2 PAP与PEAP的分子量分布
2.4 单糖组成及含量
PAP与PEAP中单糖的保留时间与组成含量如表3所示.其中PEAP主体单糖组成类型与文献报道一致[13];但两者在具体的单糖含量存在差异,推断是提取方法不同带来的[27],如岩藻糖(PAP 3.61%,PEAP 0.71%)、鼠李糖(PAP 18.47%,PEAP 7.07%);含量差异最大的为半乳糖醛酸,PEAP的半乳糖醛酸含量为43.50%,较PAP的含量高出20.01%,分析其原因可能与果胶酶降解果胶导致果胶中有更多的半乳糖醛酸结构暴露出来,最终提升了PEAP的半乳糖醛酸含量.现有研究证实单糖的类型或含量对多糖的活性产生影响[28],特别是糖醛酸结构,因其能改变多糖的性质和溶解度,故一些富含糖醛酸的多糖表现出较高的活性.PAP与PEAP中糖醛酸含量的显著差异决定有必要对两者产生的活性进行比较研究.
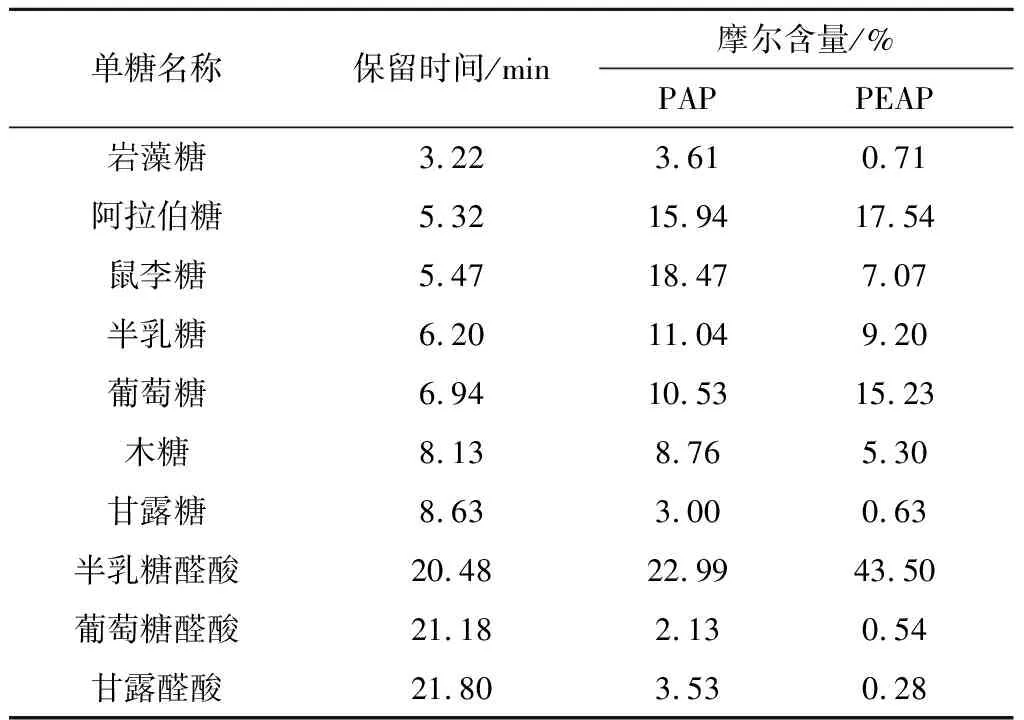
表3 PAP与PEAP的单糖保留时间与组成
2.5 AFM观察结果
PAP与PEAP的平面与立体AMF图像如图2所示.两种果渣多糖AMF立体图形貌都是凹凸不平、不均一,似山峰形状的不规则的突起,对应到平面图像中则为球状、不均一的团块,表明PAP与PEAP分子具有分支结构,在10 μg/mL浓度下,这些支链型结构紧密地缠绕在一起形成聚集,从而形成图象中的形貌[29,30].分子聚集可归因于多糖侧链上的羟基可以相互或与水分子形成强大的分子间和分子内相互作用[31,32].对比PAP与PEAP的平面与立体AMF图像,PEAP的图像中有更多的团块和不规则突起,说明PEAP较PAP具有更多的支链性结构.
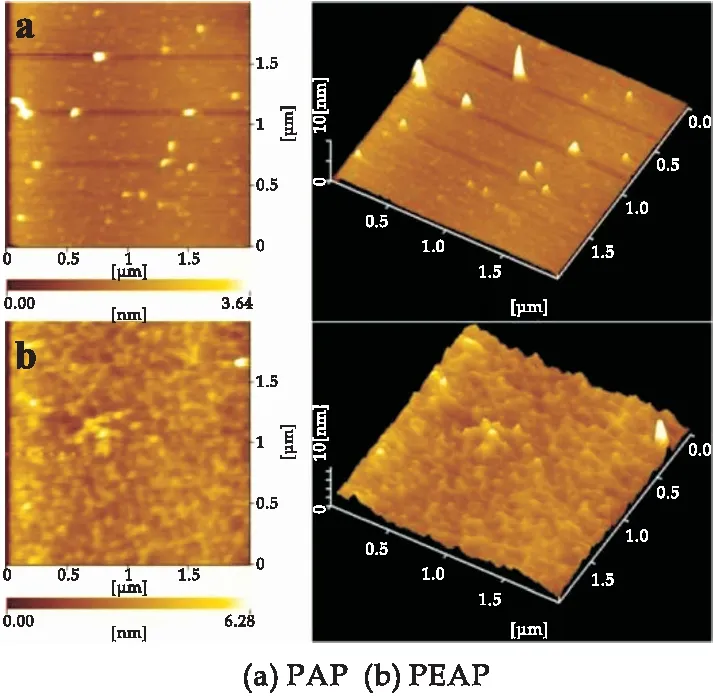
图2 PAP与PEAP的平面与立体原子力显微镜图
2.6 体外抗氧化活性
PAP与PEAP对·OH 、O2-·、DPPH·与ABTS+·自由基清除活性结果如图3所示.多糖对上述四类自由基的清除活性均呈现出浓度依赖性,均表现出与浓度变化正相关.对比2.0 mg/mL浓度下,PAP与PEAP对不同类型自由基的清除率,·OH清除率(如图3(a)所示):PAP为22.78%,PEAP为33.98%,是前者的1.49倍;O2-·清除率(如图3(b)所示):PAP为23.07%,PEAP为34.16%,是前者的1.48倍;DPPH·清除率(如图3(c)所示):PAP为34.49%,PEAP为53.99%,是前者的1.57倍;ABTS+清除率(如图3(d)所示):PAP为23.35%,PEAP为30.68%,是前者的1.31倍.

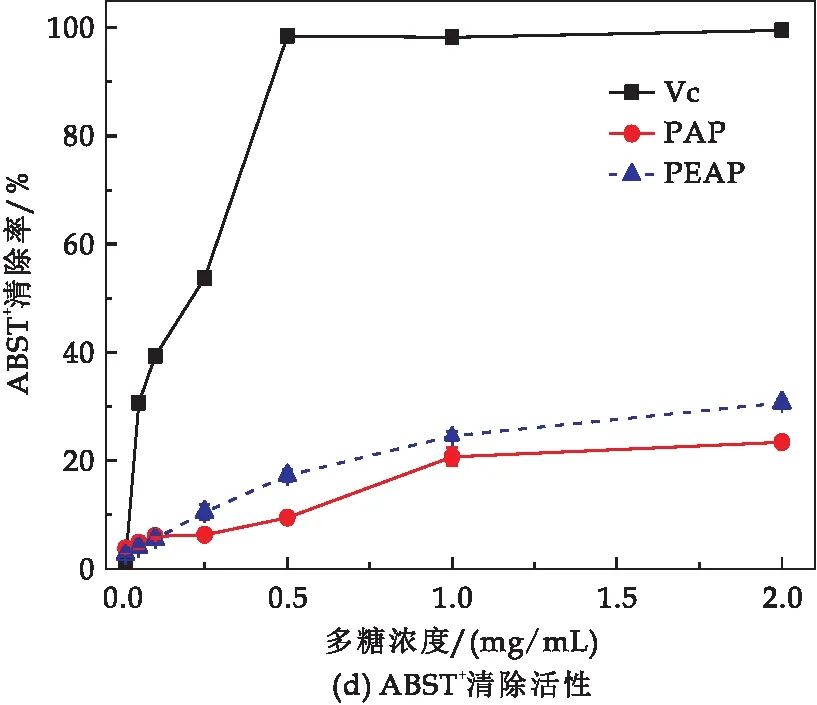
图3 PAP与PEAP体外抗氧化性活性比较
由此可知,总体上PEAP相较于PAP具有更强的体外抗氧化活性.已有研究表明,多糖中单糖类型及含量影响多糖的生物活性[28],如醛酸含量被认为与抗氧化活性相关[33].在本研究中,PAP的含量为22.99%,PEAP的半乳糖醛酸含量为43.50%,PEAP的半乳糖醛酸含量高出APP含量20.01%,PEAP相较于PAP具有更强的体外抗氧化活性,呈现出抗氧化活性与糖醛酸含量正相关,与Su等[34]的研究结果一致.同时,酶解作用使得PEAP比PAP分子量降低、支链结构增多,故PEAP结构中还原末端数量增多,且增加侧链基团,也增加一定的亲水基,有助于活性提高.因此,PEAP相较于PAP表现出更好的体外抗氧化活性,Qi等[35]与Liu等[36]也报道过同类的研究结果.
3 结论
本文探讨了酶解处理对苹果渣中多糖的影响,对比研究PEAP与PAP,分析二者的理化特性,对比酶解前后的结构变化,评价其抗氧化活性,并探讨了结构与抗氧化活性的关系.研究表明PAP与PEAP是酸性多糖,单糖组成类型一致,但具体的单糖组成含量存在差异,这其中,含量差异最大的为半乳糖醛酸,PEAP的半乳糖醛酸含量高出APP含量20.01%;PAP的分子量高于PEAP的分子量;APP与PEAP的红外光谱吸收带基本一致,这与单糖分析一致的结果吻合.通过评价APP与PEAP对·OH 、O2-·、DPPH·与ABTS+自由基清除活性,其结果表明PAP与PEAP的体外抗氧化活性均呈现出浓度依赖性,总体上PEAP相较于PAP具有更强的体外抗氧化活性,结合现有研究,推断这可归因于PAP与PEAP组成多糖的糖醛酸含量、分子量大小和分支结构的差异,具体影响规律有待于进一步研究.本研究说明不同提取方法会影响苹果渣中多糖的结构与活性,为苹果渣及其活性多糖成分的提取及深入开发利用提供了理论依据.

