健脾养血解毒方抑制咪喹莫特诱导的银屑病样皮损模型的炎症细胞浸润*
赵宁, 底婷婷, 王燕, 冯放, 齐聪, 胡雪晴, 王亚卓,朱昊玥, 杨丹阳, 张暇蔚, 李萍
健脾养血解毒方抑制咪喹莫特诱导的银屑病样皮损模型的炎症细胞浸润*
赵宁, 底婷婷, 王燕, 冯放, 齐聪, 胡雪晴, 王亚卓,朱昊玥, 杨丹阳, 张暇蔚, 李萍△
(首都医科大学附属北京中医医院,北京市中医药研究所,银屑病中医临床基础研究北京市重点实验室,北京 100010)
观察健脾养血解毒方对咪喹莫特(IMQ)诱导的银屑病样小鼠皮损模型的作用,并探讨其机制。将BALB/c小鼠随机分为正常对照组、模型组、甲氨蝶呤组及高、中、低剂量健脾养血解毒方组,采用背部涂抹IMQ的方法诱导小鼠银屑病样皮损模型。期间对皮损拍照并进行皮损严重程度指数(PASI)评分;HE染色观察皮肤病理学改变;免疫荧光染色法检测表皮Ki67的表达及Ly-6G+中性粒细胞的浸润;免疫组化法检测CD3+T淋巴细胞、CD11b+骨髓单核细胞和Ly-6C+巨噬细胞的浸润;Western blot法检测MAPK家族蛋白(p38 MAPK、ERK1/2、p-p38 MAPK和p-ERK1/2)的水平。与模型组相比,健脾养血解毒方可减轻IMQ诱导的小鼠银屑病样皮损,降低PASI评分和表皮层厚度,减少表皮层Ki67的异常表达及CD3+T淋巴细胞、Ly-6C+巨噬细胞和Ly-6G+中性粒细胞的浸润,显著降低皮损中p-p38 MAPK蛋白水平。健脾养血解毒方可能通过抑制CD3+T淋巴细胞、Ly-6G+中性粒细胞和Ly-6C+单核巨噬细胞在表皮中的浸润,减少炎症因子的大量释放,降低角质形成细胞过度增殖的诱导因素,从而减轻银屑病样增生肥厚的皮损。这表明健脾养血解毒方对炎症细胞浸润的抑制作用可能是其治疗银屑病的机制之一。
健脾养血解毒方;银屑病;中性粒细胞;巨噬细胞
银屑病(psoriasis)是一种慢性炎症性皮肤病,其组织学特征包括表皮角质细胞过度增殖,角化过度伴角化不全,毛细血管新生,真皮中性粒细胞、树突状细胞、单核巨噬细胞、T淋巴细胞浸润等。咪喹莫特(imiquimod, IMQ)是Toll样受体7(Toll-like receptor 7, TLR7)和TLR8的激动剂,能够激活树突状细胞等抗原提呈细胞,从而使T细胞活化和分化,分泌大量炎症细胞因子,诱导小鼠皮肤出现表皮增殖、免疫细胞浸润、鳞屑等类似银屑病的病理变化。健脾养血解毒方(Jianpi-Yangxue-Jiedu decoction, JYJD)是临床治疗银屑病的有效方剂。本课题组前期研究发现,JYJD能够显著缓解小鼠银屑病样皮损表现,调节Treg/Th17轴免疫平衡[1]。本研究在此基础上观察了JYJD在银屑病发病的固有免疫阶段对中性粒细胞、单核巨噬细胞等炎症细胞浸润的作用,并揭示其可能的作用机制,作为临床应用的理论依据。
材料和方法
1 动物
SPF级雄性BALB/c小鼠,体重18~20 g,6~8周龄,由北京华阜康生物技术股份有限公司提供,许可证编号SCXK(京)2019-0008。实验经北京市中医研究所实验动物管理委员会批准,伦理审查号:2021020202。
2 药物与试剂
甲氨蝶呤(methotrexate, MTX)片购自上海上药信谊药厂有限公司;IMQ乳膏为四川明欣药业有限责任公司生产;JYJD(由茯苓、白术、柴胡、白芍、陈皮、当归、生地黄、丹参、鸡血藤、麦冬、玄参、土茯苓和白花蛇舌草组成)中药材来源于首都医科大学附属北京中医医院中药房,以常规煎服法制备水煎剂,并按照成人(60 kg)剂量换算成小鼠灌胃用量,以临床等药量为中剂量,浓缩1倍为高剂量,稀释1倍为低剂量。DAB显色液和山羊血清工作液均购自北京中杉金桥生物技术有限公司;Ki67、Ly-6C、Ly-6G和CD11b抗体购自Cell Signaling Technology。
3 方法
3.1分组、造模及给药参考van der Fits等[2]小鼠银屑病样模型制备方法造模。依据随机数字表法,将小鼠随机分为空白对照(control, Ctrl)组、模型组(IMQ组)、MTX组、高剂量JYJD(high-dose JYJD, JYJD-H)组、中剂量JYJD(middle-dose JYJD, JYJD-M)组和低剂量JYJD(low-dose JYJD, JYJD-L)组,每组6只。造模同时灌胃给药,MTX组给予MTX溶液(1 mg/kg,生理盐水溶解),JYJD各剂量组给予相应JYJD水煎剂,Ctrl和IMQ组给予生理盐水,每天1次,每次0.2 mL。
3.2小鼠银屑病样皮损表现及严重程度评分每日对实验小鼠皮损进行拍照,根据PASI评分标准,鳞屑、浸润和红斑按0~4分评价:0分=无;1分=轻微;2分=中度;3分=重度;4分=极严重。每日记录统计分析各组小鼠鳞屑、浸润和红斑分值,将三者分值相加计算总分,绘制PASI评分趋势图,动态观察小鼠皮损的变化情况。
3.3苏木精-伊红(hematoxylin-eosin, HE)染色观察小鼠皮损组织形态学改变每组小鼠脱颈处死后,剪取相对应皮损处组织,固定于多聚甲醛中,经石蜡包埋、切片、脱蜡水化、HE染色、脱水、封片,显微镜下观察并拍照。每个标本选4张染色切片观察组织病理学改变,并在20及40倍物镜下拍照,对40倍物镜下图片采用ZEN图像分析系统测量表皮厚度。
3.4免疫组化法检测小鼠皮损组织CD3+、Ki67+、CD11b+、Ly-6C+和Ly-6G+细胞浸润情况每组小鼠脱颈处死后,剪取相对应皮损处组织,固定于4%多聚甲醛中,经石蜡切片,脱蜡水化,柠檬酸缓冲液高温高压进行抗原修复,封闭,Ⅰ抗4 ℃孵育过夜,Ⅱ抗孵育,DAB显色,脱水、透明、封片,显微镜下观察并拍照,并计算阳性细胞数及平均吸光度。
3.5Western blot检测小鼠皮损组织p38和ERK蛋白的表达采用常规方法提取皮肤样本的总蛋白,使用BCA法测定蛋白浓度,经变性、电泳、电转后,使用5%脱脂牛奶室温封闭1 h,Ⅰ抗4℃孵育过夜,Ⅱ抗室温摇床避光孵育1 h,扫膜获得目的蛋白条带并进行灰度分析。
4 统计学分析
采用SPSS 17.0及GraphPad Prism 9.0软件进行统计分析。实验数据均采用均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-检验。以<0.05表示差异有统计学意义。
结果
1 JYJD改善银屑病样小鼠皮损表现
Ctrl组小鼠皮肤光滑,呈淡粉色;与Ctrl组相比,IMQ组小鼠在第4天背部皮肤出现红斑、鳞屑、表皮增厚及基底潮红,第7天皮损增厚明显,出现褶皱,上覆鳞屑增多,出现片状红斑;JYJD各剂量组小鼠皮损出现时间略晚于IMQ组,且同IMQ组相比,红斑面积减小,鳞屑变薄,浸润减轻,与MTX组皮损相似,PASI评分也呈现上述趋势,见图1。
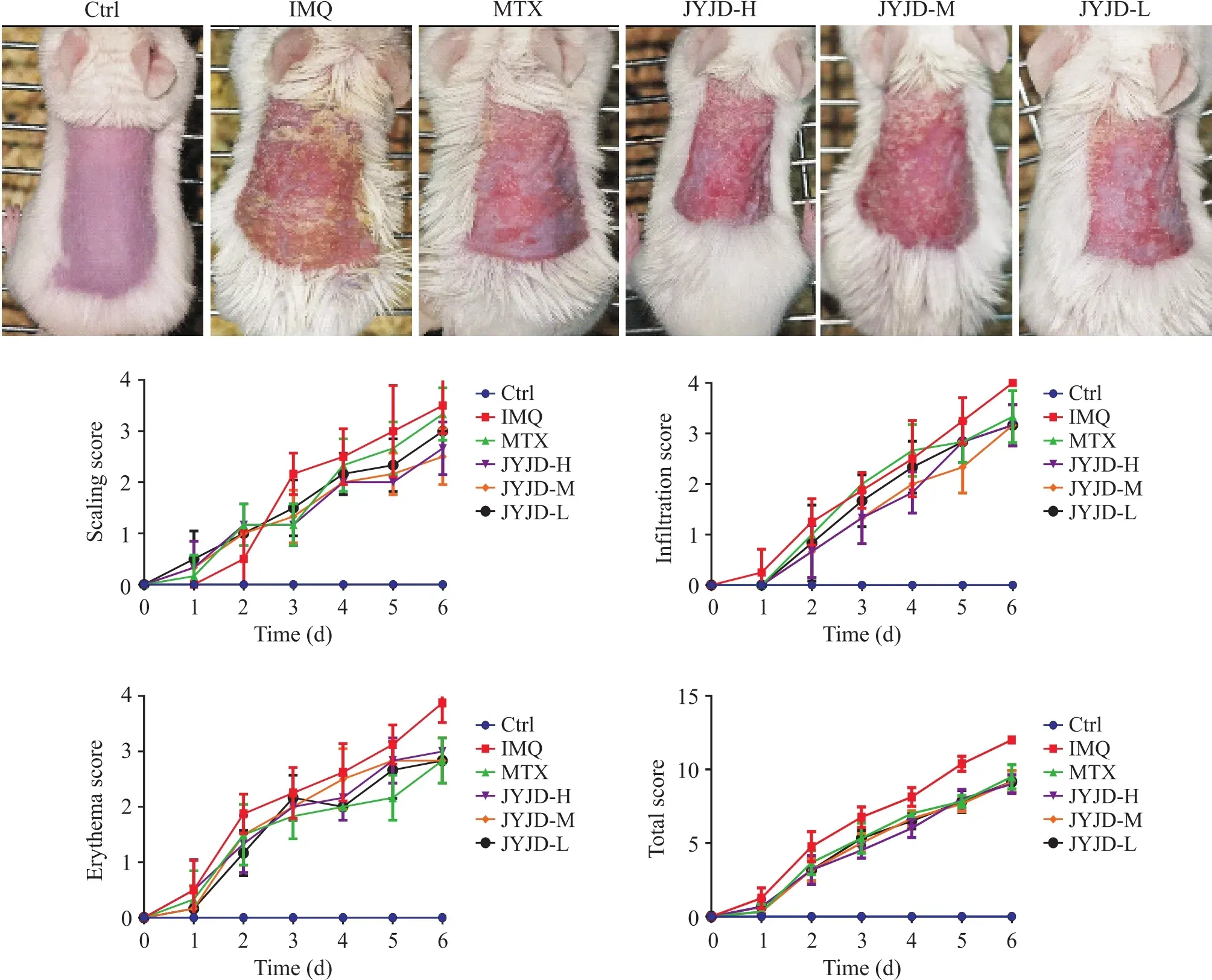
Figure 1. Effect of Jianpiyangxue-Jiedu decoction (JYJD) on the skin lesions of psoriatic mice. Mean±SD. n=6.
2 JYJD减轻银屑病小鼠模型表皮厚度
HE染色结果显示,Ctrl组小鼠表皮层较薄,炎症细胞浸润少;IMQ组小鼠表皮明显增厚(<0.01),角化不全及角化过度增加,大量淋巴细胞浸润,出现类似银屑病样皮损改变;与IMQ组相比,JYJD各剂量组小鼠表皮变薄(<0.01),角化过度及角化不全减少,炎症细胞浸润减轻,其中以JYJD-H组对表皮炎症性增殖的抑制效果最好,见图2。
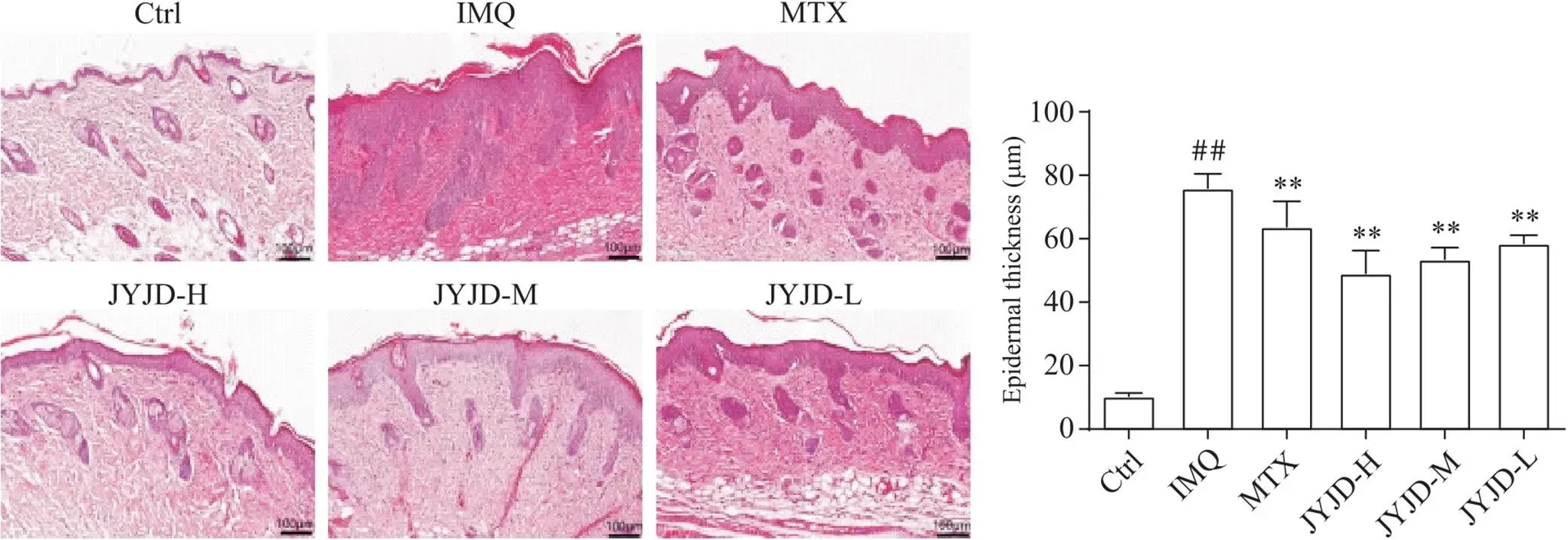
Figure 2. Pathological changes of skin lesions and measurement of epidermal thickness in mice (HE staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group; **P<0.01 vs IMQ group.
3 JYJD抑制银屑病小鼠模型角质形成细胞的增殖
免疫荧光染色结果显示,Ctrl组表皮层中存在少量Ki67+细胞;与Ctrl组相比,IMQ组Ki67+细胞数量显著增加(<0.01),位于基底层棘层,呈多层分布;与IMQ组相比,JYJD各剂量组Ki67+细胞数量显著减少(<0.01),且呈单层分布,同MTX对表皮增殖的抑制效果类似,其中以JYJD-H组效果最好,见图3。
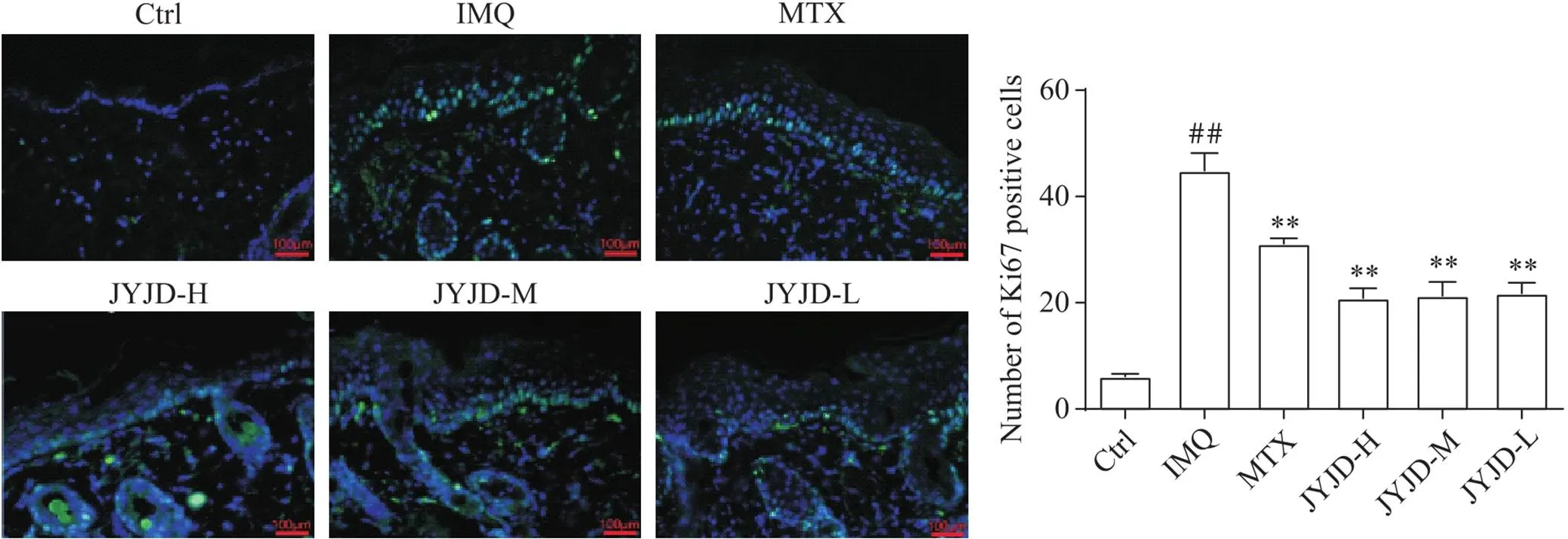
Figure 3. Expression of Ki67 in mouse epidermis (immunofluorescence staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group; **P<0.01 vs IMQ group.
4 JYJD抑制银屑病小鼠模型皮损中CD3+细胞的浸润
免疫组织化学染色结果显示,Ctrl组小鼠真皮层CD3+细胞数量较少;与Ctrl组相比,IMQ组小鼠CD3+细胞数量显著增加(<0.01),真皮及表皮中均有分布;与IMQ组相比,MTX组及JYJD各剂量组真皮层CD3+细胞数量显著减少(<0.01),见图4。
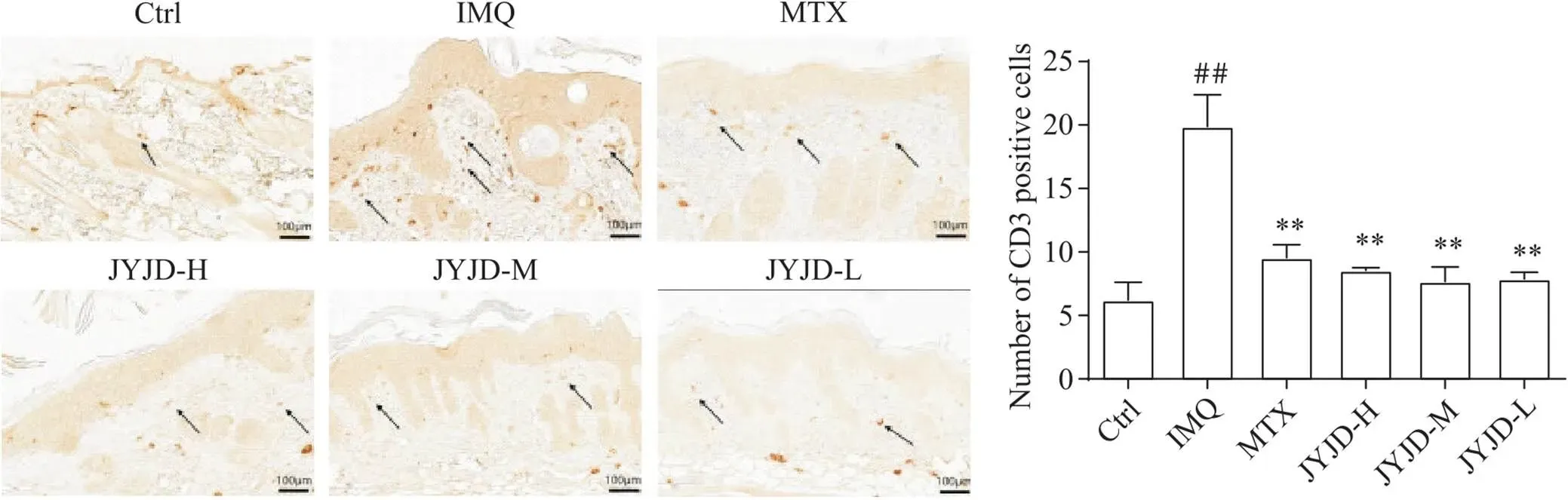
Figure 4. Expression of CD3 in skin lesions of mice (immunohistochemical staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group; **P<0.01 vs IMQ group.
5 JYJD不抑制银屑病小鼠模型皮损中CD11b+细胞的浸润
免疫组织化学染色结果显示,CD11b在Ctrl组中几乎不表达;与Ctrl组相比,IMQ组小鼠表皮中存在CD11b少量表达,真皮中主要表达在炎症细胞浸润处(<0.01);MTX组和JYJD各剂量组较IMQ组表达量略有减少,但差异无统计学显著性,见图5。
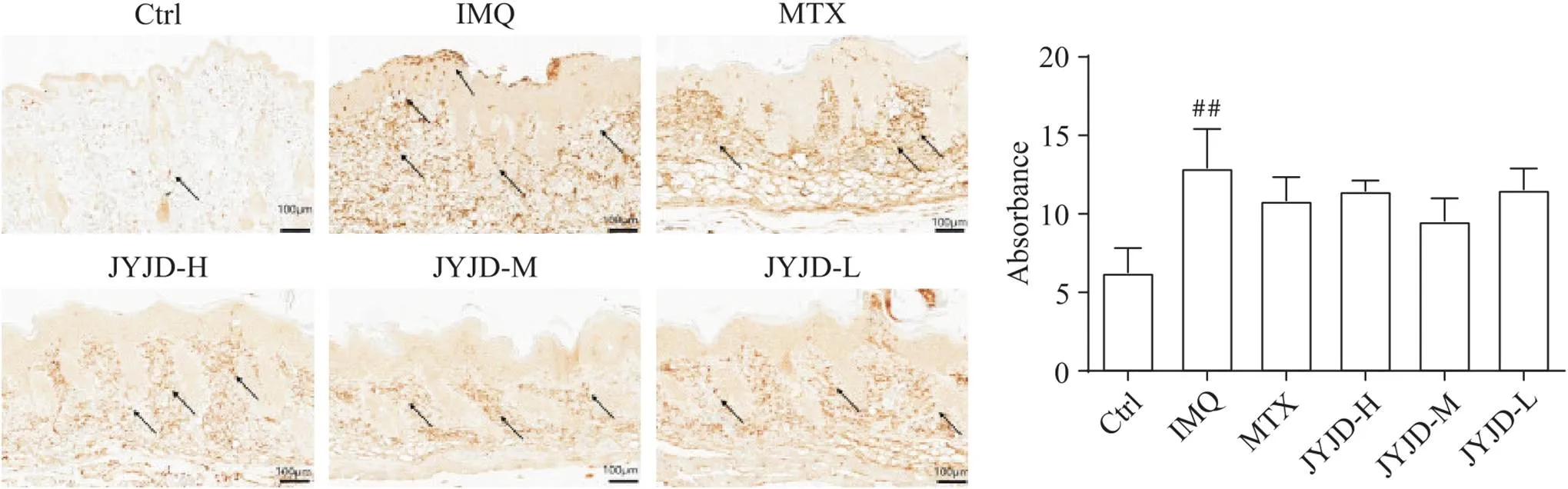
Figure 5. Expression of CD11b in skin lesions of mice (immunohistochemical staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group.
6 JYJD抑制银屑病小鼠模型皮损中Ly-6C+和Ly-6G+细胞的浸润
免疫荧光和免疫组织化学染色结果显示,Ctrl组Ly-6G和Ly-6C几乎不表达;与Ctrl组比较,IMQ组Ly-6G和Ly-6C表达量显著增加(<0.01),Ly-6C主要分布在表皮基底层,在真皮中有少量分布,Ly-6G主要表达在真皮层;与IMQ组相比,JYJD各剂量组Ly-6G和Ly-6C的表达量显著减少(<0.01),与MTX对中性粒细胞和巨噬细胞的抑制效果类似,其中JYJD-H组对Ly-6G+中性粒细胞的作用最为明显,见图6、7。
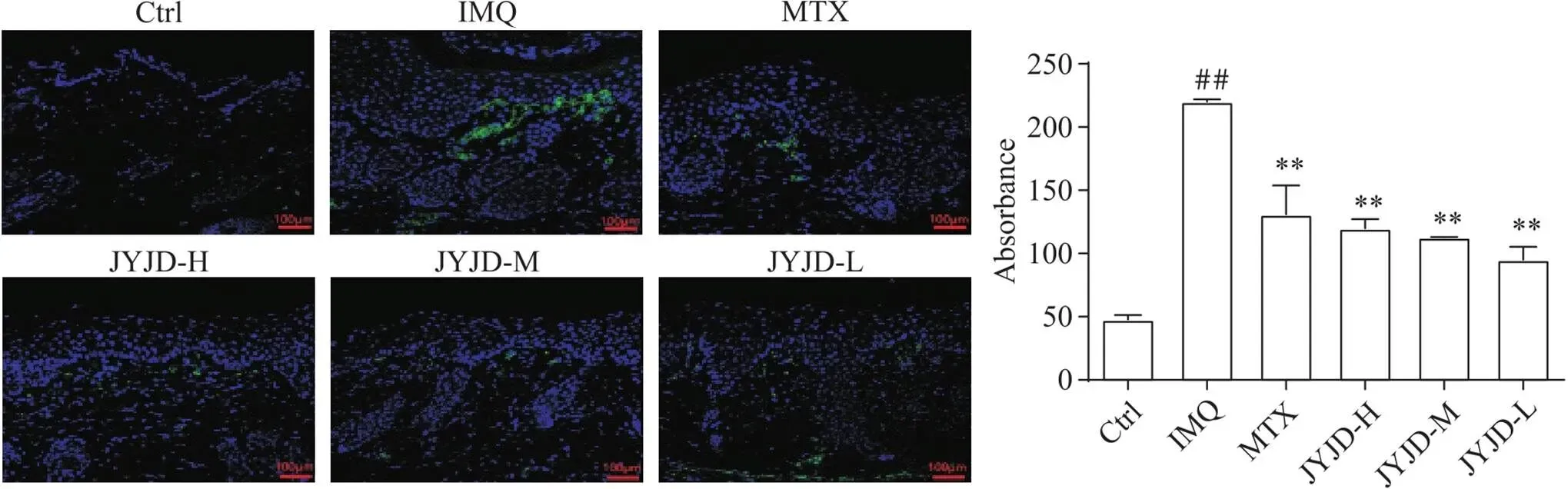
Figure 6. Expression of LY-6C in skin lesions of mice (immunofluorescence staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group; **P<0.01 vs IMQ group.
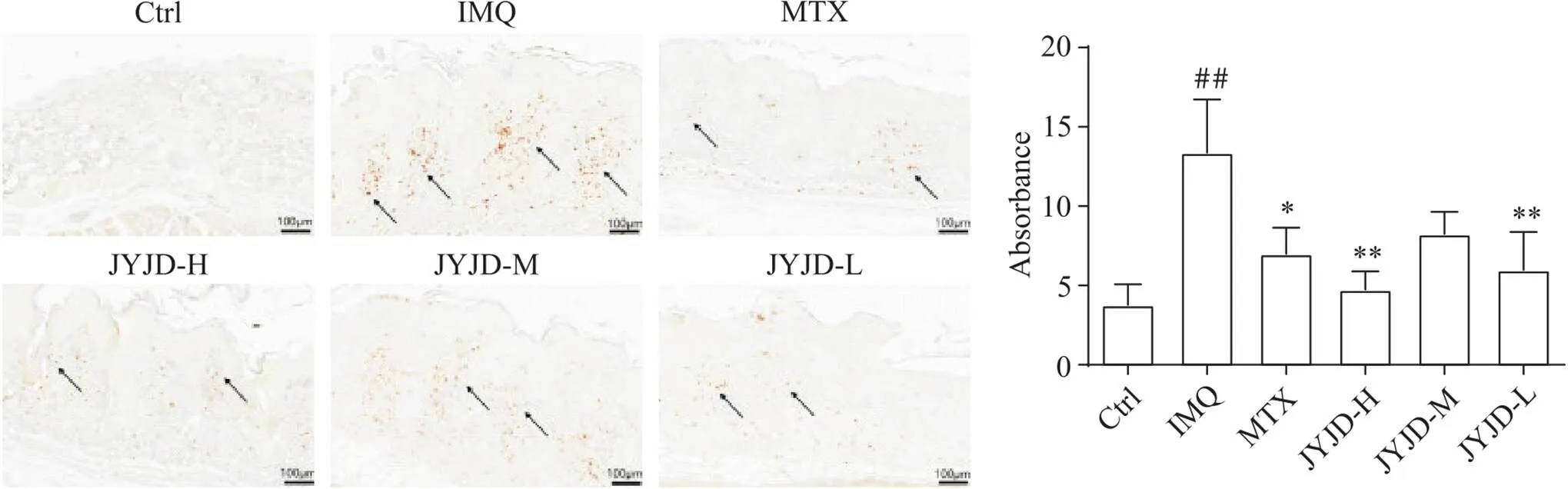
Figure 7. Expression of LY-6G in skin lesions of mice (immunohistochemical staining, scale bar=100 μm). Mean±SD. n=6. ##P<0.01 vs Ctrl group; *P<0.05, **P<0.01 vs IMQ group.
7 JYJD抑制银屑病小鼠模型皮损中p38和ERK蛋白磷酸化
Western blot结果显示,与Ctrl组相比,IMQ组p38蛋白的磷酸化水平显著升高(<0.01),ERK蛋白的磷酸化水平有升高趋势,但差异未见统计学显著性;与IMQ组相比,JYJD-H组p38蛋白的磷酸化水平显著降低(<0.01),与MTX组接近,ERK蛋白的磷酸化水平有所降低,但差异未见统计学显著性,见图8。
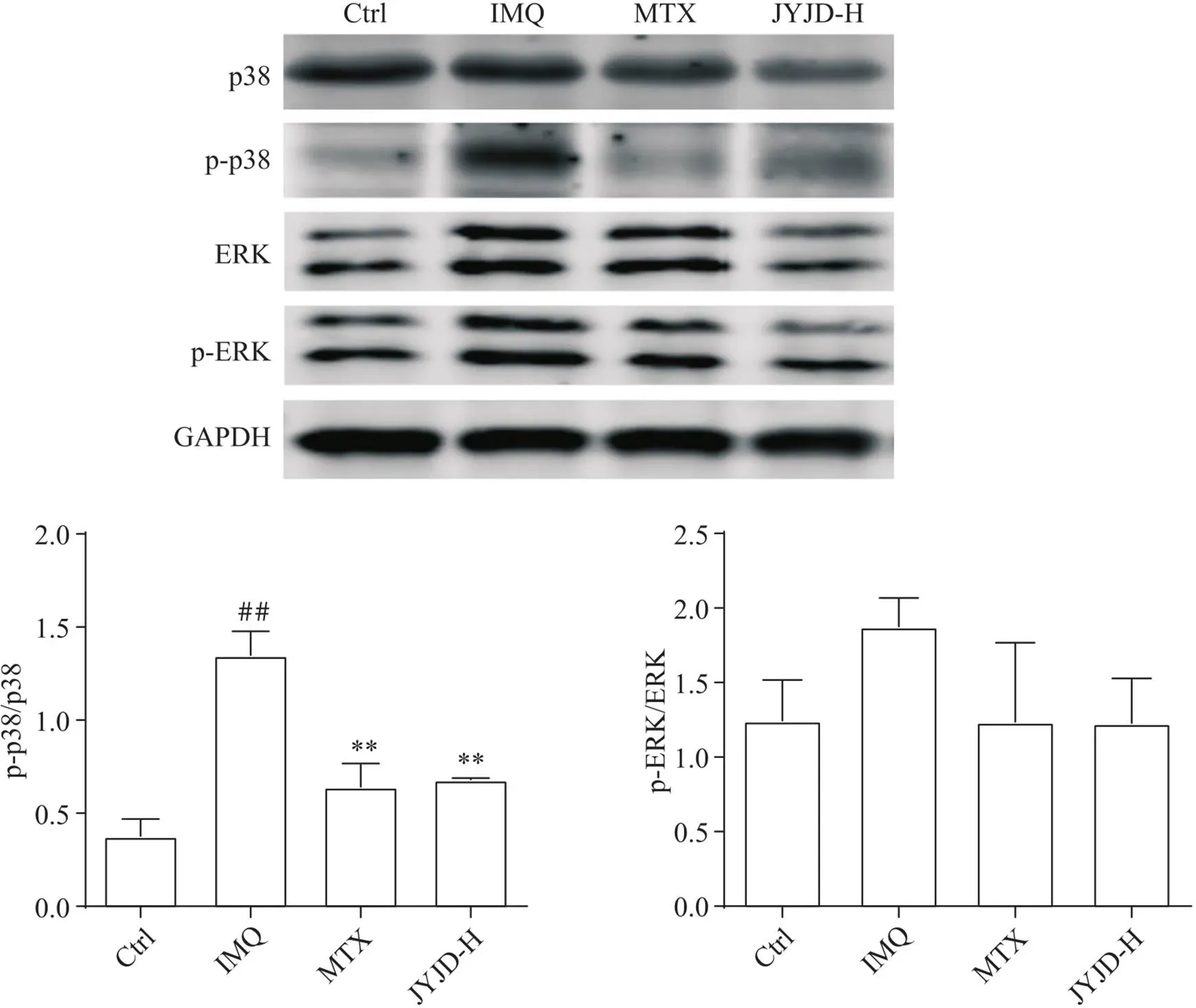
Figure 8. Expression of p38 and ERK pathway proteins in mouse skin lesions. Mean±SD. n=4. ##P<0.01 vs Ctrl group; **P<0.01 vs IMQ group.
讨论
银屑病是一种遗传与环境共同作用诱发的由免疫介导的慢性、复发性、炎症性、系统性疾病,典型临床表现为鳞屑性红斑或斑块,无传染性,治疗困难,常罹患终身[3]。现代医学认为银屑病是由Th17细胞为主的炎症细胞及相关细胞因子与角质形成细胞间相互作用诱导并维持的[4-5]。然而,中性粒细胞在真皮层大量浸润,并进一步被趋化迁移到表皮形成Munro微脓疡,是银屑病早期的典型病理表现之一[6]。巨噬细胞作为一种关键的天然免疫细胞,在银屑病皮损中大量活化及聚集,且激活后的巨噬细胞可独立于T淋巴细胞诱导银屑病样皮损的产生,在银屑病发病的过程中发挥着重要的作用[7]。
JYJD对脾虚型银屑病患者的疗效显著,在前期研究中发现,脾虚-银屑病样小鼠模型外周血中单核细胞趋化蛋白1、单核细胞趋化蛋白3、巨噬细胞炎症蛋白1α、巨噬细胞炎症蛋白1β、RANTES、IP-10(即CXCL10)、生长相关癌基因α等多种趋化因子的含量增加,这些趋化因子能够趋化单核细胞、巨噬细胞、中性粒细胞、活化的T细胞等,促使银屑病小鼠皮损加重[8-12]。JYJD能够显著抑制这些炎症细胞趋化因子的表达,提示JYJD可能通过抑制单核巨噬细胞和中性粒细胞趋化因子的水平,抑制单核巨噬细胞和中性粒细胞向银屑病皮损处的迁移和浸润,减少炎症细胞因子的释放,降低T淋巴细胞的活化水平,起到治疗银屑病的作用。
本研究表明,JYJD能够显著减轻IMQ诱导的银屑病样小鼠的皮损表现,对角质形成细胞的增殖及CD3+T细胞的浸润具有明显的抑制作用。基于小鼠外周血中趋化因子水平的提示,本实验检测了银屑病小鼠皮损中单核巨噬细胞及中性粒细胞的浸润情况。CD11b在骨髓系细胞中表达,通常用作骨髓系细胞的一个标志物,如中性粒细胞、单核细胞、巨噬细胞等[13]。JYJD不抑制CD11b+细胞在银屑病皮损中的浸润。Ly-6蛋白是造血细胞上被广泛应用的标志物,在不同的发育阶段表达于部分免疫细胞,如T细胞、B细胞、单核细胞、粒细胞和巨噬细胞[14]。Ly-6G是小鼠中性粒细胞的标志物,Ly-6C是小鼠巨噬细胞的标志物。本次实验表明,IMQ组Ly-6C+巨噬细胞聚集在表皮下,数量增多明显,JYJD能够显著抑制巨噬细胞在表皮下的聚集,对巨噬细胞在银屑病皮损中的浸润具有明显的抑制作用。Ly-6G+中性粒细胞在IMQ组的表皮及真皮中大量存在,同时,在小鼠皮损鳞屑中也检测到了中性粒细胞标志物的表达。JYJD能够抑制中性粒细胞在真皮中的浸润,同时,小鼠表皮层中中性粒细胞浸润减少,表明JYJD对中性粒细胞向表皮的迁移可能具有抑制作用。丝裂原活化蛋白激酶信号通路(mitogen-activated protein kinase, MAPK)参与细胞分化、增殖、凋亡和免疫调节,p38 MAPK和ERK1/2是MAPK的两条亚通路[15]。在银屑病中p38介导T细胞向Th1、Th2方向分化,ERK有助于角质形成细胞产生趋化因子,吸引炎症细胞聚集,放大炎症反应。JYJD能够有效抑制p38蛋白的磷酸化,达到治疗银屑病的目的。
综上所述,JYJD对中性粒细胞和巨噬细胞在皮损中的聚集具有显著的抑制作用,该作用可能与抑制p38通路有关,这可能是JYJD减轻银屑病皮损的有效机制。
[1]翟春艳, 底婷婷, 王燕, 等. 健脾养血解毒方通过调节Treg/Th17免疫平衡改善脾虚-银屑病复合模型小鼠银屑病样皮损[J]. 中华中医药学刊, 2019, 37(12):2888-2893.
Zhai CY, Di TT, Wang Y, et al. Effects of Jianpi Yangxue Jiedu decoction on mice psoriasis-like lesions combined with syndrome of spleen deficiency by restoring Treg/Th17 immune balance[J]. Chin Arch Tradit Chin Med, 2019, 37(12):2888-2893.
[2] van der Fits L, Mourits S, Voerman JS, et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis[J]. J Immunol, 2009, 182(9):5836-5845.
[3] Armstrong AW, Read C. Pathophysiology, clinical presentation, and treatment of psoriasis: a review[J]. JAMA, 2020, 323(19):1945-1960.
[4] Deng Y, Chang C, Lu Q. The inflammatory response in psoriasis: a comprehensive review[J]. Clin Rev Allergy Immunol, 2016, 50(3):377-389.
[5] Sticherling M. Psoriasis and autoimmunity[J]. Autoimmun Rev, 2016, 15(12):1167-1170.
[6]张世国, 彭立义, 王继文. 银屑病患者血清一氧化氮、肿瘤坏死因子、超氧化物歧化酶及丙二醛水平检测[J]. 中国病理生理杂志, 2000, 16(2):127.
Zhang SG, Peng LW, Wang JW. Changes of levels of serum NO, TNF-α, SOD and MDA in patients with psoriasis[J]. Chin J Pathophysiol, 2000, 16(2):127.
[7] Wang H, Peters T, Sindrilaru A, et al. Key role of macrophages in the pathogenesis of CD18 hypomorphic murine model of psoriasis[J]. J Invest Dermatol, 2009, 129(5):1100-1114.
[8] Omidian Z, Ahmed R, Giwa A, et al. IL-17 and limits of success[J]. Cell Immunol, 2019, 339:33-40.
[9] Dai YJ, Li YY, Zeng HM, et al. Effect of pharmacological intervention on MIP-1α, MIP-1α and MCP-1 expression in patients with psoriasis vulgaris[J]. Asian Pac J Trop Med, 2014, 7(7):582-584.
[10] Zablotna M, Sobjanek M, Purzycka-Bohdan D, et al. The -2518 A/G MCP-1 and -403 G/A RANTES promoter gene polymorphisms are associated with psoriasis vulgaris[J]. Clin Exp Dermatol, 2016, 41(8):878-883.
[11] 仲琳, 梁平平, 龚磊, 等. 半乳糖凝集素3对内皮细胞生长、迁移及炎症反应的影响[J]. 中国病理生理杂志, 2017, 33(6):1065-1072.
Zhong L, Liang P P, Gong L, et al. Effects of galectin-3 on growth, migration and inflammation of endothe-lial cells[J]. Chin J Pathophysiol, 2017, 33(6):1065-1072.
[12] Zlotnik A, Yoshie O. The chemokine superfamily revisited[J]. Immunity, 2012, 36(5):705-716.
[13] 袁铭, 肖漓, 许晓光, 等. 地奥司明对肾缺血再灌注大鼠肾组织MPO和中性粒细胞CD11b、CD54及CD62L水平的影响[J]. 中国病理生理杂志, 2013, 29(8):1492-1495.
Yuan M, Xiao L, Xu XG, et al. Effects of diosmin on activity of myeloperoxidase in renal tissues and expression of CD11b, CD54 and CD62L on neutrophils in rats with kidney ischemia and reperfusion[J]. Chin J Pathophysiol, 2013, 29(8):1492-1495.
[14] Bamezai A. Mouse Ly-6 proteins and their extended family: markers of cell differentiation and regulators of cell signaling[J]. Arch Immunol Ther Exp (Warsz), 2004, 52(4):255-266.
[15] Raingeaud J, Gupta S, Rogers JS, et al. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-activated protein kinase activation by dual phosphorylation on tyrosine and threonine[J]. J Biol Chem, 1995, 270(13):7420-7426.
Jianpi-Yangxue-Jiedu decoction inhibits inflammatory infiltration in the model of psoriasis induced by imiquimod
ZHAO Ning, DI Ting-ting, WANG Yan, FENG Fang, QI Cong, HU Xue-qing, WANG Ya-zhuo, ZHU Hao-yue, YANG Dan-yang, ZHANG Xia-wei, LI Ping△
(,,,,100010,)
To observe the effect of Jianpi-Yangxue-Jiedu decoction on the mouse model of psoriasis induced by imiquimod (IMQ), and to explore its mechanism.BALB/c mice were randomly divided into control group, model group (IMQ group), methotrexate group, and high-, middle- and low-dose Jianpi-Yangxue-Jiedu decoction groups. The mouse model of psoriasis-like lesion was induced by smearing IMQ on the back. Skin lesions were monitored daily using psoriasis area and severity index (PASI), and the dermatopathological changes were observed by HE staining. The expression of Ki67 in epidermis and the infiltration of Ly-6G+neutrophils were detected by immunofluorescence staining, and the infiltration of CD3+T lymphocytes, CD11b+bone marrow mononuclear cells and Ly-6C+macrophages was detected by immunohistochemistry. The levels of MAPK family proteins (p38 MAPK, ERK1/2, p-p38 MAPK and p-ERK1/2) were detected by Western blot.Compared with model group, Jianpi-Yangxue-Jiedu decoction attenuated the psoriasis-like lesions induced by IMQ, reduced the PASI score and the thickness of epidermis, and decreased the abnormal expression of Ki67 in epidermis and the infiltration of CD3+T lymphocytes, Ly-6C+macrophages and Ly-6G+neutrophils. Jianpi-Yangxue-Jiedu decoction also decreased the protein level of p-p38 MAPK in the lesions.Jianpi-Yangxue-Jiedu decoction attenuates the skin lesions of psoriasis-like hypertrophy in mice by inhibiting the infiltration of inflammatory cells.
Jianpi-Yangxue-Jiedu decoction; Psoriasis; Neutrophils; Macrophages
1000-4718(2022)09-1618-07
2022-04-07
2022-06-06
010-52176679; E-mail: liping411@126.com
R275; R751; R363.2
A
10.3969/j.issn.1000-4718.2022.09.011
[基金项目]北京市自然科学基金面上项目(No. 7212165);国家自然科学基金青年项目(No. 81904199)
(责任编辑:林白霜,罗森)

