基于p16通路探索参黄冲剂对Aβ25-35诱导的SH-SY5Y细胞凋亡和细胞周期的影响*
刘晶, 毕雪梦, 吕静萱, 王雪黎, 冯泓琳, 韩旭
基于p16通路探索参黄冲剂对Aβ25-35诱导的SH-SY5Y细胞凋亡和细胞周期的影响*
刘晶, 毕雪梦, 吕静萱, 王雪黎, 冯泓琳, 韩旭△
(南京中医药大学附属医院,江苏 南京 210029)
探究参黄冲剂对β-淀粉样蛋白(Aβ)诱导的人神经母细胞瘤SH-SY5Y细胞凋亡和细胞周期的影响。利用不同浓度(0、0.2、0.4、0.8、1.6、3.2和6.4 g/L)的参黄冲剂处理SH-SY5Y细胞48 h后,用CCK-8法检测不同浓度的参黄冲剂对SH-SY5Y细胞活力的影响。在此基础上设置空白组、模型组及低、中、高剂量参黄冲剂组。采用倒置相差显微镜观察细胞形态,Hoechst 33342荧光染色法观察细胞凋亡情况,流式细胞术检测细胞周期和细胞凋亡率,Western blot分析细胞凋亡、细胞周期及p16信号通路相关蛋白的表达变化。与模型组相比,参黄冲剂给药组细胞凋亡率降低,抗凋亡蛋白Bcl-2表达升高,促凋亡蛋白Bax和cleaved caspase-3表达下降;同时,参黄冲剂可以逆转由Aβ25-35导致的G0/G1期阻滞;与模型组相比,参黄冲剂可以上调p16蛋白的表达,下调p16下游细胞周期相关蛋白CDK4、CDK6、cyclin D1和p-RB的表达。参黄冲剂可能通过干预p16信号通路,逆转Aβ25-35诱导的SH-SY5Y细胞周期阻滞,抑制SH-SY5Y细胞凋亡。
参黄冲剂;阿尔茨海默病;细胞凋亡;细胞周期;p16信号通路
阿尔茨海默病(Alzheimer disease, AD)是一种中枢神经退行性病变,以进行性认知功能障碍和行为损害为主要临床特征[1]。国际AD协会2015年的报告显示,目前世界范围内60岁以上老年人大约有9亿人,估计全球共有约5 500万AD患者,这一数量将以每20年递增1倍的速度逐渐增加,预计到2050年将达1.39亿[2]。2019年AD和其他形式的痴呆症在主要死亡原因中位列第七,死亡人数高达163万[3]。目前全球用于痴呆的相关费用已增至2015年的8 180亿美元,与2010年相比增长了35.4%。随着老龄化社会的到来,AD患病率和死亡率逐年增高,而目前仍缺乏有效的治疗手段,加之高昂的治疗费用,可见AD已严重危害人们的生活和健康。目前临床用于治疗AD的药物如胆碱酯酶抑制剂、-甲基-D-天冬氨酸(-methyl-D-aspartic acid, NMDA)受体拮抗剂及β-淀粉样蛋白(amyloid β-protein, Aβ)靶向抑制剂等药物,价格昂贵,副作用多,且只能通过暂时缓解记忆力减退的方式帮助患者改善身体机能。因此,探究AD的病因和发病机制,寻找便宜有效且毒副作用小的治疗药物是当今医学研究的热点内容。
近年来,相关研究表明,中医药可以通过补肾化瘀、益气活血、清心开窍等治法,从减少脑内Aβ的生成、抗神经细胞凋亡、抑制小胶质细胞活化等多种途径,维持神经系统稳态,发挥治疗AD的作用[4-5]。本研究团队在南京中医药大学附属医院国医大师周仲瑛教授、省中名医韩旭教授带领下,致力于AD的临床和基础研究,根据多年临床实践经验总结,研制出以“滋阴补阳、充髓益智、化瘀祛毒”组方的院内制剂参黄冲剂(Shen-Huang granule, SHG),以其切实的临床疗效深受患者信赖。Aβ过度沉积是AD发生的重要机制,Aβ25-35作为Aβ的片段,对神经细胞具有毒性,会加速神经细胞凋亡,常被应用于模拟AD模型[6-7]。我们前期研究证实,参黄冲剂可以下调基因的表达[8],而p16在老年AD患者的海马神经元中表达增加[9-10],逆转Aβ诱导的p16表达上调可能是治疗AD的重要机制。AD中神经细胞凋亡的发生受到凋亡相关蛋白如Bcl-2、Bax、caspase及Aβ等多种因素影响[9]。因此,本研究将基于p16信号通路,阐明参黄冲剂对Aβ25-35诱导的人神经母细胞瘤SH-SY5Y细胞凋亡和细胞周期的作用机制,为参黄冲剂的临床应用提供分子生物学基础。
材料和方法
1 细胞及药物
SH-SY5Y细胞株购自中国科学院细胞库,目录号SCSP-5014。参黄冲剂由生晒参、黄精、淫羊藿、熟地黄、何首乌等中药组成,购自江苏省中医院。将颗粒剂称重后装入50 mL离心管中,用超纯水溶解至0.5 g/mL,于超净台内去除离心管盖子,将溶液分装至5 mL离心管中,每管2 mL,并用铝箔纸密封。将封装好的离心管置于冷冻干燥机内,冻干48 h,制成干燥粉末。于超净台内去除保鲜膜,紫外线照射杀菌30 min,冻干粉制备完成并于-80 ℃冰箱保存。实验时将冻干粉取出后离心,用无菌生理盐水溶解至所需浓度后,用0.22 μm滤膜过滤除菌,分装备用。
2 试剂及仪器
CCK-8检测试剂盒和细胞凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司,批号:7E530B1和7E572G1);Hoechst 33342染色试剂盒(碧云天生物科技有限公司,批号:C0003);细胞周期检测试剂盒(兰杰柯科技有限公司,批号:21327482);胎牛血清(四季青,批号:21090703);DMEM培养液(Biological Industries,批号:2151415);细胞染色缓冲液(南京福麦斯生物技术有限公司,批号:FMS20210729001);β-actin抗体(湖南艾方生物科技有限公司,批号:66032478);GAPDH抗体(Proteintech,批号:00092829);p16、CDK4、CDK6和cyclin D1抗体(杭州华安生物技术有限公司,批号:HN1214、HN0927、HN0201和HN0518);p-RB抗体(Cell Signaling Technology,批号:8516T);Bcl-2、Bax和cleaved caspase-3抗体(Affinity,批号:11o9905、44q6915和15z0096);HRP标记的山羊抗兔和山羊抗小鼠IgG(武汉塞维尔生物科技有限公司,批号:YH201006和YH203433)BCA蛋白浓度测定试剂盒、蛋白酶抑制剂混合物(100×)、RIPA裂解液、Ⅰ抗稀释液和Ⅱ抗稀释液(上海碧云天生物技术有限公司,批号:12212020210323、101320201119、092520201124、110420201126和102120201118)。
SCIENTZ-12N系列冷冻干燥机(宁波新芝生物科技股份有限公司);ChemiDoc XRS+型凝胶成像仪(Bio-Rad);ELx800型酶标仪(BioTek);FACSCelesta型流式细胞仪(BD Biosciences);CKX41型倒置相差显微镜(OLYMPUS);Ts2R型荧光倒置显微镜(NIKON);330A型低速医用离心机(北京白洋医疗器械有限公司);1300系列Ⅱ级A2型生物安全柜和88880018型涡旋振荡器(Thermo Fisher)。
3 方法
3.1细胞培养SH-SY5Y细胞培养于含10%胎牛血清的DMEM培养液中,培养环境为37 ℃、5% CO2的细胞培养箱。取对数生长期的细胞进行下列实验。
3.2CCK-8法检测细胞活力取对数生长期的细胞,以每孔1×104的密度接种到96孔板中,置于培养箱培养24 h后,用不同浓度(0、0.2、0.4、0.8、1.6、3.2和6.4 g/L)的参黄冲剂干预48 h,或用不同浓度(0、0.2、0.4、0.8、1.6、3.2和6.4 g/L)的参黄冲剂干预24 h后,再加入40 µmol/L Aβ25-35干预24 h。干预结束后弃上清,每孔加入100 µL无血清培养液和10 µL CCK-8溶液,于培养箱中继续培养2 h后,在450 nm处检测吸光度,并计算半数抑制浓度(IC50)。
3.3倒置相差显微镜下观察细胞形态取对数生长的细胞,以每孔3×104的密度接种到12孔板中,置于培养箱24 h后,分为空白组、模型组(40 µmol/L Aβ25-35干预24 h)和中药组。中药组分为参黄冲剂低、中、高剂量组,分别在造模的基础上用0.4、0.8和1.6 g/L参黄冲剂作用48 h。倒置相差显微镜下观察细胞形态变化并拍照记录。
3.4Hoechst 33342染色法观察细胞凋亡情况细胞种板培养及分组给药同3.3,干预完成后,弃上清,用PBS洗涤两次后,加入多聚甲醛固定20 min后,去除多余的多聚甲醛,加入800 µL的细胞染色缓冲液,5 µL的Hoechst 33342溶液(5 mg/L),于4 ℃孵育25 min后,倒置荧光显微镜下观察细胞核变化,淡蓝色为正常细胞,亮蓝色为凋亡细胞。
3.5流式细胞术检测细胞凋亡取对数生长期的细胞,以每孔2×105的密度接种于6孔板中,置于培养箱24 h后,分组给药同3.3,干预完成后用不含EDTA的胰酶消化细胞,加入完全培养液终止消化后,离心收集细胞,用预冷的PBS小心清洗2次;用500 μL 1× Binding Buffer重悬细胞;再加入5 μL Annexin V-FITC 及5 μL PI染色,轻轻混匀后,避光环境,室温孵育15 min后用流式细胞仪检测,观察细胞凋亡情况并计算凋亡率。
3.6流式细胞术检测细胞周期细胞种板培养同3.5,分组给药及细胞收集同3.3,取细胞沉淀,PBS清洗2次后,用1 mL的70%冰乙醇溶液重悬细胞,置于4 ℃冰箱固定过夜;再以1 000×离心5 min弃去乙醇,PBS清洗2次后,每管加入0.5 mL的PI/RNase 混合液,室温避光孵育30 min后,用流式细胞仪检测并分析细胞周期分布情况。
3.7Western blot检测细胞凋亡、细胞周期及p16通路相关蛋白的表达取对数生长期的细胞,种板培养同3.5,分组给药同3.3。干预完成后,将6孔板置于冰上,每孔加入适量RIPA裂解液,冰上裂解10 min,裂解完成后用细胞刮收集各组细胞,超声裂解3次,每次15 s,随后4 ℃、12 000 r/min离心20 min。收集上清,每组取2 μL上清用BCA法进行蛋白定量。在上清中加入适量的loading buffer,95 ℃孵育10 min使蛋白变性。将各组蛋白样本进行SDS-PAGE;然后用湿转法将蛋白转移至PVDF膜上,用脱脂奶粉封闭2 h;封闭结束后,按分子量裁剪目的条带,并将其放入相应Ⅰ抗(p16、CDK4、CDK6、cyclin D1、p-RB、Bcl-2、Bax、cleaved caspase-3和β-actin抗体,均1∶1 000稀释)中,4 ℃孵育过夜,然后用TBST洗涤3次,每次10 min;再将抗体置于对应的Ⅱ抗(1∶8 000稀释)中,室温孵育1 h,孵育完成后,用TBST洗涤3次,每次10 min;加入ECL发光液进行曝光;用Image Lab软件分析各条带灰度值。
4 统计学处理
采用SPSS 26.0、GraphPad Prism 8.0.1和Image Lab 5.2软件进行统计分析。实验数据用均数±标准差(mean±SD)表示。采用单因素方差分析比较组间差异,进一步采用LSD-检验进行两两比较。当<0.05提示差异具有统计学意义。
结果
1 参黄冲剂对SH-SY5Y细胞活力的影响
SH-SY5Y细胞在不同浓度的参黄冲剂干预48 h后呈现出不同程度的生长抑制,在3.32 g/L参黄冲剂干预48 h后,SH-SY5Y细胞生长抑制率达50%;经参黄冲剂预处理后,40 µmol/L Aβ25-35干预的细胞活力随着药物浓度的增加而升高,见图1。因此,我们选择0.4、0.8和1.6 g/L分别作为参黄冲剂低、中、高剂量组的剂量进行后续实验。
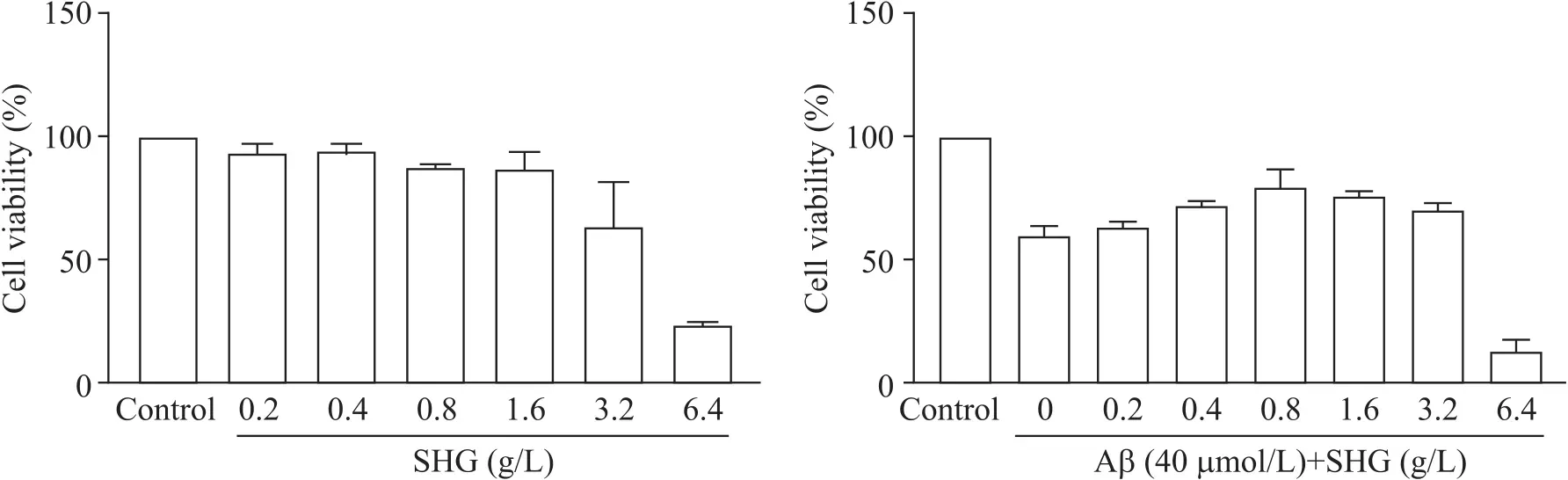
Figure 1. The effects of treatment with different concentrations of Shen-Huang granule (SHG) for 48 h or 40 µmol/L Aβ co-intervention for 48 h on the viability of SH-SY5Y cells were determined by CCK-8 assay. Mean±SD. n=5.
2 参黄冲剂对SH-SY5Y细胞形态的影响
倒置显微镜下观察发现,空白组细胞形态正常,均匀分布,贴壁状态良好;与空白组相比,模型组细胞排列不紧,多数细胞脱落,呈半贴壁状抱团生长;与模型组相比,不同浓度的参黄冲剂给药组细胞贴壁情况好转,抱团生长趋势可见一定程度逆转,见图2。
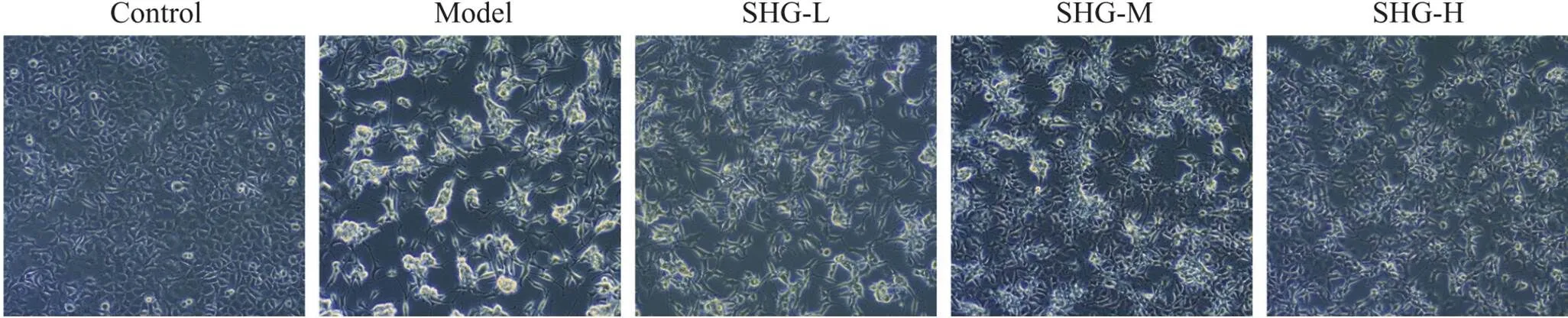
Figure 2. The morphological changes of SH-SY5Y cells in each group observed by inverted microscopy (×200). SHG-L: low-dose Shen-Huang granule; SHG-M: medium-dose Shen-Huang granule; SHG-H: high-dose Shen-Huang granule.
3 参黄冲剂对SH-SY5Y细胞核染色的影响
利用Hoechst 33342荧光染色法,在倒置荧光显微镜下观察SH-SY5Y细胞核的染色变化,活细胞细胞核呈淡蓝色荧光,凋亡细胞核呈亮蓝色荧光。空白组多数细胞核呈淡蓝色,几乎无凋亡细胞;模型组多数细胞核呈亮蓝色,提示凋亡细胞数较多;与模型组相比,参黄冲剂各剂量组亮蓝色凋亡细胞数减少,且具有一定的浓度依赖性,见图3。
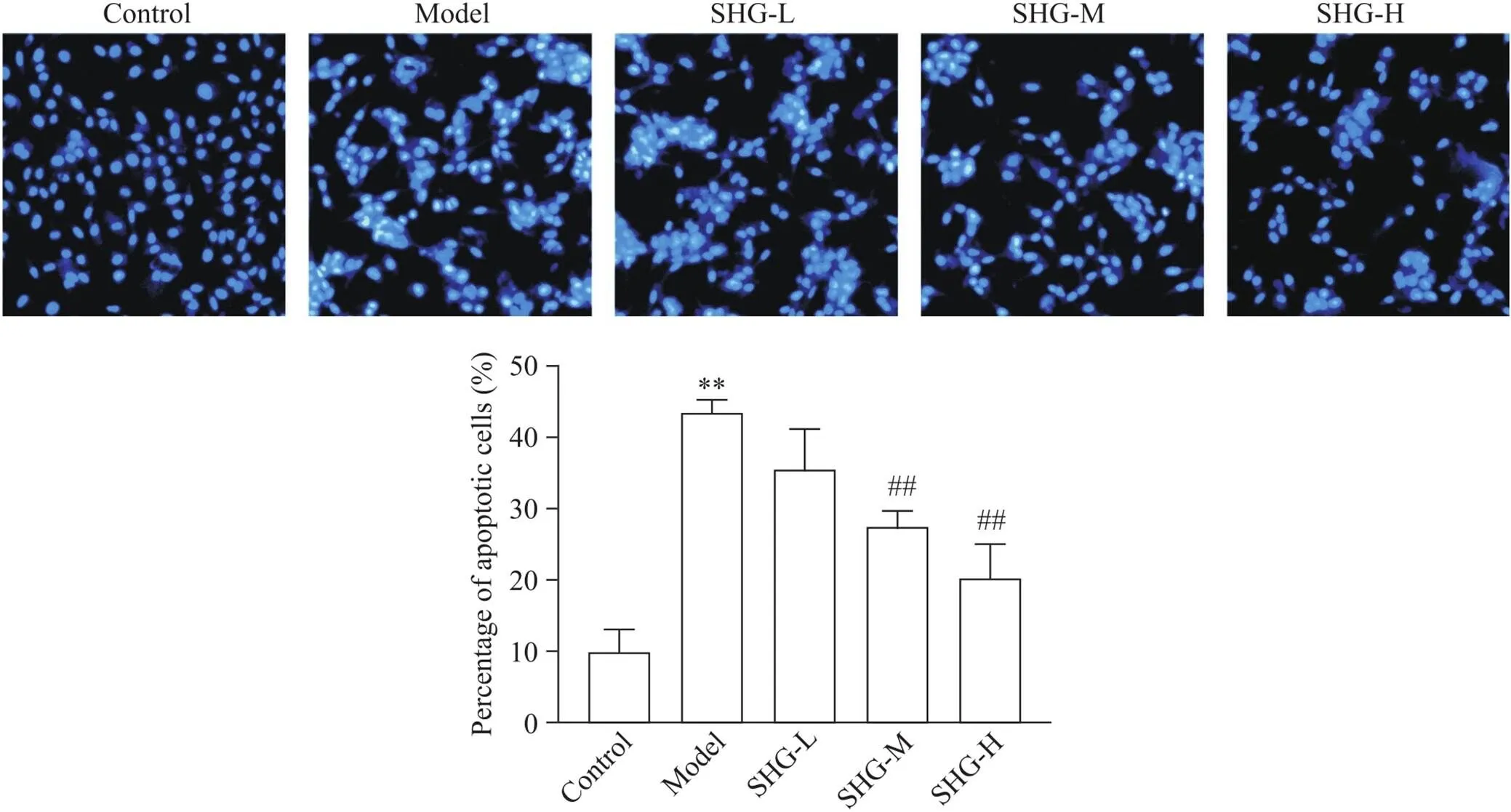
Figure 3. The apoptosis of SH-SY5Y cells in each group was detected by Hoechst 33258 staining under fluorescence microscope (×200). SHG-L: low-dose Shen-Huang granule; SHG-M: medium-dose Shen-Huang granule; SHG-H: high-dose Shen-Huang granule. Mean±SD. n=3. **P<0.01 vs control group; ##P<0.01 vs model group.
4 参黄冲剂对SH-SY5Y细胞凋亡率的影响
Annexin-V/PI双染色法可用于区分坏死细胞、早期凋亡细胞及晚期凋亡细胞。依据流式细胞术结果显示,Aβ25-35可以诱导SH-SY5Y细胞发生凋亡,而随着参黄冲剂给药浓度的增加,细胞凋亡率减少,表明参黄冲剂可以有效抑制Aβ25-35诱导的SH-SY5Y细胞凋亡过程,见图4。
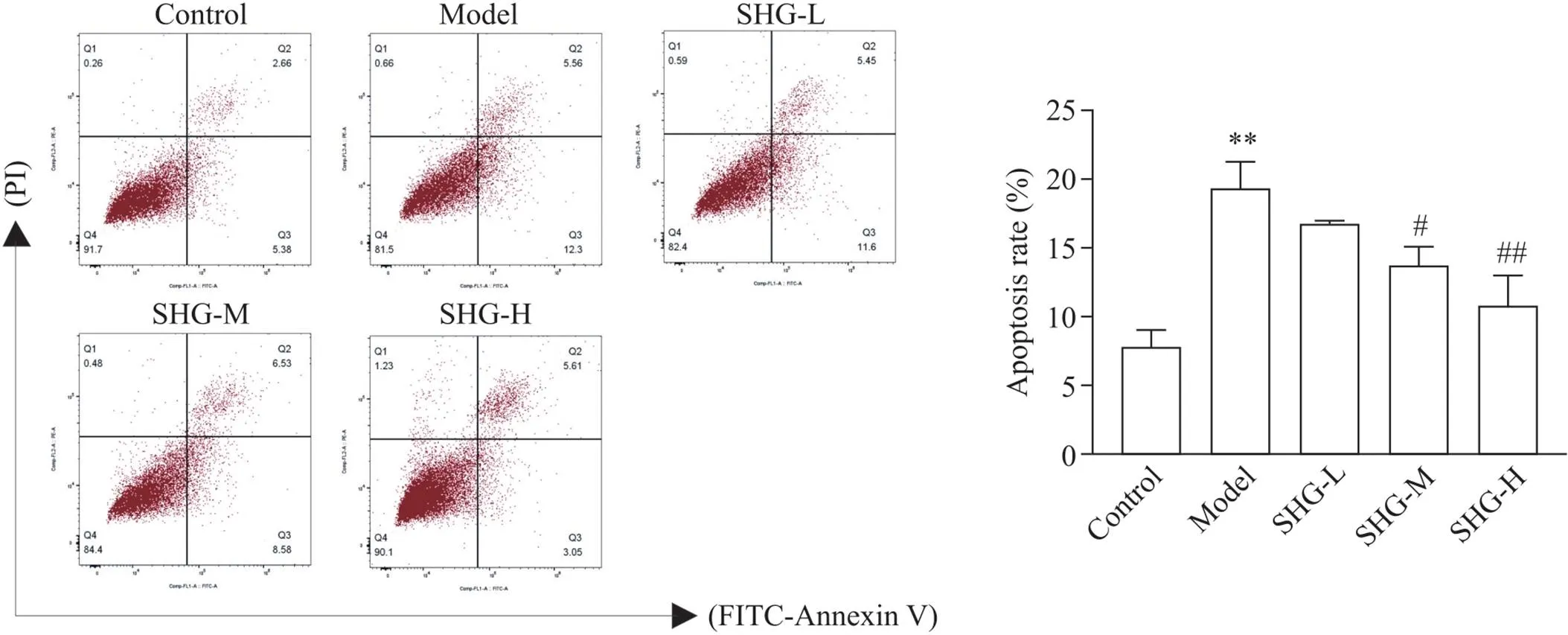
Figure 4. The effects of pretreatment with Shen-Huang granule (SHG) at different concentrations on the apoptosis of SH-SY5Y cells in 40 µmol/L Aβ25-35 environment were analyzed by flow cytometry. SHG-L: low-dose SHG; SHG-M: medium-dose SHG; SHG-H: high-dose SHG. Mean±SD. n=3. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group.
5 参黄冲剂对SH-SY5Y细胞凋亡相关蛋白的影响
Western blot实验结果显示,Aβ25-35干预后,促凋亡蛋白Bax和cleved caspase-3表达升高,抗凋亡蛋白Bcl-2表达降低;参黄冲剂可以下调SH-SY5Y细胞促凋亡蛋白Bax和cleved caspase-3的表达,同时上调抗凋亡蛋白Bcl-2的表达,表明参黄冲剂可能通过调节凋亡相关蛋白的表达而抑制SH-SY5Y细胞凋亡,见图5。

Figure 5. The effects of Shen-Huang granule (SHG) on the expression of apoptosis-related proteins in SH-SY5Y cells in 40 µmol/L Aβ25-35 environment were analyzed by Western blot. SHG-L: low-dose SHG; SHG-M: medium-dose SHG; SHG-H: high-dose SHG. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group
6 参黄冲剂对SH-SY5Y细胞周期的影响
流式细胞术结果显示,与空白组相比,Aβ25-35干预后模型组细胞中G0/G1期细胞比例显著升高;与模型组相比,参黄冲剂给药组的G0/G1期细胞比例显著降低(<0.05),见图6。这提示Aβ25-35可以诱导SH-SY5Y细胞发生G0/G1期阻滞,而参黄冲剂可以在一定能程度上抑制Aβ25-35诱导的SH-SY5Y细胞周期阻滞。

Figure 6. The effects of pretreatment with Shen-Huang granule (SHG) at different concentrations on the cell cycle distribution of SH-SY5Y cells in 40 µmol/L Aβ25-35 environment were analyzed by flow cytometry. SHG-L: low-dose SHG; SHG-M: medium-dose SHG; SHG-H: high-dose SHG. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group; #P<0.05 vs model group.
5 参黄冲剂对SH-SY5Y细胞p16通路及细胞周期相关蛋白表达的影响
Western blot实验结果显示,Aβ25-35干预后,p16蛋白表达升高,其下游细胞周期相关蛋白cyclin D1、CDK6、CDK4和p-RB表达下调;参黄冲剂可以有效逆转经Aβ25-35干预后SH-SY5Y细胞p16及其下游细胞周期相关因子cyclin D1、CDK6、CDK4和p-RB的蛋白水平,见图7。以上数据表明参黄冲剂能够通过干预p16通路调控细胞周期相关蛋白的表达变化。

Figure 7. The effects of Shen-Huang granule (SHG) on the expression of p16 signaling pathway- and cell cycle-related proteins in SH-SY5Y cells in 40 µmol/L Aβ25-35 environment were analyzed by Western blot. SHG-L: low-dose SHG; SHG-M: medium-dose SHG; SHG-H: high-dose SHG. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group
讨论
参黄冲剂选用药性较平和且无毒可久服之中草药入药,其中人参、黄精为君滋补肾之阴阳,辅以熟地、首乌、菟丝子、淫羊藿,益精填髓,补助肾气;同时兼顾老年人易夹瘀血、易成瘀毒体质,佐以虎杖活血化瘀祛毒,清补兼用,和调脏腑;选用石菖蒲作为使药,补肾开窍,宁神益志,同时引药效主入肾、脑,强肾抗衰,开窍益智。所谓“治病必求于本”,AD的治疗尤重填精补髓, 补益虚损,化瘀祛毒。气足血旺,鼓动有力,瘀毒自消,脑络通畅,神机自复。诸药合用,攻补兼施,标本兼治,相得益彰;诸法相伍,当使气血和合,以臻“疏其血气,令其条达而致和平”的治疗境地,可助AD患者改善认知,延缓痴呆之效。全方药性平和,不温不燥、不偏寒凉,相互配合,甚切AD病机之要。
神经元凋亡、Aβ沉积及tau蛋白过度磷酸化等是AD的重要发病机制[12-13]。Bcl-2家族中的抗凋亡蛋白Bcl-2和促凋亡蛋白Bax可协同作用于caspase-3下游。Aβ的过度沉积会导致促凋亡蛋白Bax过度释放,抑制抗凋亡蛋白Bcl-2的表达,从而诱导神经元发生凋亡[14]。此外,caspase-3作为所有凋亡信号的核心传导枢纽,是细胞凋亡发生的重要环节[15]。本研究结果显示,在Aβ25-35干预后,SH-SY5Y细胞凋亡率增加,同时伴随着促凋亡蛋白Bax和cleaved caspase-3表达升高,抗凋亡蛋白Bcl-2表达降低;在参黄冲剂干预后,SH-SY5Y细胞凋亡率下降,提示参黄冲剂可能通过抑制促凋亡蛋白Bax和cleaved caspase-3的表达,上调抗凋亡蛋白Bcl-2的表达,从而抑制Aβ25-35诱导的神经元细胞凋亡。
AD早期出现认知障碍的病理机制,可能与细胞周期的失调导致完全分化的神经元出现细胞凋亡密切相关,细胞周期相关因子的检测可以为神经元的早期凋亡提供有力依据[16-20]。p16信号通路是细胞从G期到S期转换的重要分子信号传导途径。一方面,cyclin D1蛋白在G1期与CDK4/6形成复合物,从而推动RB发生磷酸化,使细胞从G1期进入S期;而另一方面,p16能有效抑制CDK4/6与cyclin D1的结合及活性,致使RB去磷酸化,从而引起G1期阻滞[21-23]。此外,研究发现在老年阿尔茨海默病患者的海马神经元中p16蛋白表达增加,而逆转Aβ诱导的p16基因表达上调可以起到治疗AD的作用[9-10]。研究结果显示:在Aβ25-35干预后,SH-SY5Y细胞出现 G0/G1期阻滞,同时伴随着p16蛋白表达上调,其下游周期相关蛋白cyclin D1、CDK6、CDK4表达下调,RB磷酸化水平降低,而参黄冲剂可以逆转p16及其下游周期相关蛋白的表达变化。上述研究结果提示参黄冲剂可能通过上调p16蛋白表达,下调周期相关蛋白cyclin D1、CDK4和CDK6的表达,进而减少了cyclin D1/CDK4/CDK6复合物的形成,促进RB磷酸化,从而逆转Aβ25-35诱导SH-SY5Y细胞后发生的细胞周期阻滞。
本研究发现,参黄冲剂可以抑制促凋亡蛋白Bax和cleaved caspase-3的表达,上调抗凋亡蛋白Bcl-2的表达,从而抑制Aβ25-35诱导的神经元凋亡;同时我们发现,参黄冲剂可能通过上调p16蛋白表达,进而降低其下游细胞周期相关蛋白cyclin D1、CDK4和CDK6的表达水平,减少了cyclin D1/CDK4/CDK6复合物的形成,推动了RB磷酸化,进而逆转Aβ25-35诱导SH-SY5Y细胞后发生的细胞周期阻滞。因此,我们大胆推测,参黄冲剂对Aβ25-35诱导的SH-SY5Y细胞的保护机制,可能与调控p16信号通路干预细胞周期阻滞、抑制细胞凋亡有关,但由于参黄冲剂作为复方制剂,其治疗AD是否存在其他作用靶点有待进一步研究。
[1] Breijyeh Z, Karaman R. Comprehensive review on Alzheimer's disease: causes and treatment[J]. Molecules, 2020, 25(24):5789.
[2]李林. 中国阿尔茨海默病研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(5):765-783.
Li L. Research progress of Alzheimer's disease in China[J]. Chin J Pharmacol Toxicol, 2015, 29(5):765-783.
[3] Robinson M, Lee BY, Hane FT. Recent progress in Alzheimer's disease research, Part 2: genetics and epidemiology[J]. J Alzheimers Dis, 2017, 57(2):317-330.
[4]邓敏贞, 钟晓琴, 彭丽霖, 等. 阿尔茨海默病的病理机制及中医药防治机制研究进展[J]. 广州中医药大学学报, 2022, 39(4):984-990.
Deng MZ, Zhong XQ, Peng HP, et al. Research progress in the pathological mechanism of Alzheimer's disease and its Chinese medicine preventive and therapeutic mechanism[J]. J Guangzhou Univ Tradit Chin Med, 2022, 39(4):984-990.
[5]张伟, 孙伟明, 徐家淳, 等. 中药调控小胶质细胞功能治疗阿尔茨海默病的机制研究进展[J]. 环球中医药, 2021, 14(11):2091-2096.
Zhang W, Sun WM, Xu JC, et al. Research progress on the mechanism of Chinese medicine regulating microglia cell function in the treatment of Alzheimer's disease[J]. Glob Tradit Chin Med, 2021, 14(11):2091-2096.
[6]杨依, 唐晓丽, 刘悦, 等. 细胞自噬在Aβ25-35损伤SH-SY5Y细胞中的作用[J]. 中国病理生理杂志, 2019, 35(11):2028-2034.
Yang Y, Tang XL, Liu Y, et al. Effect of autophagy in SH-SY5Y cells injured by Aβ25-35[J]. Chin J Pathophysiol, 2019, 35(11):2028-2034.
[7] Zhi Z, Tang X, Wang Y, et al. Sinensetin attenuates amyloid beta25-35-induced oxidative stress, inflammation, and apoptosis in SH-SY5Y cells through the TLR4/NF-κB signaling pathway[J]. Neurochem Res, 2021, 46(11):3012-3024.
[8]韩旭, 李七一, 郭宏敏, 等. 参黄冲剂对衰老患者P16基因mRNA表达及临床疗效的影响[J]. 中医学报, 2011, 26(10):1219-1222, 1228.
Han X, Li QY, Guo HM, et al. Influence of Shenhuang granule on clinical efficacy and mRNA expression of P16 gene of aging patients[J]. China J Chin Med, 2011, 26(10):1219-1222, 1228.
[9] Zuev VA, Dyatlova AS, Lin'kova NS, et al. Expression of Aβ42, τ-protein, p16, p53 in buccal epithelium: prospects for use in the diagnostics of Alzheimer's disease and rate of aging[J]. Bull Exp Biol Med, 2019, 166(5):676-679.
[10] Wang J, Zheng B, Yang S, et al. The protective effects of Agomelatine against Aβ1-42 oligomers-induced cellular senescence mediated by SIRT6 and Agomelatine's potential in AD treatment[J]. Hum Cell, 2021, 34(6):1734-1743.
[11] Obulesu M, Lakshmi MJ. Apoptosis in Alzheimer's disease: an understanding of the physiology, pathology and therapeutic avenues[J]. Neurochem Res, 2014, 39(12):2301-2312.
[12] Busche MA, Hyman BT. Synergy between amyloid-β and tau in Alzheimer's disease[J]. Nat Neurosci, 2020, 23(10):1183-1193.
[13] Barthélemy NR, Li Y, Joseph-Mathurin N, et al. A soluble phosphorylated tau signature links tau, amyloid and the evolution of stages of dominantly inherited Alzheimer's disease[J]. Nat Med, 2020, 26(3):398-407.
[14] Erdal ME, Görücü Yilmaz S, Ay ME, et al. A study investigating the role of 2 candidate SNPs in Bax and Bcl-2 genes in Alzheimer's disease[J]. P R Health Sci J, 2020, 39(3):264-269.
[15] Snigdha S, Smith ED, Prieto GA, et al. Caspase-3 activation as a bifurcation point between plasticity and cell death[J]. Neurosci Bull, 2012, 28(1):14-24.
[16] Saez-Atienzar S, Masliah E. Cellular senescence and Alzheimer disease: the egg and the chicken scenario[J]. Nat Rev Neurosci, 2020, 21(10):587.
[17] Barrio-Alonso E, Hernández-Vivanco A, Walton CC, et al. Cell cycle reentry triggers hyperploidization and synaptic dysfunction followed by delayed cell death in differentiated cortical neurons[J]. Sci Rep, 2018, 8(1):14316.
[18] Chen SD, Yang JL, Lin YC, et al. Emerging roles of inhibitor of differentiation-1 in Alzheimer's disease: cell cycle reentry and beyond[J]. Cells, 2020, 9(7):1746.
[19] Joseph C, Mangani AS, Gupta V, et al. Cell cycle deficits in neurodegenerative disorders: uncovering molecular mechanisms to drive innovative therapeutic development[J]. Aging Dis, 2020, 11(4):946-966.
[20] Marlier Q, D'aes T, Verteneuil S, et al. Core cell cycle machinery is crucially involved in both life and death of post-mitotic neurons[J]. Cell Mol Life Sci, 2020, 77(22):4553-4571.
[21] Xu G, Li JY. CDK4, CDK6, cyclin D1, p16INK4aand EGFR expression in glioblastoma with a primitive neuronal component[J]. J Neurooncol, 2018, 136(3):445-452.
[22] Zhong S, Zhu J, Li Y, et al. Butylene fipronil induces apoptosis in PC12 murine nervous cells via activation of p16-CDK4/6-cyclin D1 and mitochondrial apoptotic pathway[J]. J Biochem Mol Toxicol, 2019, 33(3):e22264.
[23] Salama R, Sadaie M, Hoare M, et al. Cellular senescence and its effector programs[J]. Genes Dev, 2014, 28(2):99-114.
Role of Shen-Huang granule in apoptosis and cell cycle of human neuroblastoma SH-SY5Y cells induced by Aβ25-35
LIU Jing, BI Xue-meng, LÜ Jing-xuan, WANG Xue-li, FENG Hong-ling, HAN Xu△
(,210029,)
To explore the effect of Shen-Huang granule (SHG) on the apoptosis and cell cycle of human neuroblastoma SH-SY5Y cells induced by amyloid β-protein (Aβ) and its mechanism.After treatment with SHG at various concentrations such as 0, 0.2, 0.4, 0.8, 1.6, 3.2 and 6.4 g/L for 48 h, the viability of SH-SY5Y cells was detected by CCK-8 assay, and then the cells were divided into control group, model group, and low-, medium- and high-dose SHG groups. Morphological changes of the cells were observed by inverted microscopy. Hoechst 33342 staining was used to detect cell apoptosis. The apoptosis and cell cycle of SH-SY5Y cells were determined by flow cytometry. The proteins involved in cell cycle, apoptosis and p16 signaling pathway were assayed by Western blot.Compared with model group, SHG decreased the apoptosis rate of SH-SY5Y cells, increased the expression of anti-apoptotic protein Bcl-2, and decreased the expression of pro-apoptotic proteins Bax and cleaved caspase-3. Meanwhile, SHG reversed the G0/G1phase arrest caused by Aβ25-35. Treatment with SHG increased the expression of p16 protein but decreased the expression of the downstream cell cycle-related proteins such as CDK4, CDK6, cyclin D1 and p-RB.Treatment with SHG inhibits the apoptosis of SH-SY5Y cells induced by Aβ25-35via p16 signaling pathway
Shen-Huang granule; Alzheimer disease; Apoptosis; Cell cycle; p16 signaling pathway
1000-4718(2022)09-1569-08
2022-03-30
2022-05-25
13057504158; E-mail: hanxu9998@126.com
R285.5; R741.02
A
10.3969/j.issn.1000-4718.2022.09.005
[基金项目]江苏省自然科学基金资助项目(No. BK20181505);江苏省中医药科技发展专项计划(No. 2020ZX08);南京中医药大学自然科学基金资助项目(No. XZR2020011);江苏省研究生科研创新计划(No. KYCX22_1892)
(责任编辑:林白霜,罗森)

