叶酸受体介导的“甲氨蝶呤-川芎嗪”主动靶向纳米给药系统的制备及初步体外抗肿瘤研究
李杰,陈雨晴,王雪莹,苏慧,徐世一,高萌萌,王靖怡,肖可新,阎雪莹*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.鲁南制药山东新时代药业有限公司,山东 临沂 273400;3.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
宫颈癌是女性常见的恶性肿瘤之一,发病率及病死率呈上升及年轻化的趋势,严重威胁女性的生命健康[1-3]。中医学认为宫颈癌主要归属“癥瘕”“崩漏”“阴疮”等病的范畴,研究表明,中医药治疗宫颈癌具有独特的优势[4]。然而,制约药物治疗最重要的两个因素为单一用药治疗效果差及药物靶向性不高,因此,寻找高效、低毒的抗肿瘤药物成为治疗宫颈癌的研究热点。
川芎在中医治疗中历史悠久,东汉《神农本草经》首次记载其药效:“主中风入脑头痛、寒痹,筋脉缓急,金疮,妇人血闭无子”。川芎嗪为其主要活性成分,已广泛应用于临床治疗心脑血管疾病、呼吸系统疾病及肾脏疾病等[5-8]。近年来,越来越多的基础研究发现川芎嗪可通过多种途径对肿瘤起到治疗及辅助治疗的作用,包括抑制肿瘤细胞增殖、诱导凋亡、抑制肿瘤侵袭与转移等[9]。因此,川芎嗪在抗肿瘤及协同抗肿瘤方面具有潜在的应用价值。
甲氨蝶呤为叶酸拮抗剂,是美国FDA批准的抗代谢药物,其作用机制为竞争性抑制二氢叶酸还原酶,从而抑制DNA及RNA的合成,属于广谱抗肿瘤药物[10-11]。近年来,研究发现大多数实体瘤中叶酸受体过表达,而甲氨蝶呤与叶酸结构具有高度相似性,有研究结果显示将甲氨蝶呤设计为纳米给药系统的靶向配体既可增加纳米给药系统的靶向性,又可改善甲氨蝶呤的药代动力学特性[12-13]。
因此,为构建高效、低毒、高肿瘤靶向性的给药系统,本研究选择具有良好的生物相容性和生物降解性的壳聚糖作为药物载体,通过酰胺反应将具有双重作用的甲氨蝶呤与壳聚糖偶联,并包裹川芎嗪,构建甲氨蝶呤-川芎嗪主动靶向纳米给药系统(MTX-CS-TMP-NPs),通过叶酸受体的介导,增加药物在肿瘤组织的浓度,提高疗效,降低毒副作用,达到靶向给药的目的。
1 材料
1.1 仪器
HJ-6A数显恒温磁力搅拌器(金坛市荣华仪器制造有限公司);KQ5200DB数控超声波清洗器(昆山市超声仪器有限公司);BT25S电子分析天平(德国Sartorius公司);Axio倒置荧光显微镜(德国蔡司公司);DNM-9602酶标仪(北京普朗新技术有限公司);TDL-4低速台式离心机(上海安亭科学仪器厂);e2695高效液相色谱仪(美国waters公司);Nano-ZS90纳米粒度及Zeta电位分析仪(上海和泰仪器有限公司);TGL-16C飞鸽牌高速台式离心机(上海安亭科学仪器厂)等。
1.2 试剂与药品
甲氨蝶呤标准品(100138-201505,中国食品药品检定研究所);川芎嗪对照品(wkq16062703,四川省维克奇生物科技有限公司);川芎嗪原料药(160911R,南京道斯夫生物科技有限公司);壳聚糖(脱乙酰度:90.24%,黏度:34 mPa·S,浙江澳兴生物科技有限公司);EDC·HCl(分析纯)、NHS(分析纯,上海源叶生物科技有限公司);DMEM培养基(Gibco公司);胎牛血清(上海依科赛生物有限公司,南美进口);青霉素-链霉素双抗溶液(美国Sigma公司);四甲基偶氮唑蓝(MTT,Summus 公司);异硫氰酸荧光素(FITC,美国Sigma公司);三聚磷酸钠(分析纯,天津市凯通化学试剂有限公司);甲醇(色谱纯,美国迪马公司)。
1.3 细胞
人宫颈癌细胞株Hela购于上海揽宝仪器设备公司。
2 方法与结果
2.1 MTX-CS的合成
参照文献[14]进行。
2.1.1 甲氨蝶呤活性酯的制备
称取适量MTX,加入5 mL DMSO溶解,再加入适量缩合剂EDC·HCl和NHS(MTX、EDC·HCl与NHS的摩尔比为1∶1∶2),30 ℃避光搅拌1 h,得到甲氨蝶呤活性酯的DMSO溶液。
2.1.2 MTX-CS的制备
称取适量的CS溶解于醋酸-醋酸钠缓冲溶液(pH=5)中,超声溶解,在磁力搅拌下,将壳聚糖溶液缓慢加入到甲氨蝶呤活性酯溶液中,30 ℃避光反应24 h,然后用1 mol·L-1的NaOH溶液调节pH=9,有沉淀析出。将混合液装入透析袋中,先在pH=7.4的PBS中透析3 d(每8 h换液1次),然后于去离子水中透析3 d(每8 h换液1次)。将透析袋内的混合液冻干,即得MTX-CS。化学反应过程见图1。
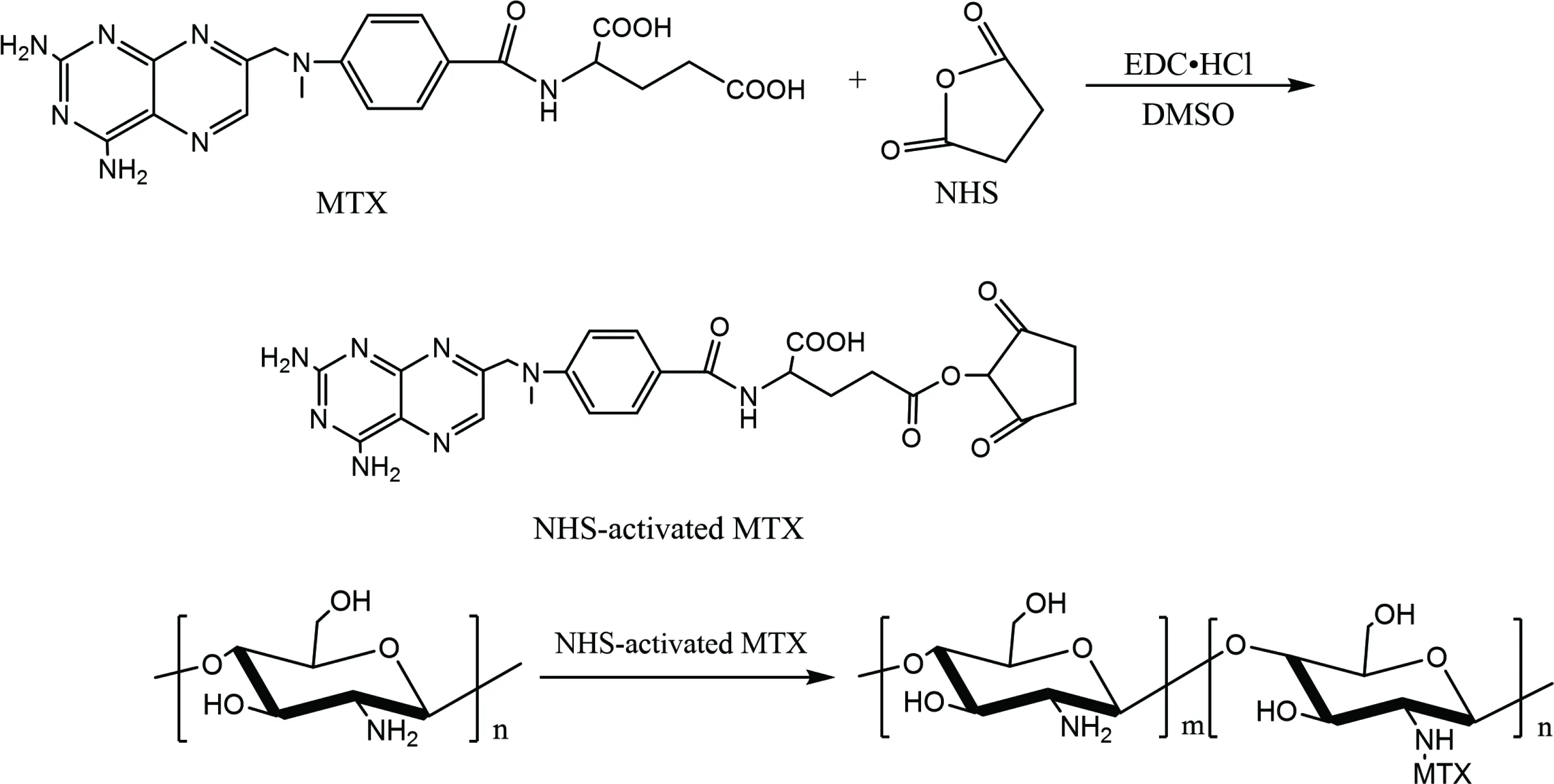
图1 MTX与CS的偶联反应
2.2 MTX-CS的结构表征
2.2.1 傅立叶红外变换光谱(FTIR)
称取MTX、CS及MTX-CS的冻干粉末适量压片。图2中箭头所指的峰为3 440 cm-1:O-H和N-H伸缩振动重叠的多重吸收峰;1 650 cm-1:酰胺Ⅰ峰(C=O伸缩振动峰);1 550 cm-1:酰胺Ⅱ峰(N-H面内弯曲振动峰),在MTX-CS中新出现的两个峰:1 607 cm-1:甲氨蝶呤苯环的伸缩振动峰;740 cm-1:甲氨蝶呤苯环的面外弯曲振动峰。由图2a可知,MTX-CS在1 650 cm-1处 C=O伸缩振动峰明显增强,3 440 cm-1处O-H和N-H伸缩振动重叠的多重吸收峰明显减弱,且出现苯环的特征吸收峰,表明MTX-CS成功合成。

注:a.MTX-CS;b.CS。图2 红外扫描图谱
2.2.2 核磁共振氢谱(1H-NMR)
称取MTX、CS及MTX-CS的冻干粉末适量,溶于DCl及D2O中,上机检测。图3为1H-NMR谱图,图3b中,δ=6.94 ppm(2H,d,J=2.0 Hz),δ=7.55 ppm(2H,d,J=2.129 Hz)为MTX中苯甲酰基的特征化学位移,δ=4.70 ppm(2H,s)为 2,4-二氨基-6-蝶啶基旁边亚甲基中氢原子的特征化学位移,δ=8.47 ppm(1H,s)为2,4-二氨基-6-蝶啶基中氢原子的特征化学位移,δ=3.17 ppm(3H,s)为甲基中氢原子的化学位移。图3c中,δ=3.20~5.40 ppm为壳聚糖中氢原子的化学位移,δ=7.68、7.38、3.27 ppm均为MTX的氢原子的特征化学位移,与图3b相比,这些氢原子的化学位移均向低场移动,δ值增大,这是由于大量的CS与MTX偶联后,使MTX与CS形成分子间氢键,使MTX分子氢核电子云密度降低,产生去屏蔽作用,化学位移向低场移动,δ值增大。1H-NMR谱结果也证明CS与MTX成功偶联。
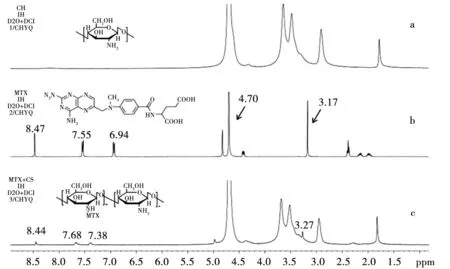
注:a.CS;b.MTX;c.MTX-CS。图3 核磁共振氢谱图
2.3 离子凝胶法制备纳米粒
离子凝胶法是制备壳聚糖纳米粒的一种简单、快速的方法,该方法条件温和、无需使用有机溶剂,能得到稳定性好、粒径均一的纳米粒,因此,本实验选用离子凝胶法制备壳聚糖纳米粒[15]。
精密称取一定量的MTX-CS,溶于3 mL pH=6.5的醋酸-醋酸钠缓冲溶液中;另精密称取适量TPP、TMP,加入2 mL超纯水,超声溶解;将上述TPP溶液2 mL逐滴加入MTX-CS溶液中,保持转速为500 r/min,25 ℃搅拌30 min,即得叶酸受体介导的MTX-CS-TMP-NPs。
2.4 TMP分析方法的建立
根据《中国药典》2015版中磷酸川芎嗪含量测定方法,建立HPLC测定TMP的分析方法。
2.4.1 色谱条件
色谱柱:Dikma Diamonsil (C18,4.6 mm×250 mm,5 μm);流动相:甲醇∶水(55∶45,v/v);检测波长:295 nm;柱温:25 ℃;流速:1 mL·min-1;进样量:20 μL。
2.4.2 专属性考察
按“2.4.1”项下的色谱条件,分别进样TMP对照品溶液、MTX-CS-TMP-NPs溶液及未载TMP纳米粒溶液,检测方法的专属性。结果如图4所示,纳米粒的载体材料对TMP的色谱峰无影响。
2.4.3 标准曲线的建立
精密称取TMP对照品配制成浓度为5、10、25、50、100、200 μg·mL-1的TMP标准溶液。按“2.4.1”项下的色谱条件进行测定,以峰面积(As)为纵坐标对浓度(C)横坐标进行回归分析,得标准曲线方程为:As=51956C-9695.5(R2=0.999 8),结果表明,TMP在5~200 μg·mL-1范围内线性关系良好。
2.4.4 精密度考察
精密配制50 μg·mL-1的TMP标准溶液,按照“2.4.1”项下的色谱条件,日内分别连续进样6次,记录峰面积,计算日内精密度。RSD值为1.65%,符合含量测定要求。
2.4.5 方法回收率考察
精密配制5、50、150 μg·mL-1的TMP标准溶液,按照“2.4.1”项下的色谱条件,进样分析,记录峰面积,采用“2.4.3”的标准曲线方程,计算实测浓度和方法回收率,RSD值<2%,符合含量测定要求。
2.5 MTX-CS-TMP-NPs包封率及载药量的测定方法
采用超滤离心法测定纳米粒中TMP的包封率,精密吸取MTX-CS-TMP-NPs溶液500 μL置于超滤离心管中,4 ℃,转速8 000 r/min,离心15 min收集超滤离心管下层液体,按照“2.4.1”项下的色谱条件,进样分析,计算MTX-CS-TMP-NPs中游离的TMP的含量为W游,投入的TMP的量为W总,同法重复3次。结果显示,此法测得的TMP包封率准确度较高,重现性好。结果见表1。包封率及载药量的计算公式为,EE(%)=(W总—W游)/W总×100%,DL(%)=(W总—W游)/W载×100%。

表1 MTX-CS-TMP-NPs中TMP包封率测定结果(n=3,%)
2.6 星点设计-效应面优化纳米粒制备工艺
2.6.1 星点设计因素、水平及指标
根据实验前期考察结果,固定实验转速750 r/min,温度50 ℃,MTX与CS的摩尔比为15∶1,将0.5 mg TMP先加入1.5 mg·mL-1的TPP溶液中,然后按照“2.3”项下方法制备纳米粒。以MTX-CS浓度、TPP浓度及TMP用量为考察因素,根据CCD原理,设计3因素5水平20个试验点的效应面分析模型。星点设计因素水平表见表2。以纳米粒的平均粒径(nm)、包封率(%)作为评价指标,对取值越小越好的指标(如:粒径)和取值越大越好的指标(如:包封率)采用Hassan[63]方法分别进行数学转换求归一值dmin和dmax,dmin=(Ymax-Yi)/(Ymax-Ymin),dmax=(Yi-Ymin)/(Ymax-Ymin),式中Yi表示各指标每一次实验测定数据,Ymax、Ymin系指各指标的实验最值。OD=(d1,d2,…,dn)1/n,n为指标数,星点设计及结果见表3。
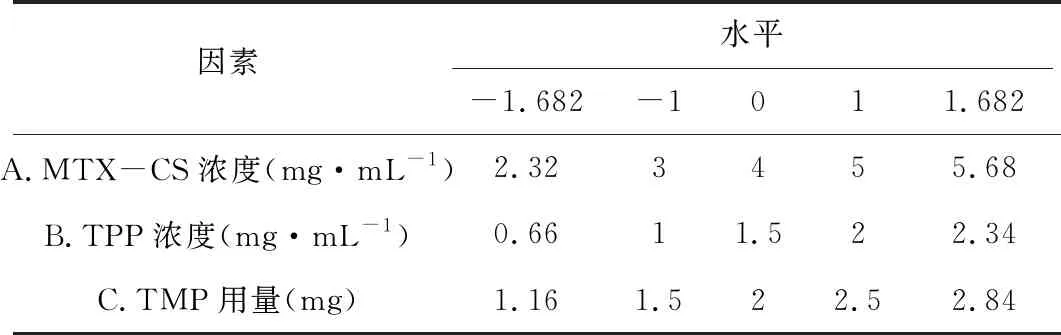
表2 星点设计因素水平
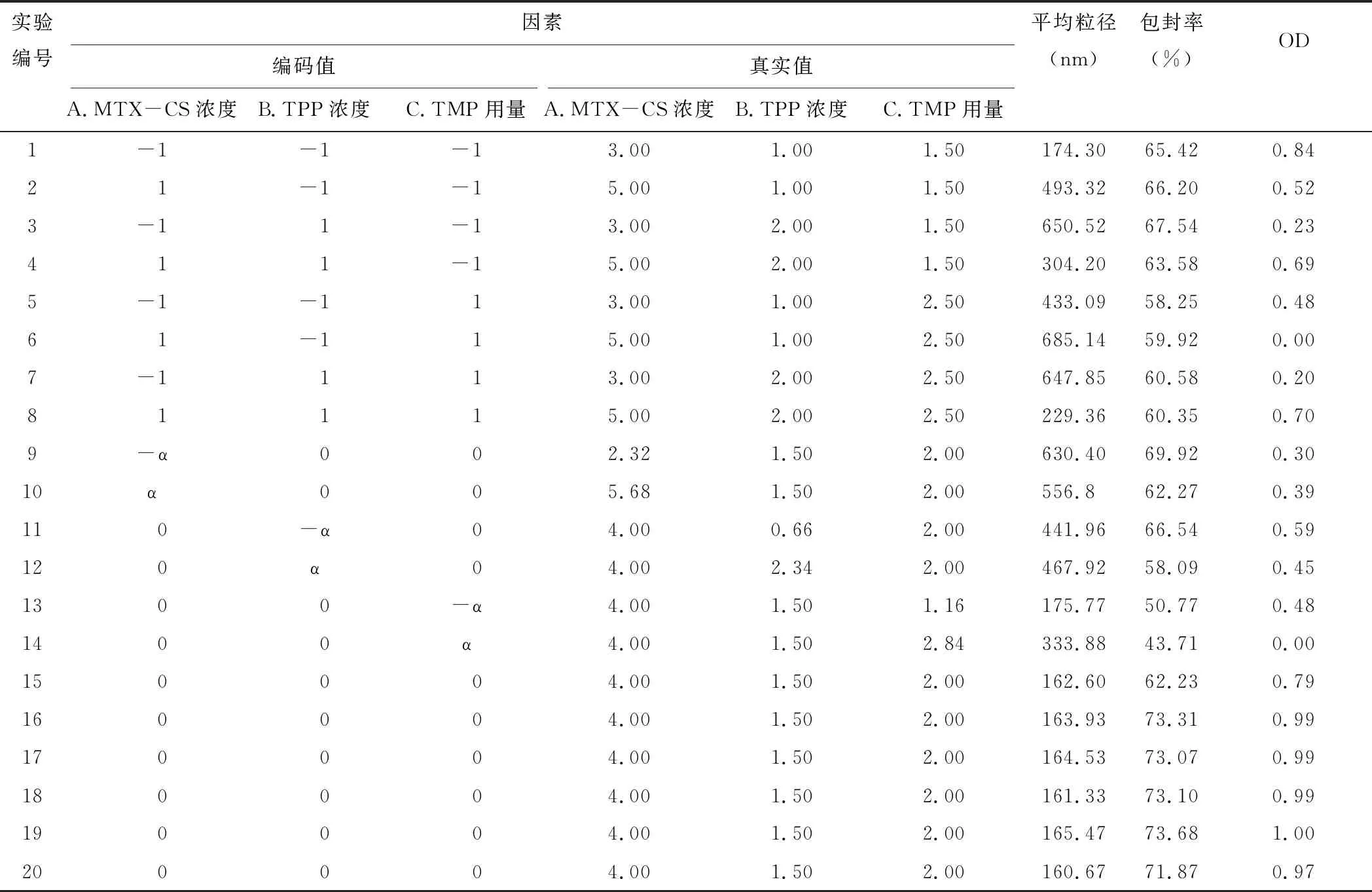
表3 星点设计表及结果
2.6.2 数据处理及模型拟合
采用Design-Expert 8.0.7统计学软件进行回归方程拟合。结果表明,OD值与自变量以二项式方程拟合时,R2最大,因此选择二项式拟合模型进行预测。二项式方程及回归模型的方差分析如下。
OD=0.95+0.022A-0.020B-0.13C+0.22AB-0.017AC+0.11BC-0.19A2-0.13B2-0.23C2(R2=0.910 0,P<0.0001)。所建立的模型有意义(P<0.05),失拟项P=0.259 3(P>0.05),表明模型拟合程度好。各因素对OD值影响大小为:C>A>B。采用Design-Expert 8.0.7统计学软件绘制因变量OD与3个自变量的三维效应面和二维等高线图,见图5。根据总评归一值OD的二维等高线和三维效应面图,利用Design-Expert 8.0.7统计学软件可以得到优化的最优处方为:MTX-CS浓度为3.84 mg·mL-1,TPP的浓度为1.36 mg·mL-1,TMP的用量为1.87 mg,此条件下制备的纳米粒粒径的预测值为154.11 nm,包封率的预测值为71.47%。
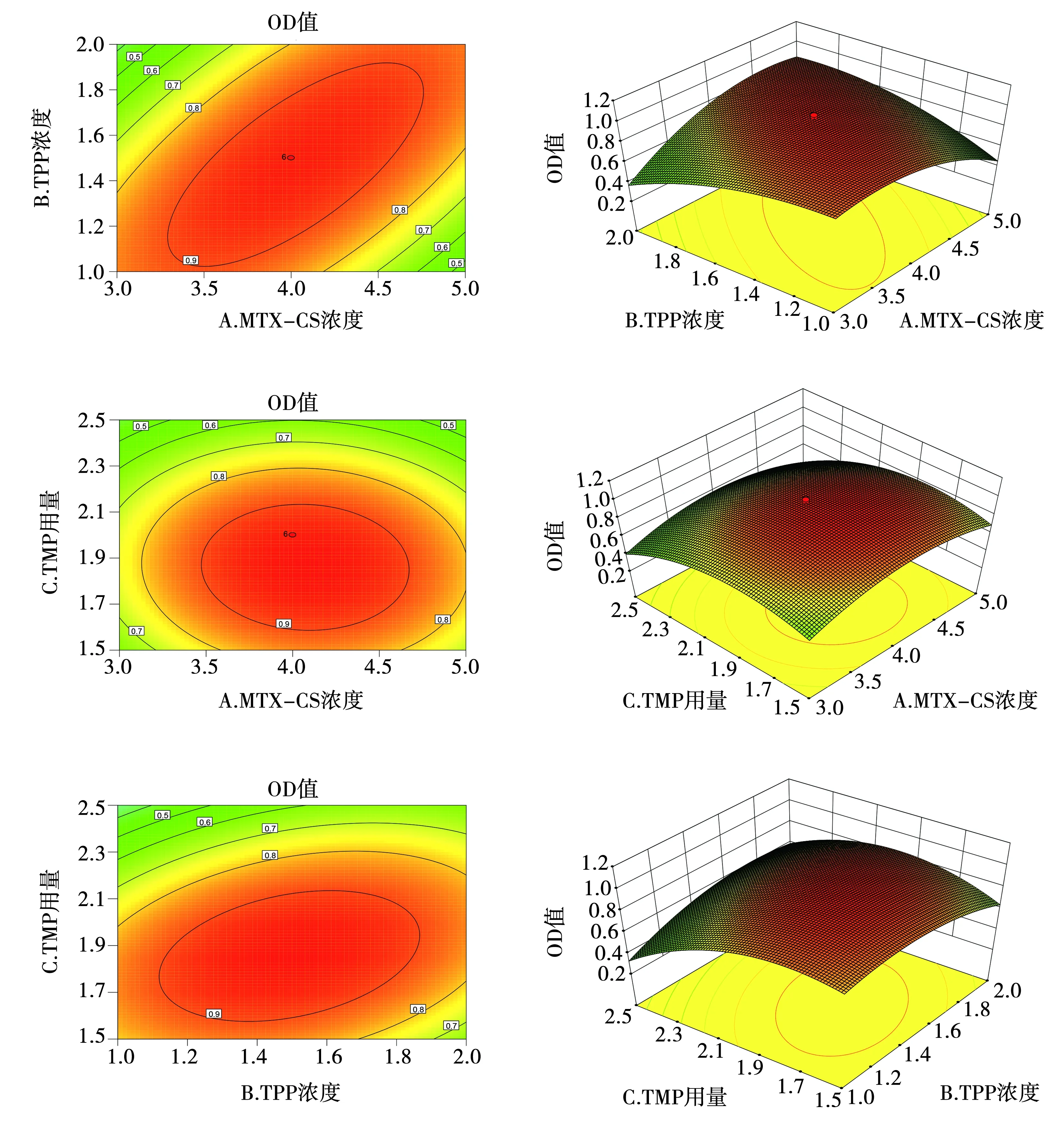
图5 OD值与不同因素的二维等高线和三维效应面
2.6.3 模型验证试验
根据确定的最优处方工艺条件,平行制备3份MTX-CS-TMP-NPs,测其平均粒径及包封率,结果显示平均粒径和包封率的实测值与预测值的偏差均<5%,表明该模型预测性良好,符合设计要求。
2.7 纳米粒的表征
2.7.1 形态观察
从图中可以看出,纳米粒呈球形,分布均一,粒径与激光粒度仪检测结果基本一致,见图6、图7。
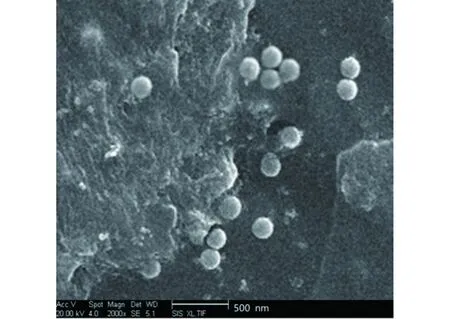
图6 MTX-CS-TMP-NPs扫描电子显微镜照片

图7 MTX-CS-TMP-NPs透射电子显微镜照片
2.7.2 粒径分布及电位
采用Zetasizer Nano- ZS90纳米粒度及 Zeta电位分析仪测定粒径和电位分布,结果见图8、图9。TX-CS-TMP-NPs平均粒径为156.6 nm,PDI为0.144,分布较均匀,zeta电位为+19.9 mV。
2.8 MTX-CS-TMP-NPs的细胞毒性研究
2.8.1 细胞毒性实验
采用DMEM完全培养基分别配制川芎嗪浓度为5、25、50、100、200、400 μg·mL-1的川芎嗪溶液组(free TMP)、川芎嗪纳米粒溶液组(CS-TMP-NPs)、甲氨蝶呤川芎嗪纳米粒溶液组(MTX-CS-TMP-NPs)、叶酸溶液与甲氨蝶呤-川芎嗪纳米粒溶液组(free FA+ MTX-CS-TMP-NPs)以及浓度为4.5、22.5、45、90、180、360 μg·mL-1的甲氨蝶呤溶液组(free MTX),其中游离叶酸溶液的浓度为100 μg·mL-1。取对数生长期的Hela细胞,调整细胞密度为2.5×104/mL,接种于96孔板中,每孔加入200 μL单细胞悬液,于37 ℃、5% CO2培养箱中培养48 h后吸弃旧培养液,分别吸取200 μL上述溶液加入96孔板中,每组各浓度设6个复孔,每组均设对照组与空白组。
将上述细胞继续培养24 h后,采用MTT法进行测定并按公式计算细胞的增殖抑制率。细胞增殖抑制率(%)=(对照组OD492 nm-实验组OD492 nm)/(对照组OD492 nm-空白组OD492 nm)×100%。

图8 MTX-CS-TMP-NPs粒径分布图
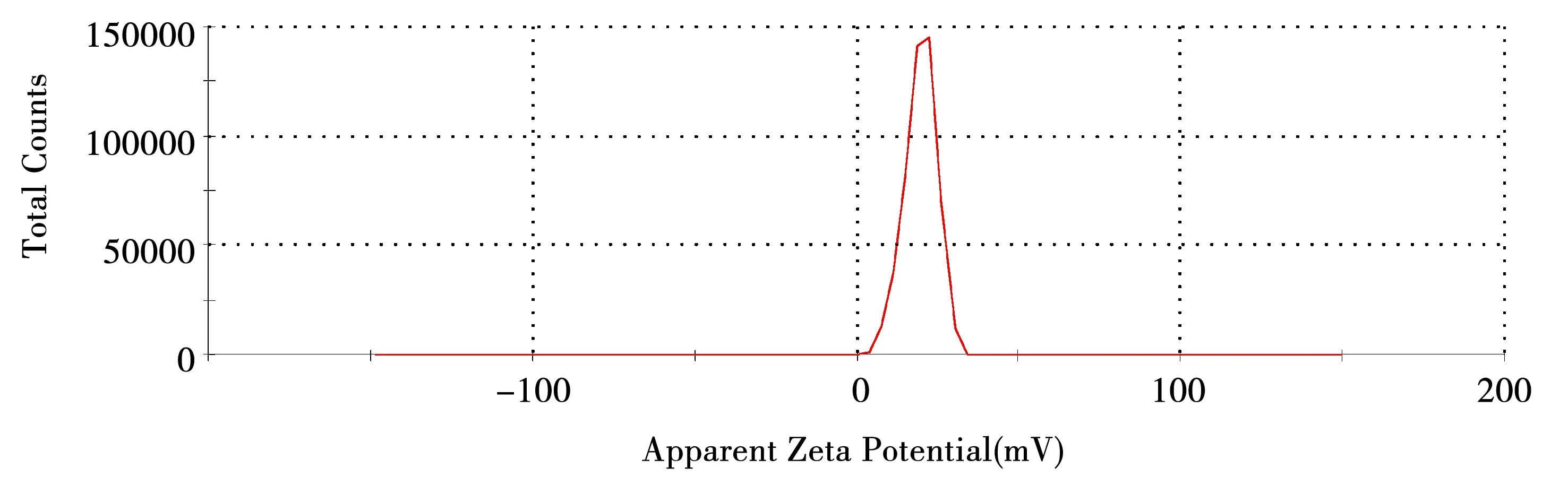
图9 MTX-CS-TMP-NPs电位图

表4 不同实验组对Hela细胞的抑制率
2.9 荧光倒置显微镜定性观察Hela细胞对纳米粒的摄取情况
2.9.1 MTX-CS-FITC-NPs的制备
精密称取11.52 mg MTX-CS溶于3 mL pH=5.5的醋酸-醋酸钠缓冲溶液中,另精密称取2.72 mg TPP,1.00 mg FITC加入2 mL超纯水中,超声溶解;将上述浓度为1.36 mg·mL-1的TPP溶液2 mL逐滴加入浓度为3.84 mg·mL-1的3 mL MTX-CS溶液中,转速为750 r/min,50 ℃搅拌30 min,即得FITC浓度为200 μg·mL-1的MTX-CS-FITC-NPs。CS- FITC-NPs的制备方法同上。
2.9.2 Hela细胞对纳米粒的摄取实验
采用pH=7.4的PBS溶液配制浓度为200 μg·mL-1的FITC溶液及浓度为100 μg·mL-1的叶酸溶液,采用完全培养基将MTX-CS-FITC-NPs、CS-FITC-NPs及free FITC溶液稀释至25 μg·mL-1(按FITC浓度计算)。取对数生长期的Hela细胞,调整细胞密度为1×105/mL,接种于12孔板中,每孔加入1 mL单细胞悬液,37 ℃,5% CO2培养箱中贴壁培养24 h,弃去旧培养液,将浓度为25 μg·mL-1的free FITC、MTX-CS-FITC-NPs、CS-FITC-NPs及free FA+ MTX-CS-FITC-NPs组分别接种于上述12孔板中,每组设3个复孔,培养24 h后,弃去培养液,用PBS洗涤3次,于荧光倒置显微镜下观察细胞对纳米粒的摄取情况,实验结果见图10。

注:A.MTX-CS-FITC-NPs; B.CS-FITC-NPs; C.free FA+MTX-CS-FITC-NPs; D.free FITC。图10 Hela细胞对壳聚糖纳米粒的摄取结果图
如图10A显示,MTX-CS-FITC-NPs与Hela细胞孵育24 h后荧光强度最高,其摄取机制主要为Hela细胞表面的叶酸受体与MTX-CS-FITC-NPs表面的MTX特异性结合,通过细胞内吞作用主动摄取纳米粒。而free FA+MTX-CS-FITC-NPs与Hela细胞孵育24 h后荧光强度最弱,这是由于大量游离的FA与Hela细胞表面的叶酸受体特异性结合后,使细胞表面的叶酸受体达到了过饱和的状态,MTX-CS-FITC-NPs表面的MTX不能与Hela细胞的特异性位点结合,从而失去了主动靶向的作用。图10 D结果显示,Hela细胞几乎不摄取游离的FITC,表明未包封的FITC不影响实验结果。以上实验结果表明,壳聚糖纳米粒经MTX修饰后,有效地提高了对Hela细胞的靶向性,Hela细胞对其摄取增加,这一结果与细胞毒性结果一致。
3 讨论
本研究通过酰胺反应将具有双重作用的甲氨蝶呤与壳聚糖偶联,并包裹川芎嗪,制备叶酸受体介导的壳聚糖主动靶向纳米给药系统,通过星点设计-效应面处方优化确定最佳工艺即MTX-CS(偶联率为14.58%)浓度为3.84 mg·mL-1,TPP的浓度为1.36 mg·mL-1,TMP的用量为1.87 mg,温度为50 ℃,转速为750 r/min,纳米粒扫描电镜图粒与透射电镜图显示纳米粒呈球形,分布均一,平均粒径为156.6 nm,PDI为0.144,分布较均匀,zeta电位为+19.9 mV,同时体外细胞毒性实验与摄取实验均证明MTX-CS-TMP-NPs通过EPR效应及靶向分子作用,将药物靶向释放于叶酸受体过表达的宫颈癌组织,有效提高了对Hela细胞的靶向性,降低化疗药物的毒副作用,增加药物的生物利用度,并发挥协同抗肿瘤的作用。
川芎在医药领域中的应用已有几千年的历史,疗效确切。川芎嗪作为川芎的主要有效成分,显示了广泛的药理作用,且多数药理活性的作用机制已经明确[16],具有巨大开发潜力。本研究期望为川芎嗪的进一步开发和应用提供理论和实验依据,为中药有效成分与现代化制剂技术研究开发提供参考。

