腹腔镜手术联合GnRH-a治疗早期子宫内膜异位症临床疗效分析
熊 倬,吴明勇,马 洁,李 霞,李承杰,齐美敬,刘启祥
子宫内膜异位症(Endometriosis),指具有生长能力的子宫内膜组织出现在子宫腔被覆内膜及宫体肌层以外的体内其他部位,多发生于育龄期女性。该病可引起女性进行性痛经、慢性盆腔疼痛以及不孕等症状,发病率逐年上升,病程长,易复发[1]。到目前为止,除了根治性手术,尚无其他方式可以根治子宫内膜异位症。药物治疗及保守性手术均有较高的复发率,腹腔镜非根治手术治疗后子宫内膜异位症的复发率高达30%~50%[2]。如何以最少的经济消耗、最大程度地减小患者的疼痛,帮助患者完成生育,减少疾病复发概率,提高患者生活质量,是临床医生的研究目标[3]。手术联合药物治疗,可以减少复发概率,或者延长复发时间[4]。促性腺激素释放激素激动剂(GnRH-a)是人工合成的十肽类化合物,其作用与天然的促性腺激素释放激素(GnRH)类似,但其稳定性好,半衰期长,效价是天然GnRH的100倍,可以通过竞争性结合GnRH受体,引起受体减少,达到“药物垂体切除”的效果,从而使异位子宫内膜组织萎缩[5]。本文回顾性分析了在疾病早期即采用新型腹腔镜手术方式联合GnRH-a的治疗方式治疗盆腔有病灶的子宫内膜异位症的患者,评估患者治疗后各项指标,评价该联合治疗的效果。
1 资料与方法
1.1 一般资料:本文选取自2017年4月至2018年12月被诊断为子宫内膜异位症患者102人,符合纳入标准,年龄22~42岁。按照患者意愿术后是否选择联合GnRH-a药物治疗,分为2组,A组(实验组)52人,术后联合GnRH-a治疗3个疗程;B组(对照组)50人,仅选择手术治疗,所有患者治疗结束后随访1年。对A组患者术后立即给予GnRH-a对症治疗1次,之后每间隔28 d 予以GnRH-a治疗1次,共3次。
1.2 纳入标准:患者有周期性下腹疼痛、性交痛等,不孕,伴/不伴后穹隆及骶韧带等处触痛结节,妇科B超检查提示附件区包块;前3月未进行子宫内膜异位症相关治疗;选择早期腹腔镜手术治疗术,术后病检确定为子宫内膜异位症;无生殖系统其他疾病;肝肾等脏器功能正常,无药物禁忌症;积极配合完成全部治疗;已婚,有生育要求,有正常性生活且未避孕未孕2年及以上;男方精液检查结果正常,术后有正常性生活,未选择其他方式干预妊娠;采用新型腹腔镜手术方式,术中分离粘连,基本恢复盆腔正常解剖,美兰实验检查输卵管通畅度,且双侧输卵管均通畅者。
1.3 效果评价:治疗结束后半年评估患者疼痛(不规则腹痛、痛经、性交痛)自觉症状,B超观察肿瘤变化。疗效评定标准[6]:自觉症状及体征完全消失,B超检查盆腔包块及病灶消失为显效;自觉症状及体征减轻,B超检查盆腔包块及病灶消失为有效;若自觉症状无明显变化甚至加重,B超检查无盆腔包块及病灶为无效。总有效率=显效率+有效率。采取患者治疗前及治疗后半年血清CA125、FSH及E2对比分析,评估两种治疗效果。为了评估2组患者复发率及妊娠率,延长随访时间至治疗结束后1年,对治疗结束后1年内再次出现疼痛等自觉症状及体征,B超检查发现盆腔包块或盆腔病灶为复发。对治疗结束后1年内有过妊娠,包括正常妊娠、早产、流产、异位妊娠等,评估2组患者术后复发率及妊娠率。
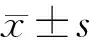
2 结果
2.1 2组患者总体疗效比较:2组患者治疗后半年进行临床疗效比较,A组总有效率94.2%,明显高于对照组(86.0%),2组比较差异有统计学意义(χ2=3.21,P<0.05),见表1。

表1 2组患者临床疗效比较[n(%)]
2.2 2组患者治疗前后临床指标比较:2组患者治疗前及治疗后半年A组CA125平均值降至(5.53±0.56)U/mL,较B组(15.56±2.50)U/mL明显低,差异有统计学意义;A组治疗后FSH(2.52±0.88)mIU/mL明显下降,较B组(4.06±0.94)mIU/mL明显低,差异有统计学意义;E2的趋势同FSH,A组(22.85±0.32)pg/mL治疗后明显下降,下降趋势较B组(44.56±0.86)pg/mL明显低,差异有统计学意义,见表2。
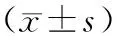
表2 2组患者治疗前后CA125及激素水平比较
2.3 2组患者治疗后1年内妊娠率及复发率比较:A组妊娠率(53.8%)高于B组(34%),差异有统计学意义;A组治疗后1年内无复发患者,而B组有2人复发,复发率高于A组,差异有统计学意义,见表3。

表3 2组患者治疗后1年内妊娠率及复发率比较
3 讨论
腹腔镜手术属于微创手术的范畴,其创伤相比传统开腹手术明显减少,能够减轻患者术后的疼痛;其次属于美容手术,腹部切口仅1~2 cm。卵巢癌的经典手术方式是肿瘤细胞减灭术,是指尽可能切除所有肉眼可见的肿瘤组织,包括转移病灶,尽量减少人体的肿瘤负荷,延长患者的生存期。根据本研究前期临床经验,对于有生育要求且诊断不孕的子宫内膜异位症患者,选择在疾病早期手术,采用新型腹腔镜手术方式。该手术方式是借鉴卵巢癌肿瘤细胞减灭术的一种手术方式。子宫内膜异位症虽然属于良性疾病,但因其生物学行为类似恶性肿瘤,有生长、浸润、转移、复发等行为,基于此,本文借鉴卵巢癌肿瘤细胞减灭术的手术方式,术中尽量切除一切肉眼可见子宫内膜异位病灶组织,包括深部病灶组织,微小病灶即使无法切除也要电凝破坏,并且术中尽量恢复盆腔正常解剖,从而给后期备孕创造正常的受孕环境。本研究前期研究观察发现,子宫内膜异位症患者选择早期手术与药物保守治疗一段时间失败后再次手术,病灶完全切除率减低,组织硬化、粘连、解剖结构破坏明显,增加了手术难度,而且手术对卵巢功能破坏较大,患者术后即使同样联合药物治疗,效果都相对较差。因此,本文选择在子宫内膜异位症患者疾病早期即选择新型的腹腔镜手术方式,以达到对病灶尽可能彻底切除的效果。
对于子宫内膜异位症所造成的不孕,有诸多原因,对于早期子宫内膜异位症,比较受认可的观点是微小病灶对盆腔微环境的改变。对于中、重度子宫内膜异位症患者,主要考虑盆腔解剖改变,从而影响输卵管功能、影响卵巢发育及排卵等[7]。手术虽然切除或破坏肉眼可见病灶,尽可能恢复盆腔正常解剖,但对于小的深部组织病灶,或造成的输卵管运卵功能降低原因之一的输卵管内异位病灶,无法切除,因此手术后联合药物治疗至关重要。
治疗子宫内膜异位症的药物众多[8],其中还包括一些中药[9],与GnRH-a相比较,大多数药物虽然廉价,但效果均较差且副作用大。近几年,临床上更倾向于选择使用GnRH-a,该药物可以明显减低复发率,改善患者生活质量[4]。GnRH-a是天然的促性腺激素释放激素的同工异质体,可抑制卵巢分泌性激素,而子宫内膜异位症是激素依赖性疾病,GnRH-a可抑制子宫内膜异位病灶生长,使病灶萎缩[10]。另一方面,GnRH-a可提高辅助性T细胞有丝分裂活性以及数量,提高患者免疫力,从而间接治疗子宫内膜异位症[11]。而且,GnRH-a药物半衰期长,药效稳定,是目前治疗子宫内膜异位症最有效的药物[12]。
研究者们尝试了各种与之相关的治疗方式,包括单用GnRH-a,联合曼月乐,联合手术[13]等。单用GnRH-a,子宫内膜异位病灶负荷重,无法彻底消除病灶,不能很好增加妊娠率,复发率高。新型腹腔镜手术后选择使用GnRH-a,不但可以缩小甚至消灭微小病灶,而且该药物可以改变盆腔微环境,降低炎性介质表达,软化输卵管,从而提高妊娠率[14]。
手术联合GnRH-a治疗子宫内膜异位症复发率最低,且治愈率最高[15]。本文选择了就诊我科被确诊为子宫内膜异位症患者,根据患者术后是否选择使用GnRH-a,随机分为2组,治疗后分析评价患者相关指标,评价治疗效果。对照组仅行手术治疗,实验组术后联合GnRH-a治疗三次,在手术基础上联合药物治疗,目的是杀灭手术无法切除的微小病灶,尽量提高患者治疗效果,减低患者复发率。从本研究的数据中可以看到,实验组GnRH-a总的有效率明显高于对照组。实验组仅选择联合GnRH-a治疗3次,是因为在前期的临床工作中我们发现长期使用GnRH-a会影响患者卵巢功能;而短时间使用,不但治疗效果好,而且仅个别患者有潮热、盗汗,性欲下降等不适,大部分患者无明显不适,停药后症状可消失,并可立即备孕。极少数患者低雌激素症状明显,可反向添加补充雌激素缓解症状,适当的反向添加可以治疗即时副作用和防止长期后遗症。有研究证明反向添加雌激素是安全的,对于病情严重患者,GnRH-a可联合反向添加雌激素延长治疗至1年[15]。并有研究指出减少GnRH-a剂量或增加剂量之间的间隔已被证明是有效的,成本较低,且能维持低雌激素环境[16],可以用于后期临床治疗中。

