一种测定蛹虫草中虫草酸含量的酶标仪微量反应方法
柴林山,李剑梅,孙翠焕,谢存一,张疏雨,朱万芹,白玉红
(1.辽宁省微生物科学研究院,辽宁 朝阳 122000;2.营口市食品药品检验检测中心,辽宁 营口 115000)
蛹虫草(Cordycepsmilitaris)又称北虫草,属子囊菌门(Ascomycota)虫草菌科(Cordycipitaceae)虫草属(Cordyceps)真菌[1],富含多种天然药理活性成分并具有多种药理作用[2-3]。虫草酸是虫草类真菌的主要有效成分,又名D-甘露醇,化学分子式C7H12O6,为1,3,4,5-四羟基环己酸,具有利尿、抗氧化、预防和治疗脑血栓、脑出血、心肌梗死等功效,虫草酸含量是虫草产品质量评价的指标之一[4]。目前,虫草酸的测定方法有滴定法、旋光法、高效液相色谱法、气相色谱法、分光光度法等[5-8]。分光光度法是测定虫草酸的常用方法之一[9-11],但分光光度法受到比色槽数量限制,单次测定数量少,且操作繁琐,试剂用量大。酶标仪与分光光度计在测定原理上是相同的,即物质在一定波长的吸光度与浓度呈线性关系,且酶标仪可测定样品数量多,一般96个,测定速度快,操作简单,试剂用量少[12-13]。本研究以酶标仪为检测仪器,建立酶标仪微量法,即在96孔板内按照设定反应条件微量加入样品和试剂进行显色反应,最后利用酶标仪测定虫草酸含量,以期提高虫草酸的检测效率,实现样本的高通量检测。
1 材料与方法
1.1 材料
1.1.1 样品 蛹虫草(Cordycepsmilitaris)子实体CM1~CM7为辽宁省微生物科学研究院药用蕈菌实验室栽培获得。
1.1.2 主要试剂与仪器设备 高碘酸钠、乙酸胺、冰醋酸、L-鼠李糖(分析纯,辽宁泉瑞试剂有限公司)。分析天平(PR224ZH/E OHAUS);酶标仪(Multiskan GO 1510,Thermo Fisher);紫外可见分光光度计(UV6000,METASH);96孔微孔板(Corning 3635,美国康宁);恒温水浴锅(HH-4,常州市江南实验仪器厂)。
1.2 方法
1.2.1 蛹虫草子实体虫草酸提取液制备 参考邓黎等[11]的方法:蛹虫草子实体于烘箱内55 ℃干燥,粉碎,过80目筛,料液比1∶30(g/mL,W/V),于90 ℃热水浸提60 min,离心取上清液,沉淀用蒸馏水洗涤两次,离心,合并上清液,定容至50 mL,得到虫草酸待测样品液。
1.2.2 酶标仪测定虫草酸最佳体积的确定 参考蒋永红等[12]的方法(以下称为标准法),分别吸取1 mL质量浓度为0、10、20、30、40、50 mg/L 的甘露醇标准液1 mL至10 mL具塞比色管中,加1 mL 0.05 mol/L高碘酸钠溶液,混匀,室温反应10 min;再加2 mL 0.1%的L-鼠李糖溶液,震荡混匀后加4 mL新配制的Nash试剂53 ℃ 水浴15 min,快速冷却至室温。分别取50、100、150、200、250 μL待测标准液于96孔板中,以相应体积的蒸馏水为空白对照,置于全波长酶标仪中412 nm波长处测定吸光度(OD),以质量浓度为横坐标,OD值为纵坐标,绘制甘露醇不同体积系列标准曲线,并以已知浓度的标准液验证曲线精确度。
1.2.3 酶标仪微量反应体系的确定 按1.2.2标准法,用移液枪向96孔板中分别加入25 μL各浓度标准液,再加入25 μL高碘酸钠溶液,混匀,室温反应10 min,再加50 μL 0.1% 的L-鼠李糖溶液,震荡混匀后加100 μL新配制的Nash试剂,构建200 μL总体积的反应体系,用防水自封袋密封后53 ℃水浴15 min使其呈色,反应结束后4 ℃冰箱预冷2 min,取防水自封袋,全波长酶标仪412 nm波长处测定OD,以质量浓度为横坐标,OD值为纵坐标,绘制微量反应体系下的标准曲线,并对标准法和微量法曲线方程进行比较。
1.2.4 酶标仪微量法水浴时间的确定 将微量反应法中水浴显色时间设定为5、10、12、15、18、20 min,水浴结束后,4 ℃冰箱预冷2 min,全波长酶标仪测定吸光度,比较不同水浴时间对OD值的影响。
1.2.5 酶标仪微量法的方法学考察 ①精密度试验:取样品CM1和CM2的待测液,每个样品重复测6次,酶标仪微量法测定OD值;②重复性试验:分别取浓度为40 mg/L标准液(B40)和CM2的虫草酸样品液各6份,酶标仪微量法测定OD值;③加标回收率试验:设置 6 个实验组,每组加 0.5 mL CM1样品溶液,然后分别加入0、10、20、30、40、50 mg/L虫草酸标准溶液各 0.5 mL,充分混匀后,酶标仪微量法测定OD值,计算回收率。
1.2.6 酶标仪微量法测定蛹虫草子实体中虫草酸含量 取虫草酸待测液用蒸馏水稀释10倍,酶标仪微量法测定虫草酸含量,每个样品3个重复,同时以1.2.2制备的待测液采用分光光度计绘制分光光度法标准曲线,并对虫草酸待测液进行虫草酸含量测定,根据相应标准曲线,计算虫草酸含量,并对酶标仪微量法和分光光度法进行比较分析。
2 结果与分析
2.1 酶标仪测定虫草酸最佳体积的确定
在标准法反应条件下,绘制不同体积甘露醇标准液系列浓度标准曲线(图1),不同体积标准样品的标准曲线相关系数R2值均达到0.986 1以上,且随着待测标准样品体积的增加,同一浓度的样品光密度逐渐增大,标准曲线的斜率也逐渐增大。采用已知质量浓度为40 mg/L的虫草酸标准样品按照1.2.2标准法制备待测液,3次重复。将反应待测液用移液枪分别吸取50、100、150、200、250 μL置于96孔板,在412 nm处采用酶标仪测定OD值,将OD值分别代入相应体积的标准曲线方程,计算虫草酸标准液浓度,结果见表1,对于虫草酸标准样品反应液,当体积为50 μL时,标准差和相对误差均较大,测定结果不准确;当标准样品反应液体积为100~150 μL时,与已知标准样品值相对误差较大,测定结果相对准确;当标准样品反应液体积达到200 μL及以上时,相对误差在1.44%以内,测定结果准确。结合检测灵敏度、准确度及操作便捷性,采用测定体积为200 μL为宜。
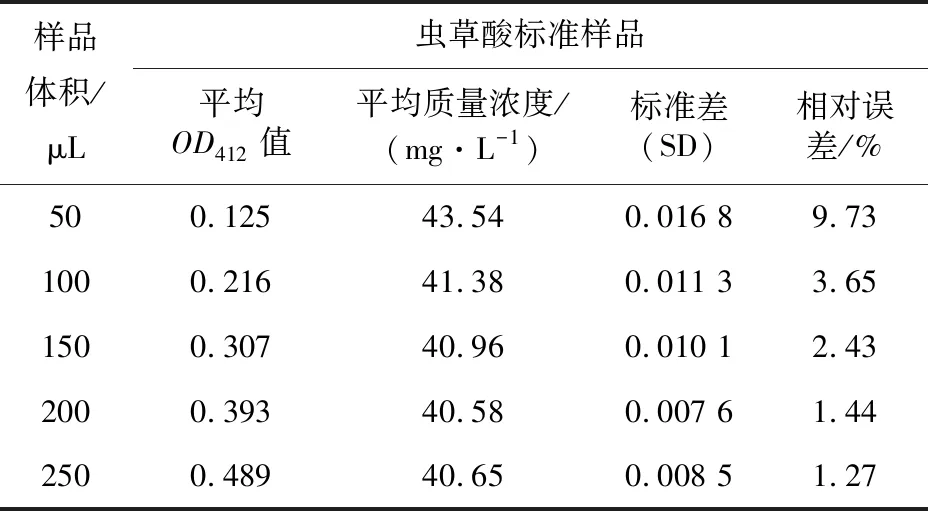
表1 酶标仪比色法不同体积标准样品显色影响Table 1 The effect of the colorimetric method of the microplate reader on the color development of standard samples of different volumes

图1 虫草酸系列体积下的标准曲线方程Fig.1 Standard curve equation under the volume of cordycepic acid series
2.2 酶标仪微量法反应体系的确定
在酶标仪测定标准法基础上,按照标准法操作,在96孔板上以总体积200 μL 检测体积为基准,按照1.2.3方法进行酶标仪微量法甘露醇标准曲线的绘制,同时比较标准法相同体积下不同浓度标准样品的OD值及标准曲线方程。图2结果显示,微量法与标准法在酶标仪下,200 μL 体积下测定的OD值相当,标准曲线方程分别为微量法y=0.008 8x+0.046 2(R2=0.998 7)和标准法y=0.008 6x+0.044(R2= 0.996 6)。两种方法曲线斜率K值基本一致,R2值在0.996 6以上,均具有良好的线性关系,酶标仪微量法测定虫草酸具可行性。

图2 200 μL体积下标准法与微量法的标准曲线方程Fig.2 Standard curve equations of standard method and micro method in 200 μL
2.3 水浴反应时间对测试结果的影响
在酶标仪微量反应过程中,考察水浴时间对OD值的影响,40 mg/L标准样品不同水浴时间OD值结果显示在5~20 min内吸光度值呈先升高后下降趋势,水浴15 min时最高,直至18 min内趋于平稳,20 min时显著降低。对照已知标准样品质量浓度(40 mg/L)与15 min时实际测定样品质量浓度(40.57 mg/L),因此最佳水浴时间设定为15 min(图3)。
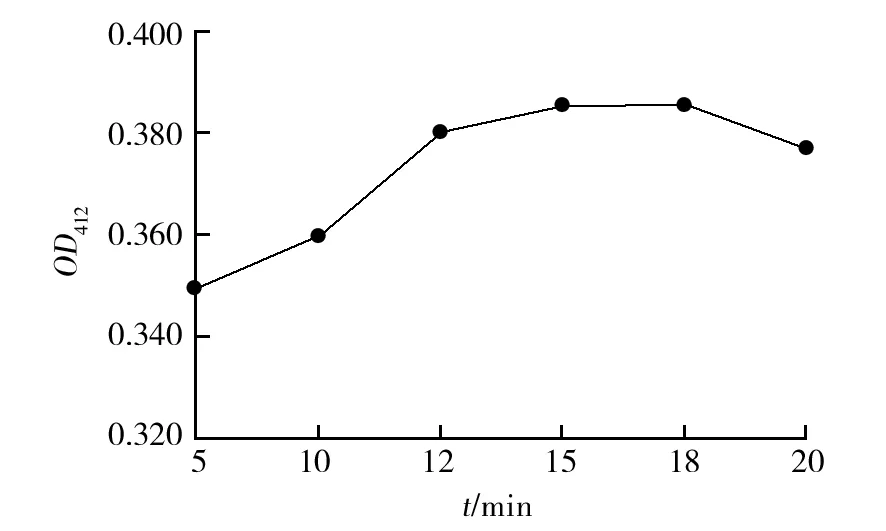
图3 不同水浴时间对OD值的影响Fig.3 The influence of different water bath time on the absorbance OD value
2.4 方法学考察结果
2.4.1 精密度试验 采用酶标仪微量法测定样品CM1和CM2的虫草酸含量,每个样品6次重复,测得的OD值代入曲线方程,计算虫草酸含量,从表2中可看出,每个样品6次测定结果相近,相对标准偏差(RSD)值分别为0.829%和1.772%,说明酶标仪微量法测定结果精密度良好。

表2 精密度试验(n=6)Table 2 Precision test (n=6)
2.4.2 重复性试验 采用酶标仪微量法测定40 mg/L标准样品(B40)和样品CM2中虫草酸含量,每个样品6次重复,测定的OD值,带入曲线方程,计算虫草酸含量,表3显示标准液B40(40 mg/L)和样品CM2的测定结果,RSD值分别为2.061%和1.599%,表明酶标仪微量法测定结果具有较好的重复性。

表3 重复性试验(n=6)Table 3 Repeatability test (n=6)
2.4.3 加标回收试验 在CM1样品中加入不同浓度标准溶液,微量酶标仪法测定6组样品OD值,计算各组的虫草酸含量,进一步计算各组的回收率,结果见表4。6组样品加标回收率实验的平均值为99.24%,RSD值为3.666%,表明酶标仪微量法有较高的回收率,且检测准确度较高。
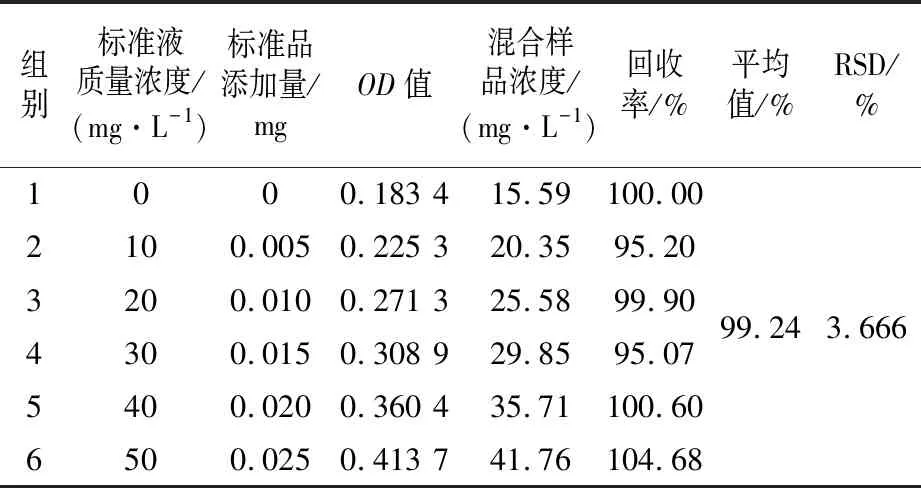
表4 回收率试验(n=6)Table 4 Recovery rate test (n=6)
2.5 酶标仪微量法与分光光度法测定蛹虫草子实体中虫草酸含量的比较
分别采用酶标仪微量法和标准法制备CM1~CM7共7个样品的虫草酸待测液,每个样品3次重复,利用酶标仪和分光光度计对待测样品OD值进行测定,代入相应标准曲线方程,计算虫草酸含量(图4)。结果显示,利用分光光度法和酶标仪微量法测得的相同样品虫草酸含量无显著差异(P>0.05)。采用Origin 8.6软件分别对酶标仪微量法和分光光度法测定的7个蛹虫草子实体样品虫草酸含量结果进行拟合分析,验证两种方法的相关性,相关性分析结果见图5。在统计学上根据相关关系的强弱,将R=7.0看成是一个中等到较高的相关[13],本研究中酶标仪微量法和分光光度法测定结果相关性分析的R=0.993 15,说明两种方法具有较高的正相关性,验证了酶标仪微量法测定虫草酸的准确性。

图4 分光光度法和酶标仪微量法测定虫草酸含量的比较Fig.4 Comparison of cordycepic acid content by spectrophotometry and micro method
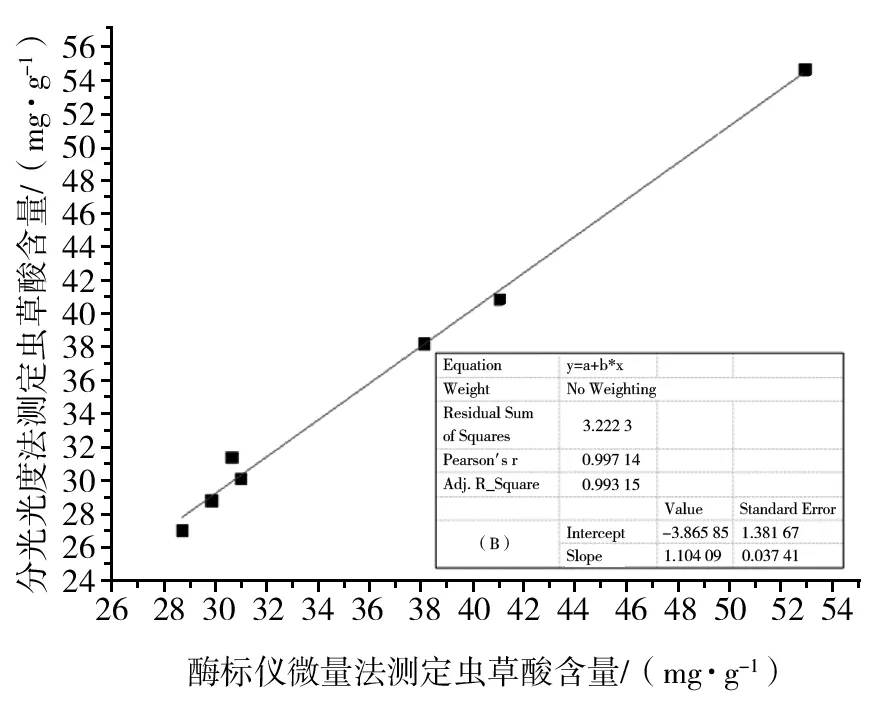
图5 酶标仪微量法与分光光度法测定虫草酸含量相关性分析Fig.5 Correlation analysis of the content of cordycepic acid by micro-reaction method with microplate reader and spectrophotometer method
3 讨 论
虫草酸作为蛹虫草子实体中主要的药理活性物质之一,其含量的多少是评价蛹虫草制品质量的一个重要指标[14-16],目前虫草酸含量的测定主要采用高效液相色谱法和分光光度法,虽然高效液相色谱法在测量准确性和精确度上具有一定优势,但其对仪器设备、试剂纯度及检测人员技术水平要求较高。而分光光度法因其试剂成本低、操作简单、检测准确度较高被广泛接受[17-18]。酶标仪与分光光度计在测定原理上是相同的,即物质在一定波长的OD与浓度呈线性关系,不同在于分光光度计光路为水平,光程固定,加样量不一致对测量结果没有影响,但测定时需样品量大、速度慢、效率低[14]。酶标仪具有96个比色槽,最多可同时对96个样品进行多波段扫描和测定,速度快、效率高,96孔板在酶标仪上1 min之内就可获得OD数据结果,测定上百个样品只需几分钟时间便可完成[19-21],因此相较分光光度计,酶标仪测定相关样品时具有较大优势,已广泛应用于样品检测[22]。因酶标仪光路为垂直,加样量多少直接影响OD值,检测体积的大小直接影响检测的准确性,一般体积太小会造成较大的检测误差[23],本研究对酶标仪检测虫草酸含量的检测体积进行了分析,确定了当标准样品反应液体积达到200 μL及以上时,相对误差在1.44%以内,测定结果准确,以检测体积为200 μL为最优。在此基础上探讨了以96孔板为反应载体的微量样品和试剂添加的反应方法,在200 μL反应体系下,酶标仪微量法与标准方法的OD值和曲线斜率无差异,建立的标准曲线具有高度一致性,验证了酶标仪微量法具较高准确度。为分析酶标仪微量法中水溶时间对OD值的影响,本研究对酶标仪微量法中不同水浴时间影响进行了分析,结果显示水浴时间与OD值具相关性,呈先升高再降低的趋势,水浴时间在15 min时,OD值最大,结果可知反应体系的体积大小对整个反应体系无明显影响,确定水浴最佳时间为15 min。本研究对酶标仪微量法的精密度、重复性和加标回收率等进行了方法学考察,精密度试验中样品CM1的RSD值0.829%,样品CM2的RSD值1.772%显示较高的精密度;重复性实验中40 mg/L的标准样品的RSD值2.061%,样品CM2 的RSD值1.599%,重复性良好、样品平均回收率99.24%,回收率评价RSD值3.666%,回收率较高,本方法检测准确性高。为验证该方法测定虫草酸的准确性,将其测定结果与分光光度法进行了比较及两种方法的相关性分析,结果显示两种方法测定结果无显著差异(P>0.05),同时两种方法具有较强的相关性(R=0.993 15)。
本研究利用酶标仪为检测仪器,在验证酶标仪检测虫草酸含量准确度的基础上,建立酶标仪微量法测定虫草酸含量的方法,即以96孔板为反应载体,通过微量样品和试剂在96孔板内实现显色反应进而测定蛹虫草子实体中虫草酸含量的方法。具体反应条件:移液枪取样品溶液25 μL于96孔板内,加入25 μL高碘酸钠溶液,混匀,室温反应10 min,加入50 μL L-鼠李糖溶液,加100 μL新配制的Nash试剂,96孔板封膜防水后,于53 ℃ 水浴15 min,迅速放入4 ℃冰箱预冷2 min,去掉防水膜后,于全波长酶标仪中测定OD值,并根据相关标准曲线计算所测虫草酸含量。此方法具有较高的精密度、重复性、回收率,表明酶标仪微量法可以替代分光光度法,用于虫草酸含量的测定,此法可大大减少样品试剂的用量,且反应和检测在96孔板内完成,方便、快捷、高效。