肺炎克雷伯氏菌利用甘油生产1,3-PDO发酵优化的研究进展
王世伟,王卿惠,向文胜,李婷婷,赵晨晨,周智强
(1.齐齐哈尔大学生命与农林学院 抗性基因工程与寒地生物多样性保护重点实验室,黑龙江 齐齐哈尔 161005;2.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030)
随着我国经济的高速增长,石油短缺已成为制约经济和社会发展的瓶颈[1]。为了解决这一难题,生物柴油产业应运而生,然而生物柴油生产过程中又必然产生副产物甘油[2],如何处理废弃的甘油成为目前棘手的新问题。粗甘油作为一种廉价碳源,可被微生物转化为有经济价值的化合物,如1,3-丙二醇(1,3-PDO)、乳酸、乙醇、3-羟基丙酸、2,3-丁二醇和琥珀酸。其中1,3-PDO具有开发价值,可作为生产聚酯新产品——聚对苯二甲酸1.3丙二醇酯(PTT)的单体[3-4]。微生物发酵法生产1,3-PDO操作简便,反应温和,副产物少,污染少,且容易处理[5]。肺炎克雷伯氏菌(Klebsiellapneumoniae)是微生物甘油转化的重要菌株。利用肺炎克雷伯氏菌以粗甘油为底物生产1,3-PDO具有广阔的应用前景。
1 产1,3-PDO的微生物
早在1881年,August[6]首次报导梭状芽胞杆菌(Clostridiumpasteurianum)进行甘油发酵能产1,3-PDO,为微生物法生产1,3-PDO 开辟了新途径。微生物发酵法生产1,3-PDO既可利用天然微生物转化底物甘油途径实现,又可以通过重组大肠埃希菌转化葡萄糖途径完成[7-8]。肺炎克雷伯氏菌也是能够高效转化甘油生产1,3-PDO的菌株。
1.1 产1,3-PDO的细菌
经自然分离获得的菌株通常只能以甘油为底物发酵生产1,3-PDO。在厌氧条件下,仅少数兼性厌氧肠细杆菌,如克雷伯氏菌属(Klebsiella)中的肺炎克雷伯氏菌[9]、产酸克雷伯氏菌(Klebsiellaoxytoca)[10];肠杆菌属(Enterobacter),如絮凝肠细杆菌(Enterobacteraggglomean)[11];柠檬酸菌属(Citrobacter),如弗式柠檬酸菌(Citrobacterfreundii)[12]、乌克曼枸橼酸杆菌(Citrobacterwerkmanii)[13];乳酸杆菌属(Lactobacilli),如罗伊氏乳杆菌(Lactobacillusreuteri)[14]以及完全厌氧菌梭菌属(Clostridia),如丁酸梭菌(Clostridiumbutyricum)[15]、巴氏芽胞梭菌(Clostridiumpasteurianum)[16]和糖丁基梭菌(Clostridiumsaccharobutylicum)[17]等可将甘油转化为1,3-PDO。可见,研究微生物发酵特性,阐明肺炎克雷伯氏菌代谢途径,不仅能为菌株选育和改良提供参考,也能为甘油生物转化生产1,3-PDO提供重要菌种资源和应用基础。
1.2 常用产1,3-PDO两种细菌的特点
肺炎克雷伯氏菌与梭状芽胞杆菌(Clostridium)是两种重要的1,3-PDO生产菌,前者对底物甘油和产物1,3-PDO具有很强的耐受性,后者的耐受性较弱。从代谢流量、细胞内酶以及生长状况上看,前者甘油脱水酶(glycerol dehydratase,GDH′t)和丙酮酸激酶(PK)是两个关键酶;后者甘油脱水酶是限速酶;前者在有氧、微氧或厌氧条件下均以甘油为底物快速生长,而后者为典型严格厌氧菌,生长较慢[18-19]。
如表1所示,作为产1,3-PDO的两种重要菌株,肺炎克雷伯氏菌和梭状芽胞杆菌产1,3-PDO的摩尔产率和生产强度均较高。如果在不考虑条件致病菌的前提下,肺炎克雷伯氏菌是发酵法生产1,3-PDO的最理想菌株,通过发酵条件优化提高其1,3-PDO产量,具有十分广阔的前景。

表1 不同微生物菌株发酵产 1,3-PDOTable 1 Microbial production of 1,3-propanediol using different bacteria species
2 肺炎克雷伯氏菌产1,3-PDO的厌氧代谢途径
肺炎克雷伯氏菌产1,3-PDO厌氧代谢途径的阐明是对其进行应用的重要环节。由于肺炎克雷伯氏菌产1,3-PDO的强度、产率均较高,近年来对其厌氧代谢途径、代谢机理、关键酶等已经进行了较为详细的研究,现总结归纳如下作为参考。
2.1 产1,3-PDO的厌氧代谢途径
如图1所示,肺炎克雷伯氏菌厌氧代谢途径中甘油歧化有两条途径,一是生成ATP和还原当量的乙酸/乙醇途径,该途径伴随菌体细胞的生长;二是利用前一途径生成的过量还原型辅酶I,将甘油转化为1,3-PDO,其产率与丙酮酸代谢途径密切相关,该途径对于调节还原当量的平衡起着重要作用。在生物转化中,甘油被转化为1,3-PDO的同时,还生成乙酸、2,3-丁二醇、乙醇或丁酸等副产品;主要副产物为乙酸和乙醇,次要副产物为2,3-丁二醇、乳酸和琥珀酸[25]。如何更有效地使甘油转化为1,3-PDO,减少副产物的积累,是该菌株应用的关键。
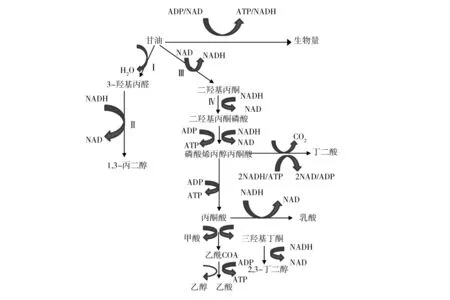
图1 肺炎克雷伯氏菌厌氧代谢相关途径Fig.1 The relatecl anaerobic metabolism pathways of Klebsilla pneumonia
2.2 产1,3-PDO厌氧代谢的重要酶
在厌氧条件下,甘油脱水酶、1,3-PDO氧化还原酶(1,3-propanediol oxidoreductase,PDOR)、甘油脱氢酶(glyceroldehydogenase,GDH)和二羟丙酮激酶(Dihydroxyacetone kinase)四种酶起重要作用。甘油进入细胞后除了为自身生长提供能量和原料外,还经还原和氧化两个途径进行代谢[26]。在还原支路中,甘油进入细胞,部分被甘油脱水酶催化,生成3-羟基丙醛和水,产物3-羟基丙醛再经1,3-PDO氧化还原酶作用,消耗还原力NADH生成终产物1,3-PDO。在限制底物情况下,甘油脱水酶是产物生成的限速酶;当底物过量时,1,3-PDO氧化还原酶是限速酶,生成的3-HPA 抑制细胞生长和代谢[27]。在氧化途径中,另一部分甘油在甘油脱氢酶作用下,转化为二羟基丙酮,后者再经磷酸化脱氢进入丙酮酸代谢途径,生成各种副产物[28]。因此,在1,3-PDO生产中,要合理利用菌株,减少副产物积累,优化工艺设计,提高1,3-PDO产量。
2.2.1 厌氧发酵中的“振荡”现象 在肺炎克雷伯氏菌甘油厌氧连续发酵中,当底物浓度、pH或稀释速率发生变动时,菌体生物量、比生长速率以及副产物生成呈规律性“振荡”。推测“振荡”可能归因于参与代谢的丙酮酸甲酸裂解酶(PFL)和丙酮酸脱氢酶(PDH)作用的不同步性,以及还原当量(NAD/NADH2)的不平衡所致[29]。而且副产物和还原当量通量“振荡”之间存在明显关系。在振荡条件下,受影响的主要是丙酮酸代谢,所有丙酮酸代谢产物的比生成速率差异显著。相反,在振荡期间,底物摄取、ATP生成和直接来自甘油衍生的1,3-PDO或丙酮酸代谢上游衍生产物形成的特定速率几乎不受影响。在振荡和稳态条件下,除了丙酮酸甲酸裂解酶外,其他酶系统同时参与丙酮酸脱羧代谢;而在振荡条件下,这些酶活性都会发生振荡。因此,“振荡”和“滞后”可能是由于底物过量和环境剧变,触发了丙酮酸代谢中酶的调控失调所致[30]。
2.2.2 厌氧发酵中“振荡”的酶学基础 在稳态、振荡和瞬态厌氧连续培养中,对甘油脱氢酶、甘油脱水酶和1,3-PDO氧化还原酶三种酶的体内外活性分析表明,尽管甘油浓度对上述三种酶的体外活性都有负面影响,但对体内活性却有促进作用。在甘油浓度较低的情况下,生长速率显著影响体外和体内酶活性的比率;但在甘油过量的情况下,生长速率不影响酶活性比率。甘油氧化途径流量主要由代谢水平上体内酶活性调节控制,而还原途径流量主要由酶合成控制。高甘油浓度下,甘油脱水酶是甘油消耗和1,3-PDO生成的关键酶,振荡培养中该酶的体外和体内活性都发生“振荡”。菌体生长和产物生成对底物浓度变化十分敏感,这种敏感性是遗传和代谢网络动态变化的结果[31]。可见,阐明代谢网络动态变化与1,3-PDO产量相关性是亟需解决的问题。
2.2.3 1,3-PDO产量与代谢流量变化之间的关系 基因组尺度(Genome scale)代谢网络分析,是从基因组序列出发,结合基因、蛋白质、代谢数据库及实验数据,从系统角度定量研究代谢过程,阐明各个组分之间相互作用的有效方法[32]。为了研究肺炎克雷伯氏菌1,3-PDO产量与代谢途径中流量变化之间的关系,Pan等[33]将基因组尺度流量平衡分析与细胞外代谢物动力学模型相结合,构建了一种基于动态流量平衡分析的方法,扩展了三条新的代谢途径或位点,即在二羟基丙酮(DHA)节点引出的戊糖磷酸途径(PPP),提供更多还原当量;3-磷酸甘油酯(3PG)节点上的合成氨基酸分支;三羧酸(TCA)循环中的α-酮戊二酸位点导出的通向谷氨酸和其他氨基酸合成的代谢途径。通过代谢途径中重要节点动态流量分布与1,3-PDO产率之间的关系分析表明,DHA到PPP动态通量变化和TCA循环中流量变化与1,3-PDO产量均呈正相关。辅助因子四氢叶酸形成反馈环,对氨基酸合成代谢途径中TCA通量变化也有影响。可见,对产1,3-PDO肺炎克雷伯氏菌关键酶的深入研究,也可采用分子生物学技术对关键酶性质做更深入研究。随着代谢网络途径和节点同1,3-PDO产量相关性的阐明,以及甘油代谢途径的拓展,肺炎克雷伯氏菌发酵生产1,3-PDO将发挥更大的优势。
3 产1,3-PDO肺炎克雷伯氏菌的筛选和培养
3.1 产1,3-PDO肺炎克雷伯氏菌的筛选
在筛选产1,3-PDO肺炎克雷伯氏菌时,可采用酸碱度和温度变化的方法进行。Raghunandan等[34]利用M9培养基,设置不同pH和温度条件,使用纯甘油底物,对12株菌进行摇瓶发酵,考察其对底物利用能力,筛选到甘油降解率>80%的菌株SM7,经鉴定为肺炎克雷伯氏菌,该菌最大甘油耐受质量浓度达110 g/L。可见,传统筛选法仍然可行,合理利用能获得优良的菌株。菌株的耐受性一直是人们关注的热点。赵红英[35]通过提高培养基中甘油浓度和平板包埋培养驯化,提高了肺炎克雷伯氏菌甘油耐受力和厌氧生长能力,1,3-PDO发酵终浓度和甘油转化率均有所提高。Wang等[36-37]在研究产腈水合酶红球菌底物耐受性时发现,提高底物丙烯腈浓度的驯化,能获得较高丙烯酰胺产量。通过复合诱变和双亲灭活原生质体融合,可有效改良菌株。可见,在筛选产1,3-PDO肺炎克雷伯氏菌时,为了提高菌株的底物耐受性也可以借鉴传统的筛选方式和菌种选育策略。Ma等[38]在肺炎克雷伯氏菌2e分批发酵粗甘油转化1,3-PDO时发现,粗甘油及其主要杂质对该菌生长、关键酶活性和1,3-PDO几乎无影响。该菌含30个与甘油无氧代谢及1,3-PDO合成相关基因。实时定量PCR分析表明,与纯甘油相比,在粗甘油中编码甘油代谢和1,3-PDO生物合成关键酶的多数基因显著上调。该菌株存在一种新甘油摄取促进蛋白,比其他肺炎克雷伯氏菌应激反应蛋白数量更多。可见,获得耐受粗甘油的肺炎克雷伯氏菌,并对甘油耐受性分子机制进行研究,不但能提高1,3-PDO产量,而且对基因工程菌株构建,优化代谢途径都有理论和应用价值。
3.2 产1,3-PDO肺炎克雷伯氏菌的培养优化
对培养基和培养条件进行优化是提高1,3-PDO产量的常用方法。Supaporn等[39]采用统计学方法,推导出甘油、(NH4)2SO4、微量元素、pH值和培养时间等因子对1,3-PDO浓度、产量、选择性和生产力等单一效应和交互效应的统计学模型,确定了产1,3-PDO的最佳条件。Hiremath等[40]对肺炎克雷伯氏菌ATCC15380利用麻疯树生物柴油产生的粗甘油为底物生产1,3-PDO反应条件进行优化,优化后的1,3-PDO产量高达56 g/L,甘油转化率达0.85 mol/mol。Rosarin等[41]采用常规方法,研究了表达融合蛋白的新型重组大肠埃希菌BP41Y3,优化了生产1,3-PDO的环境和营养条件。在10个营养变量中,选择富马酸盐、(NH4)2HPO4和蛋白胨,研究它们之间的交互作用,获得最佳培养基。通过厌氧培养24 h后,“振荡”最大质量浓度为11.92 g/L。可见,利用统计学、采用响应面等方法对培养基成分和条件进行优化,仍然是常规有效的方法。
4 影响肺炎克雷伯氏菌产1,3-PDO的因素
4.1 氧气对肺炎克雷伯氏菌产1,3-PDO的影响
肺炎克雷伯氏菌属于兼性厌氧菌。作为重要发酵参数的氧气,对菌株发酵生产1,3-PDO具有重要影响。在低、中、高甘油浓度下,Wang等[42]在厌氧和有氧条件下,研究了肺炎克雷伯氏菌连续发酵生产1,3-PDO。在有氧高甘油浓度发酵条件下(通气量为0.04 vvm),1,3-PDO随甘油浓度增加而增加,最高可达266 mmol/L(此时甘油浓度达760 mmol/L)。然而,在厌氧条件下,随着甘油浓度增加,1,3-PDO产率却逐渐降低;在较低甘油浓度条件下(270 mmol/L),1,3-PDO最高产率为520 mmol/L。在高甘油浓度条件下进行有氧发酵,甘油脱水酶比活性最高为0.04 U/mg。在实验设置的所有甘油浓度和有氧条件下,甘油脱氢酶和1,3-PDO氧化还原酶的比活性都有所提高,这意味着在微需氧条件下dha操纵子不会受到抑制。随着甘油浓度增加,更多碳通量转移到氧化途径,导致1,3-PDO生成通量降低,该途径氧化分支中碳通量增加并不均匀分布。Chen等[43]研究了肺炎克雷伯氏菌在微需氧条件下分批发酵,发酵结束时,产生的乙醇比厌氧条件下少,间歇微需氧发酵时间明显短于厌氧发酵,导致1,3-PDO产率增加。Liu等[44]在微需氧条件下,利用肺炎克雷伯氏菌,以甘油为原料生产1,3-PDO,补料分批发酵工艺的发酵罐体积已成功扩大到1 m3。在微需氧条件下,1,3-PDO的最终浓度和产率(72 g/L ~2.1 g/(L·h))与厌氧条件下相近。可见,研究不同氧气环境对发酵的影响,应该有针对性地设计1,3-PDO生产发酵工艺。Ma等[45]在不同曝气方式下,研究了肺炎克雷伯氏菌XJPD-Li分批发酵甘油转化,发现1,3-PDO产量和产率分别呈“厌氧条件﹥无曝气条件﹥好氧条件”的规律减少。在好氧条件下,甘油对1,3-PDO产率最低,但生物量最高。在补料分批培养中,就1,3-PDO产量而言,好氧条件﹥厌氧条件﹥无曝气条件;就产率而言,厌氧条件﹥好氧条件﹥无曝气条件。三种条件下,在最初12 h内,1,3-PDO产量均较好。可见,发酵形式不同,获得的1,3-PDO最终浓度和产率也不同。因此应根据不同需要,采取不同的氧气控制的发酵形式。
4.2 pH对肺炎克雷伯氏菌产1,3-PDO的影响
Ji等[46]在不同分批发酵条件下进行pH静态补料分批发酵研究,发现副产物2,3-丁二醇和乳酸产量与pH值密切相关,发酵结束时副产物和残余甘油浓度较高,不利于1,3-PDO产生。pH值为5.0~6.5时,主要副产物为2,3-丁二醇,而在pH值7.1~8.0时,主要副产物为乳酸,说明菌体产生了自我保护机制,在环境pH值变化时,菌体细胞会对代谢途径进行更改。采用周期性pH值波动(6.3~7.3)投喂策略,在pH周期性低或高胁迫下,2,3-丁二醇和乳酸代谢途径处于亚活跃状态,采用该种分批补料策略,实现了1,3-PDO高效生产(质量浓度达70 g/L,每摩尔甘油获得0.700 毫摩尔1,3-PDO,产率达 0.97g/(L·h),两个主要副产物和残甘油浓度均较低。pH是影响发酵的一个重要参数,对pH的合理调控就可达到增加生成量,减少副积累的目的。Petrov等[47]研究发现,采用“强制pH波动”分批发酵,以一定ΔpH(振幅范围1.0~2.0)连续升高pH值,不仅可提高肺炎克雷伯氏菌的1,3-PDO产量,而且产生副产品较少。方法是按照ΔpH=1.0的增加量,每隔3 h增加一次pH。与相应进料批次(恒定pH=7.0)发酵相比,1,3-PDO最高增加10%;副产物显著减少。可见,掌握周期性变化规律,遵循pH的周期性规律,能提高1,3-PDO产量。
4.3 底物和产物对肺炎克雷伯氏菌产1,3-PDO的影响
4.3.1 底物甘油对产1,3-PDO的影响 为了使发酵过程稳定、重复性好,可精确控制底物甘油的投料来提高1,3-PDO产量。Huang等[48]设计了一种基于发酵动力学的甘油自动进料策略,采用转基因肺炎克雷伯氏菌LDH526,以甘油为唯一碳源,使1,3-PDO生产质量浓度﹥90 g/L。将底物投料速率与pH、发酵时间等变量耦合,进行甘油自启动投料和甘油浓度动态控制,72 h后1,3-PDO最终质量浓度﹥95 g/L。可见,利用自动化技术准确地进行底物的投放,可有效提高1,3-PDO产量。
4.3.2 辅助底物对产1,3-PDO的影响 除了甘油底物,添加辅助底物进行共底物生产1,3-PDO是一种改良的新方法。添加半纤维素水解物,能使菌株获得更多的生物量和还原力,从而提高1,3-PDO产量。Jin等[49]发现,木糖和甘露糖能促进1,3-PDO产生和细胞生长;低浓度糠醛和醋酸钠能促进菌体生长和1,3-PDO、乙酸盐生成。以半纤维素水解物为共底物的补料分批发酵,最终1,3-PDO产量、甘油转化率和生产率比单一底物甘油发酵均有所提高。NADH消耗量是调节还原当量平衡的关键,甘油和木糖共发酵可提高1,3-PDO还原当量。Jin等[50]添加木糖作为共底物,发现可产生更多还原当量,提高细胞生长速度。在微需氧分批发酵中,共发酵相关的1,3-PDO浓度、甘油转化率和生物量都有提高。陈琳等[51]研究表明,肺炎克雷伯氏肺杆菌经过磷酸戊糖途径可利用D-木糖为菌体代谢提供大量还原力,促进1,3-PDO的合成。在以木糖作为辅助底物的微氧批次补料发酵中,1,3-PDO质量浓度、甘油转化率及产量均明显提高。吴家鑫等[52]研究了辅助碳源蔗糖与葡萄糖对重组肺炎克雷伯氏菌批式发酵生产1,3-PDO的影响。对发酵工艺进行放大,并优化流加策略,发现葡萄糖作为辅助碳源优于蔗糖。以葡萄糖为辅助碳源,采用指数流加策略,30 L发酵罐中1,3-PDO的产量显著提高。可见,共底物发酵比甘油单一底物发酵能显著提高1,3-PDO产量。
4.3.3 产物对1,3-PDO生成的影响 不同代谢产物对1,3-PDO生产影响不同。Barbirato等[53]发现,无论初始甘油含量如何,聚团肠杆菌甘油发酵在消耗大约430 mmol/L甘油后会产生3-羟基丙醛,阻止了菌体生长和产物1,3-PDO生成。经质子核磁共振证实3-羟基丙醛对菌体生长具有抑制作用。Lin等[54]发现,在肺炎克雷伯氏菌培养液中添加5 mmol/L延胡索酸,甘油消耗率和1,3-PDO生成均有提高;同时,NAD+与NADH比值下降。Zhong等[55]研究了乳酸和3-羟基丙醛对肺炎克雷伯氏菌发酵产1,3-PDO的影响,发现它们对正常和乳酸途径缺陷菌株生产1,3-PDO均有影响。直接抑制1,3-PDO产生的原因是3-羟基丙醛的早期积累,而非发酵后期产生的乳酸。通过减少发酵初期3-羟基丙醛的积累,1,3-PDO浓度和产率分别比初始实验水平提高了18%和16%。可见,正是由于3-羟基丙醛的早期积累,而非发酵后期乳酸积累,才导致了1,3-PDO最终浓度的降低。刘龙飞等[56]分析了产乳酸和2,3-丁二醇途径基因敲除菌的乳酸代谢特性,结果发现,前期添加乳酸能使1,3-PDO产量迅速降低;而发酵10 h后添加乳酸,几乎对1,3-PDO的生产无抑制作用。乳酸敲除菌株发酵后期能够消耗培养基中的乳酸,对乳酸具有耐受性。副产物2,3-丁二醇基因工程敲除菌前期乳酸过早积累被解除后,1,3-PDO的产量大幅度提高。可见,分析代谢途径中导致1,3-PDO产量下降的真正原因,然后适当删除或过表达副产物产生的关键酶基因,构建基因工程菌株有望提高1,3-PDO产量;了解乳酸在发酵过程中的变化规律,不但有利于工艺的合理设计,而且也有利于对基因工程菌株的构建提供科学指导。
4.4 盐对菌体产1,3-PDO的影响
无机盐是培养基的重要成分。Xu等[57]发现在低盐浓度下,细胞生长和产物形成率较高;高盐浓度下细胞生长缓慢,1,3-PDO最终浓度、甘油的1,3-PDO转化率以及1,3-PDO氧化还原酶活性均有所降低。李莉莉等[58]发现在肺炎克雷伯氏菌(HSL4)发酵生产1,3-PDO的培养基中,磷酸盐对发酵过程影响较大。利用5 L发酵罐进行补料发酵,在培养基中高、低初始磷酸根浓度条件下,1,3-PDO终质量浓度均在75 g/L左右。在低磷条件下,底物甘油消耗量较少,1,3-PDO转化率较高;除2,3-丁二醇外,其他副产物积累均比高磷条件下少。高磷促进乙酸、乙醇、乳酸等副产物生成,且改变中、后期发酵环境,增加下游分离提取1,3-PDO压力。Zheng等[59]采用含有过量甘油的铵和磷酸盐限制的恒化培养基,研究了肺炎克雷伯氏菌1,3-PDO生产。结果发现,在限氨和限磷酸盐培养基中,大约50%分解代谢通量直接作用于1,3-PDO合成。在36 h内,限氨分批培养产生的1,3-PDO明显高于有机酸产量。但是,限磷酸盐分批培养产生1,3-PDO小于乳酸产量。可见,在肺炎克雷伯氏菌甘油发酵生产1,3-PDO过程中,要控制培养基中无机盐的种类和含量。
5 肺炎克雷伯氏菌产1,3-PDO的工程技术策略
5.1 单一辅因子工程和多模块工程策略
单一辅因子策略能提高1,3-PDO和2,3-丙二醇的产量。Wang 等[60]采用辅因子工程策略,构建糖酵解中具有较高NAD(P)H再生率的ED途径和转氢化酶为基础的NADH再生体系,通过调节细胞内NADH/NAD+比值,利用葡萄糖和甘油混合物提高1,3-PDO和2,3-丙二醇浓度。NADH/NAD+比值提高能影响中枢碳途径基因转录水平和细胞生长。构建后菌体NADH/NAD+比值比原始菌丙二醇质量浓度增加到110.8 g/L,增加了92.8%;摩尔产率和生产强度分别增加到0.78 mol/mol和3.46 g/(L·h)。联合使用若干策略,形成叠加效应能更好地提高1,3-PDO的产量。Wang等[61]利用多模块工程技术,提高了肺炎克雷伯氏菌1,3-PDO产量和耐受性。首先采用集中在甘油途径进化,使1,3-PDO产量增加25%,副产物显著降低,1,3-PDO耐受性提高到150 g/L;接着对共底物转运体系进行调控,突变体1,3-PDO浓度、产量和产率进一步提高(分别达到76.4 g/L、0.53 mol/mol、2.55 g/(L·h));最后引入NADH再生体系,重组菌株获得了最高的1,3-PDO产量、摩尔产率和生产强度(86 g/L、0.59 mol/mol、2.69 g/(L·h))。可见,不同模块组合不断升级,可一步步增加1,3-PDO产量,比单一模块工程更有潜力。
5.2 采用集成建模预测和优化策略
动力学模型固有的不确定性限制了其产物的预测能力。利用数学模型和计算机模拟优化是目标产物形成的优化策略。Pan等[62]以甘油为底物,对肺炎克雷伯氏菌产1,3-PDO产量提高进行了优化,采用集成建模技术降低了模型对发酵过程的不确定性,提高了其预测性能。①通过灵敏度分析,确定了对模型有显著影响的参数作为集成建模可调参数。②确定合适模型误差阈值系数,并采用抽样方法生成尽可能多的等效参数集。③每一组参数分别应用于模拟,并将所有预测值整合为加权平均值,得到预测期望值。与传统单参数模拟相比,集成建模预测值与实验值相对误差小,模型预测性能显著提高,获得了1,3-PDO最佳产率和收率。集成建模补偿了模型不确定性,预测更准确。
5.3 采用肺炎克雷伯氏菌产1,3-PDO的生产监测策略
5.3.1 化学计量学模型和荧光光谱技术优化产1,3-PDO的监测 Rossi等[63]应用化学计量学模型和荧光光谱技术,监测了肺炎克雷伯氏菌在不同通气条件下的代谢过程。在需氧和厌氧条件下,将多波长荧光技术应用于培养过程参数在线监测,观察到光谱差异可反映细胞代谢不同的状态。为了预测生物量、甘油和1,3-PDO等工艺变量,根据连续测量荧光光谱建立了化学计量模型。虽然甘油和1,3-PDO不是荧光化合物,但可作为变量应用于在线监测代谢过程以提高1,3-PDO产量。
5.3.2 ORP监测优化1,3-PDO生产 细胞外氧化还原电位(ORP)可作为科学监测指标。Du等[64]在分批发酵过程中,利用ORP监测肺炎克雷伯氏菌1,3-PDO生产。研究发现-190 mV的ORP水平下,细胞生长快,1,3-PDO浓度较高。测定了不同ORP水平下NAD+/NADH比值,确定NAD+/NADH比值关键点为4,将大于这一关键点的发酵环境设为相对氧化环境,反之为相对还原环境。在氧化环境中1,3-PDO产率和比生长速率均高。Du等[65]也提出了基于ORP的突变体筛选新方法。具体步骤:①确定野生型菌株生长和生产1,3-PDO的首选ORP范围;②将化学诱变培养物置于对野生型菌株有害的低ORP水平内;③选择在有害ORP水平下表现出高比生长率的菌落,并研究其产生1,3-PDO能力。当ORP控制在-280 mV,从11个分离菌株中筛选出4个阳性突变株。补料分批发酵中,突变体首选ORP水平(-280 mV)显著低于其亲本(-190 mV)。突变体细胞内还原通量增强,促进了1,3-PDO的生成。可见,充分利用ORP监测特点和规律或通过ORP筛选突变菌可有效获得高产突变菌株,有效提高1,3-PDO产量。
6 展 望
生物柴油在全球大规模生产,给其副产物甘油的利用带来了挑战。与化学合成法相比,微生物法可有效利用剩余的甘油副产物生产1,3-PDO,具有明显的优势,微生物法也有助于解决甘油过剩带来的环境污染问题,并有利于生物柴油行业的可持续发展。随着发酵工艺研究的进展,对甘油生物转化过程的代谢途径、动力学特征和动态行为的认识逐渐深入,今后一方面要通过控制培养条件改变代谢途径,在保持高转化率的情况下提高1,3-PDO浓度和生产强度;进一步优化甘油或辅助底物代谢中还原当量的分布和平衡,减少副产物的积累和抑制作用,提高 1,3-PDO产率和浓度;另一方面要重视通过基因工程、蛋白质工程和代谢网络工程等方法构建优良工程菌株,阐明更多的代谢途径和相关机理,为1,3-PDO的产生开辟新途径。相信微生物发酵法在生物技术领域生产1,3-PDO将成为新范例。