耐高温木质素降解菌筛选及降解效果研究
郭玲玲,江志阳,陶姝宇,于 淼,朱晓琳,陈丽媛
(1.辽宁省微生物科学研究院,辽宁 朝阳 122000;2.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016;3.辽宁省农业发展服务中心,辽宁 沈阳 110032;4.辽宁恒润农业有限公司,辽宁 鞍山 114000)
木质素是一种天然有机高分子聚合物,广泛存在于高等植物细胞壁中,具有溶解性差、难以被酸水解等特点,主要因其分子结构和化学性质较为复杂,含多种稳定的复杂键型,却不含易水解而重复的单元[1]。同时,木质素在细胞壁中对纤维素等起到保护作用,木质素的降解和半纤维素、纤维素的降解有着密切关联[2-3]。菌糠和秸秆中的木质纤维素含量高却降解困难,成为此类农业废弃物有效开发利用的主要限制因素。因此,关于降解木质素的微生物相关研究逐渐成为关注热点。目前木质素降解菌的研究多集中于中低温菌,但在菌糠和秸秆等农业废弃物高温堆肥等特殊环境中此类菌株容易失活,其木质素降解效果随之受到很大影响[4]。因此,筛选高温耐受性高效木质素降解菌具有重要意义。自然界中木质素的降解主要依靠微生物完成,其中真菌研究最多,主要有原孢厚毛平革菌(PhanerochaetechrysosporiumBurdsall)、白腐真菌、褐腐真菌、毛革盖菌(Stereumhirsutum(willd.:Fr.S.F.Gray))、东方栓菌(Trametesorientalis(Yasuda)lmaz.)等[5-10]。但大多木质素降解真菌的研究仅停留在试验阶段,能够应用于生产的菌株实际效果都不够理想。与真菌相比,细菌生长迅速、适应性强、来源广泛、资源利用效率高,将细菌应用于木质素降解领域的研究值得深入探讨。本研究从育苗基质中筛选到了一株耐高温木质素降解菌,结合菌株形态、生理生化及分子测定结果,筛选菌株HZ11为解淀粉芽胞杆菌(Bacillusamyloliquefaciens),并对其进行了秸秆木质素和菌糠木质素降解效果的研究,降解率分别达到46.7%和 42.4%。本研究对于补充木质素降解菌种资源库、丰富解淀粉芽胞杆菌特性研究数据以及农业废弃物资源化有效利用具有重要的参考意义。
1 材料与方法
1.1 材料
1.1.1 供试样品 菌种筛选用样品粉采自辽宁土木启生物科技有限公司,在菌糠、秸秆、牛粪等堆腐生产育苗基质堆高温阶段采集样品粉,放入灭菌袋中带回实验室;玉米秸秆采自辽宁省凌源市三道河子金茂农业有限公司种植基地,用清水洗净玉米秸秆,65 ℃烘干后粉碎过 40 目筛,得秸秆粉,121 ℃灭菌 30 min后,密封保存备用。
1.1.2 培养基 ①富集培养基:MgSO40.2 g,Na2HPO41.5 g,(NH4)2SO42.0 g,CaCl22.0 g,KH2PO41.5 g,玉米秸秆粉10.0 g,蒸馏水定容至1 L,pH自然。②初筛固体培养基:碱性木素2.0 g,MgSO40.5 g,Na2HPO40.2 g,KH2PO41.0 g,NH4NO31.33 g,琼脂20 g,蒸馏水定容至1 L。③NA培养基:蛋白胨 10.0 g,牛肉膏 5.0 g,NaCl 5.0 g,琼脂20.0 g,蒸馏水定容至1 L,pH 7.2~7.4。④LB液体培养基:酵母浸膏5.0 g,牛肉浸膏 5.0 g,鱼粉蛋白胨 10.0 g,NaCl 5.0 g,蒸馏水定容至1 L,pH 7.0~7.2。⑤LB 固体培养基:液体培养基加入琼脂粉18.0 g。⑥苯胺蓝培养基:100 mL固体LB培养基中加苯胺蓝0.1 g。⑦复筛液体培养基:大豆蛋白胨20.0 g,玉米粉20.0 g,CaCl20.2 g,MgSO40.3 g,Na2HPO42.0 g,NaH2PO41.0 g,蒸馏水定容至1 L,pH 7.0。⑧无机盐溶液:(NH4)2SO43 g,NaCl 0.5 g,KH2PO41 g,MgSO40.5 g,FeSO4·7H2O 0.01 g,CaCl20.3 g,ZnSO4·7H2O 0.015 g,MnSO4·7H2O 0.015 g,CoCl20.01 g,蒸馏水定容至 1 L。⑨秸秆固态发酵培养基:将无机盐溶液 6 mL加入到250 mL 三角瓶中,称取2.0 g 秸秆粉加入装有上述溶液的三角瓶中。⑩菌糠固态发酵培养基:称取过40目筛的菌糠粉2.0 g,其他条件同秸秆固态发酵培养基制作过程。
1.1.3 主要试剂与仪器设备 藜芦醇、硫酸锰、硫酸镁、氯化钠、苯胺蓝、氯化钙(分析纯)。超净工作台(VS-1300L-U,苏州安泰);紫外可见分光光度计(T6新悦,北京普析通用仪器有限责任公司);恒温摇床(SPH2102,上海世平);高压灭菌锅(LD2F-75L,上海申安);高速离心机(Hico21,上海生工);电热鼓风干燥箱(101-2BS,天津宏诺);马弗炉(上海唐河实业发展有限公司);电子天平(ME104E,上海梅特勒-托利多);生化培养箱(SPX-450,北京中仪国科)。
1.2 方法
1.2.1 耐高温木质素降解菌的富集 称取实验室保存的菌种筛选用样品粉10 g于锥形瓶中,加入100 mL富集培养基溶液,100 r/min、35 ℃培养6 d。
1.2.2 木质素降解菌的初筛 用移液枪吸取1 mL锥形瓶中的上清液于9 mL无菌水试管中,充分摇匀后获得10-1稀释液,按上述方法制得10-2~10-7稀释液。吸取 10-3~10-7稀释液各100 μL涂布于以碱性木素为唯一碳源的初筛固体培养基平板上,每一稀释梯度3 次重复,35 ℃恒温培养3 d。在相同条件下,分别挑取不同的菌落划线培养,做3组平行试验,直至菌落形态一致完成菌株纯化,4 ℃条件下LB试管培养基内保存待用。
1.2.3 木质素降解菌的复筛 ①脱色圈试验方法:初筛菌种接种到苯胺蓝培养基,35 ℃避光培养5 d,测定蓝色培养基中菌落的脱色圈大小。②菌种活化和粗酶液提取:将纯化保存待用菌株扩培,35 ℃、NA 培养基活化菌株24 h,活化菌株接种至复筛液体培养基,35 ℃培养48 h后,4 ℃、5 000 r/min 离心8 min,吸取上清液为粗酶液。③木质素过氧化物酶活力测定:采用藜芦醇法。加入1.0 mL 125 mmol/L、pH 3.0的酒石酸钠缓冲液,0.2 mL 10 mmol/L 藜芦醇,加入500 μL粗酶液,再加入500 μL 2 mmol/L的 H2O2溶液启动,30 ℃水浴3 min,310 nm处测定吸光度值。以每分钟每毫升粗酶液降低 0.1 个OD值表示一个酶活力单位。④锰过氧化物酶活力测定:采用MnSO4法。加入3.4 mL 50 mmol/L、pH 4.5的乳酸钠缓冲液,0.1 mL 1.6 mmol/L的 MnSO4溶液,加入0.4 mL粗酶液,再加入0.1 mL 1.6 mmol/L的 H2O2溶液启动,37 ℃水浴3 min,240 nm处测定吸光度,每分钟吸光值增加 0.1的酶量表示一个酶活力单位。
1.2.4 菌株分类鉴定 ①菌落和菌体形态观察:观察NA培养基上单菌落的光泽度、透明度、颜色、大小、形态、隆起形状、边缘特征等,挑取单菌落进行革兰染色后,置于光学显微镜下观察菌体形态。②生理生化特性测定:分别对菌株进行硝酸盐还原、甲基红、吲哚试验、脲酶试验、淀粉水解、明胶液化、过氧化氢酶、纤维素分解、葡萄糖发酵、甘露醇发酵等试验,并试验菌膜形成和固氮能力,每个处理3次重复。形态学特征和生理生化特性测定参照《伯杰细菌鉴定手册》(第8版)、《常见细菌系统鉴定手册》进行[11-12]。③分子鉴定:采用DNA提取试剂盒提取菌株的DNA,采用琼脂糖凝胶电泳法分析DNA的纯度。以菌株基因组为模板,选取16S rDNA扩增的通用引物进行PCR扩增,PCR 反应体系(25 μL):2×SanTaqPCR Mix 12.5 μL,27F (25 μmol/L) 1 μL,1492R (50 μmol/L) 1 μL,DNA 模板(10 mmol/L) 1 μL,ddH2O 9.5 μL。PCR 反应条件:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 2 min,循环35 次;终延伸72 ℃ 10 min。扩增及测序工作均由宝生物工程有限公司完成。将测得的序列在NCBI(https://www.ncbi.nlm.nih.gov/)数据库中进行BLAST序列比对,并与已报道细菌菌株的16S rDNA序列同源性比较,并构建分析菌株系统发育进化树。
1.2.5 菌株木质素降解效果验证 取1支已培养好的菌种斜面,加入无菌水5 mL,轻轻刮下琼脂表面菌体,将该菌体制成悬浮液并置于已灭菌预先放置玻璃珠的50 mL三角瓶中,充分振摇,用无菌水调整菌体浓度,最终菌体活菌数达到107cfu/mL。分别吸取上述悬浮液1 mL接种到秸秆固态发酵培养基、菌糠固态发酵培养基中,以不接菌种为对照,每个处理3次重复,50 ℃培养20 d,65 ℃烘干至恒重,分别计算木质素降解率。木质素含量测定:将干净的坩埚放入马弗炉中,(575±25) ℃灼烧至少4 h。灼烧结束后,冷却称重。相同条件再次灼烧1 h后冷却称重。重复操作直至坩埚质量差前后两次小于0.3 mg,记录此时坩埚的重量为M1。称量300 mg烘干的检测样品粉加入到锥形瓶中,再加入72%的硫酸溶液3 mL混匀,30 ℃水浴 60 min,期间缓慢搅拌,5 min 一次。水浴结束后,向瓶内加入去离子水并缓慢摇匀,使硫酸的浓度为4%。密封锥形瓶后121 ℃湿热灭菌1 h。将冷却后锥形瓶中的液体倒入坩埚中真空抽滤,滤液备用。坩埚内剩余固体物质用去离子水冲洗,坩埚和固体物质80 ℃烘干5 h后冷却称重。重复操作直至坩埚质量差前后两次小于0.3 mg,记录坩埚和残留物重量为M2。将坩埚和固体物质放入马弗炉灼烧30 h,冷却后称量坩埚与里面灰分的重量为M3。酸不溶木质素(%)=((M1-M2)/M)×100%,灰分(%)=((M3-M1)/M)×100%。式中,M:检测样品粉的重量(mg);M1:坩埚的重量(mg);M2:坩埚和残留物的重量(mg);M3:坩埚和灰分的重量(mg)。酸溶木质素(%)=((A×B×D)/(ε×d×M))×100%。式中,A:吸光度;B:水解液;D:用4%的硫酸溶液稀释两倍(D=2);ε:320 nm下检测样品粉的吸收系数(ε=30 mL/mg·cm);d:紫外可见分光光度计吸收池光程长(d=1 cm)。木质素降解率(%)=((C1-C2)/C1)×100%。式中,C1为对照木质素质量;C2为加菌体悬液木质素质量。
2 结果与分析
2.1 耐高温木质素降解菌筛选结果
从样品粉中初筛得到木质素降解菌20株,通过对苯胺蓝脱色圈观察,选取其中褪色效果明显的菌种6株,测定其上清液木质素过氧化物酶、锰过氧化物酶活力,结果表明,菌株HZ11脱色圈直径达30.5 mm,木质素过氧化物酶和锰过氧化物酶活力分别达到90.62和50.88 U/mL,酶活力明显高于其他菌株,作为接下来进行研究的优势菌种。

表1 不同菌株脱色圈直径比较Table 1 Comparison of transparent ring diameters of different strain
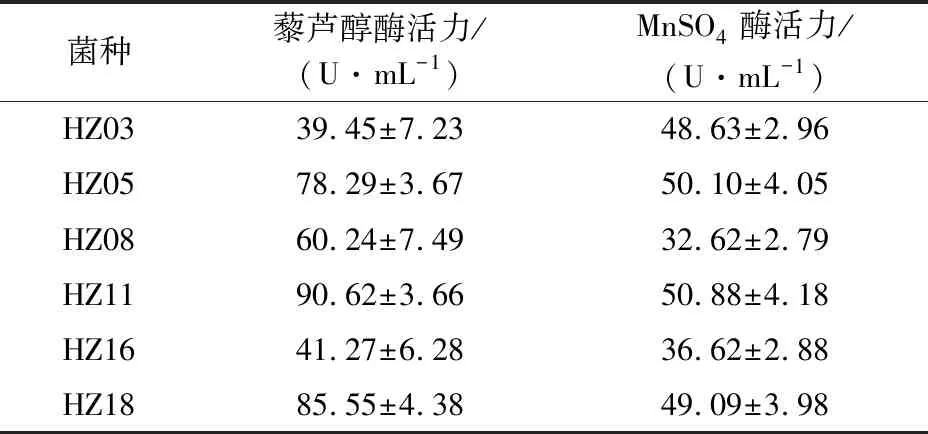
表2 不同菌株木质素降解酶活力检测结果Table 2 Detection results of lignin degradable enzymes capacity of different strains
2.2 菌株HZ11鉴定
2.2.1 菌株HZ11的形态学及生理生化特征 图1、图2所示菌落和菌体细胞形态,菌株HZ11在NA 培养基上的菌落特征:雪花状、纯白色、无光泽、不透明、表面干燥、有大量褶皱、外缘不规则。显微镜下革兰染色观察阳性、菌体较小、呈杆状,有芽胞。菌株HZ11生理生化特征检测结果如表3所示。

表3 菌株HZ11的生理生化特征Table 3 Physiological and biochemical characteristics of strain HZ11

图1 菌株HZ11菌落形态Fig.1 Colony morphology of strain HZ11
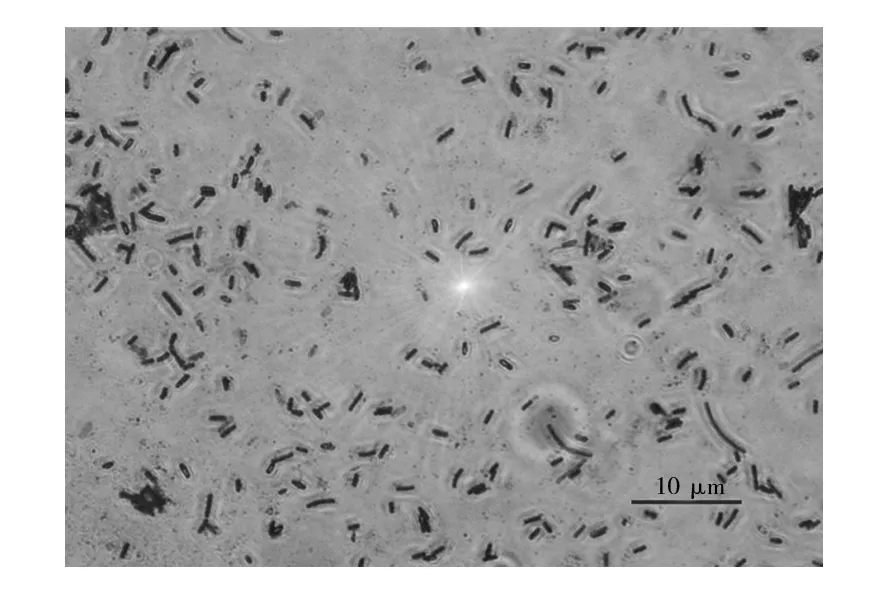
图2 菌株HZ11细胞形态 Fig.2 Cell morphology of strain HZ11
2.2.2 16S rDNA序列测定分析与系统发育进化树构建 登陆NCBI网站,将测出的序列通过16S rDNA序列同源性比较,进行BLAST在线分析。菌株HZ11(编号JZ18562)与解淀粉芽胞杆菌的16S rDNA 序列同源性达到100%。从GenBank中选择序列相似菌株,应用Bioedit 7.0和Mega软件进行多重比较后构建系统发育树(图3),鉴定菌株HZ11为解淀粉芽胞杆菌(Bacillusamyloliquefaciens)。

图3 菌株HZ11的16S rDNA系统发育进化树Fig.3 Phylogenetic tree of 16S rDNA of strain HZ11
2.2.3 菌株HZ11木质素降解能力测试结果 分别将菌株HZ11加入到秸秆固态发酵培养基和菌糠固态发酵培养基,50 ℃培养20 d,以未接菌的秸秆和菌糠为对照,测试菌株对秸秆和菌糠木质素的降解效果。表4结果表明,加入菌株HZ11的秸秆和菌糠培养基质木质素质量明显降低,与对照组比较差异达显著水平;玉米秸秆木质素降解率46.7%,菌糠木质素降解率42.4%,表明菌株HZ11对秸秆和菌糠木质素均有较好的降解作用。
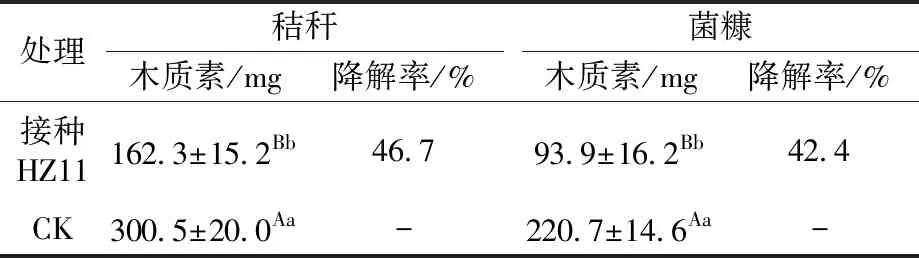
表4 菌株HZ11对秸秆和菌糠木质素的降解效果Table 4 Degradation effect of strain HZ11 on straw and mushroom substrate
3 讨 论
近年来,利用微生物降解木质素成为高效利用生物质资源的研究热点,细菌中的芽胞杆菌(Bacilluscohn)具有定殖率高、容易培养、抗逆性强等优势,同时芽胞杆菌因生产工艺简单、产品稳定、存储期长、使用方便、安全环保,实现产业化的潜力巨大,更具实际应用价值而倍受学者们关注。研究发现部分细菌通过代谢降解、改变结构、矿化产生CO2等作用降解木质素[13-17]。王毅等[18]研究发现了一株枯草芽胞杆菌能够降解木质素;王纳贤等[19]筛选出的一株淀粉芽胞杆菌经发酵培养后木质素降解率能够达到35%以上。本研究分离筛选到能高效降解木质素的菌株HZ11为解淀粉芽胞杆菌(Bacillusamyloliquefaciens),此结果与上述研究均印证了芽胞杆菌有望成为应用于工业化生产的木质素高效降解优良菌种研究的重要方向。
韩月颖[20]筛选的嗜麦芽窄食单胞菌LS-1,经过20 d发酵后,木质素降解率达36.14%;张芳芳等[21]测定亚黑管孔菌ZT-307和桦栓孔菌ZT-153对玉米秸秆酸不溶木质素降解效率分别为13.60%和 21.87%;戚业强[22]研究了优势菌株W.dispersaDY5在玉米秸秆固体发酵60 d后木质素降解率为34%;宋丽丽等[23]得出硬毛粗盖孔菌 (Funaliatrogii(Berk.) Bondartsev &Singer) 预处理玉米秸秆的木质素降解率为33.99%。本研究接种菌株HZ11的秸秆和菌糠培养基试验结果表明,发酵20 d后,秸秆和菌糠木质素降解率分别达到46.7%和42.4%,木质素降解效果明显高于上述研究。与未接种菌株的对照组相比较,加入菌株HZ11的培养基试验组木质素含量降低均达到显著水平。同时,菌株HZ11不仅能够高效降解木质素,还能够耐受50 ℃的高温。可见,菌株HZ11无论是在秸杆、菌糠等农业废弃物高温环境下好氧堆肥、生物饲料发酵等处理,还是在促进生物质资源高效利用等方面都具有潜在的应用价值。