聚乙烯亚胺改性硅胶材料对Cu2+的吸附动力学与热力学研究
刘海龙,张黎君,赵丹丹,赵 扬,范忠雷
(1.河南应用技术职业学院,河南 郑州 450042;2.郑州大学 化工与能源学院,河南 郑州 450001)
全球工业的快速发展导致重金属污染日益严重,如何解决重金属污染已成为社会研究热点[1]。因此,重金属离子的处理工艺越来越多,其中吸附法具有吸附量大、可重复利用、吸附速率大等优点备受关注。胺基对重金属离子具有较强的螯合作用,以胺基基团为修饰剂改性的吸附材料已多见报道[2-7]。文章以聚乙烯亚胺为表面修饰剂,接枝到硅胶表面,制备了聚乙烯亚胺硅胶材料。测定了其对重金属Cu2+的吸附性能,为进一步实现工业应用提供理论基础。
1 实验部分
1.1 试剂与仪器
聚乙烯亚胺,工业级,中和化学(山东)有限公司;烷基化硅胶,自制[6];甲醇,分析纯,天津市永大化学试剂有限公司;硫酸铜,分析纯,天津市永大化学试剂有限公司。
D-8401-W型多功能电动搅拌器,天津市华兴科学仪器厂;HZS-H型恒温振荡器,哈尔滨东联电子技术开发有限公司;DZ-2BC真空干燥箱,天津市泰斯特仪器有限公司;UV-2102 PC紫外可见光分光光度计,尤尼柯(上海)仪器有限公司。
1.2 聚乙烯亚胺硅胶材料的制备
以甲醇为溶剂,分别加入一定质量的聚乙烯亚胺溶液、烷基化硅胶(CPTMS-SiO2),60 ℃下反应16 h。结束后对产物进行洗涤、烘干,制成吸附材料,合成示意图见图1。
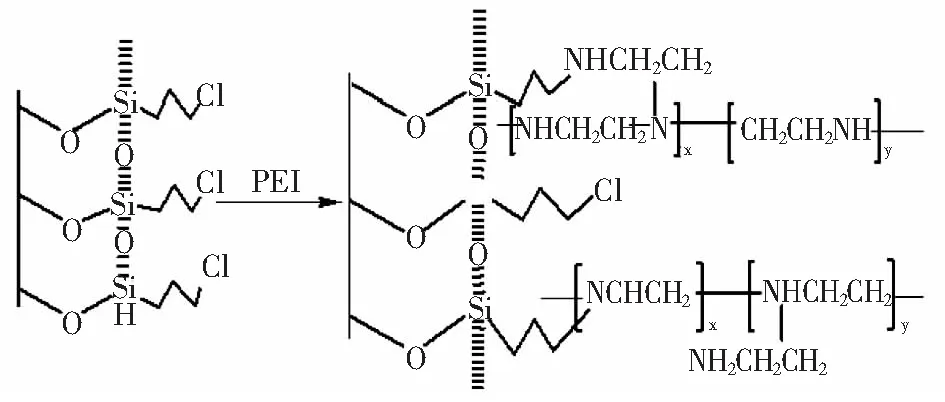
图1 吸附材料的合成示意图
1.3 动力学曲线的绘制
分别取25.00 mL不同浓度Cu2+溶液,加入0.15 g吸附材料,恒温振荡吸附一段时间,用紫外可见光分光光度计测定残余Cu2+的浓度,通过公式(1)计算出聚乙烯亚胺硅胶材料对Cu2+的吸附量,并绘制聚乙烯亚胺硅胶材料对Cu2+的吸附动力学曲线。
(1)
式中:q——吸附材料对Cu2+吸附量,mmol/g;V——Cu2+溶液体积,L;CA0——Cu2+溶液的初始浓度,mmol/L;CA——为t时刻Cu2+残余浓度,mmol/L;m——吸附剂质量,g。
1.4 等温吸附线的绘制
取25.00 mL不同浓度的Cu2+溶液,分别加入0.15 g吸附材料,恒温振荡直至吸附达到平衡,测定残液中Cu2+的浓度,通过公式(2)得出吸附剂对Cu2+的平衡吸附容量,绘制吸附热力学曲线。
(2)
式中:qe——平衡吸附容量,mmol/g;V——Cu2+溶液体积,L;CA0——Cu2+初始浓度,mmol/L;Ce——吸附平衡浓度,mmol/L;m——吸附剂质量,g。
2 结果与讨论
2.1 吸附动力学分析(图2)
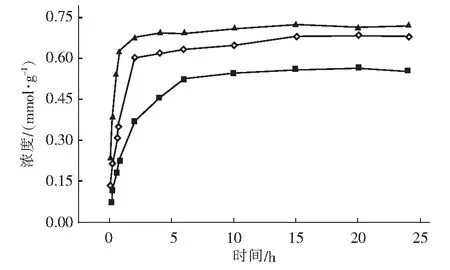
图2 聚乙烯亚胺硅胶材料对Cu2+的吸附动力学曲线
由图2可知,Cu2+初始浓度越大,吸附剂对Cu2+吸附容量越大,吸附平衡时间越短,这主要是因为初始浓度越大,推动力越大。当CA0为0.02 mol/L时,吸附量可达0.67 mmol/g,120 min达到吸附平衡,可见该吸附剂对Cu2+有较高的吸附容量和较快的吸附速率。
用于描述固—液吸附体系的主要有以下几个动力学方程,见公式(3)~公式(6)。
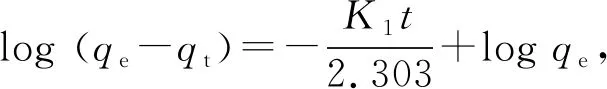
(3)
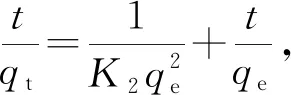
(4)
qt=A+Ktlnt,Elovich方程[10]
(5)
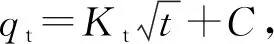
(6)
分别用上述方程来描述吸附材料对Cu2+吸附过程,根据实验数据进行回归分析并作图,拟合实验数据结果见表1。
根据表1中线性回归系数R2值,说明该吸附过程可用准二级动力学模型与粒子扩散模型进行描述。准二级动力学模型中Cu2+平衡吸附量计算值(Qe.exp)与实验数据极为接近,该吸附主要为化学吸附[12]。另外,粒子扩散方程线性回归方程并不通过原点,可知该吸附过程分别由膜扩散和颗粒内扩散联合控制[13-14],回归方程的直线斜率Kt1>Kt2,说明外扩散吸附速率大于内扩散速率,Cu2+的吸附在颗粒内部逐步达到平衡状态。在以后实际应用中,可通过减小吸附剂粒度改善内扩散过程。

表1 聚乙烯亚胺硅胶材料吸附Cu2+的动力学方程线性回归结果
2.2 吸附等温线及吸附热力学
吸附材料对Cu2+的吸附过程利用表2中Freundlich、Langmuir及Temkin等代表性等温方程对进行描述,分别对实验数据进行拟合计算。

表2 热力学方程
以qe对Ce作图,绘制吸附材料对Cu2+的吸附等温曲线,如图3。
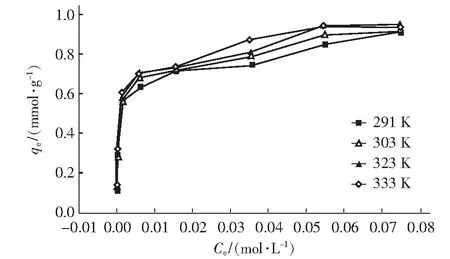
图3 吸附材料对Cu2+的等温吸附曲线
由图3可知,随着温度升高,吸附材料对Cu2+的饱和吸附容量增大。通过利用Langmuir、Freundlich及Temkin等温方程对实验数据进行线性拟合。结果表明,Cu2+的吸附过程可用Langmuir、Freundlich方程进行描述,具体见表3。
由表3中数据可知,Langmuir等温方程回归系数R2>0.99,该吸附行为符合Langmuir等温方程,表明该吸附材料表面存在着大量活化能相同的吸附位点,同时也说明该吸附为单分子层吸附。另外,Freundlich等温方程回归系数R2也接近0.98,说明该吸附过程也符合Freundlich等温方程,由拟合值1/n<1,可知吸附材料对Cu2+的吸附是优惠吸附过程。
由Van’t Hofff方程,可计算得出Langmuir常数KL随温度T(K)的变化关系[15]。
(7)
式中:ΔH0——吸附过程的焓变,kJ/mol;ΔS0——吸附过程的熵变,J/mol·K;R(8.314 J/mol·K)——理想气体常数;T——吸附温度,K。
以lnKL对1/T作图,有lnKL=7.066-315.088/T,R2=0.970,如图4所示。
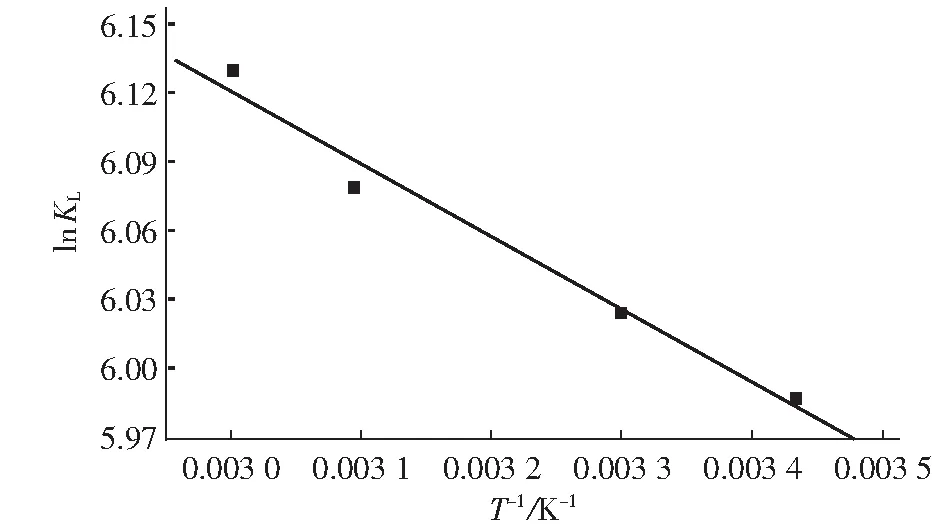
图4 吸附材料吸附Cu2+的lnKL随1/T的变化曲线
由lnKL随1/T的关系,可计算得到吸附过程的焓变ΔH0、熵变ΔS0,由计算吸附过程的吉布斯函数ΔG0,结果见表4。

表4 聚乙烯亚胺硅胶材料吸附Cu2+的热力学参数
由表4中数据可知,吸附焓变ΔH0>0,说明该吸附过程为吸热;ΔG0<0,说明该吸附为自发过程;ΔS0>0,表明该吸附为熵增过程;在291 K~333 K范围内,|ΔH0|<|TΔS0|,说明该吸附过程不是由焓变控制,而是熵变控制过程。
3 结论
文章将Cu2+具有螯合作用的聚乙烯亚胺接枝到带有端基-Cl的烷基化硅胶(CPTMS-SiO2),成功制得聚乙烯亚胺硅胶材料。该吸附剂对Cu2+的吸附容量高达0.5 mmol/g以上,其吸附行为符合Langmuir、Freundlich模型及准二级动力学方程,是一个熵驱动的吸热、自发过程。

