全基因组SNP-array联合染色体核型分析在胎儿中枢神经系统异常产前诊断中的价值*
张 颖,金艳文,温 艳,李伟伟
河北省承德市妇幼保健院:1.检验科;2.产科,河北承德 067000;3.河北省秦皇岛市妇幼保健院遗传优生科,河北秦皇岛 066000
胎儿中枢神经系统(CNS)异常是最常见的胎儿先天畸形之一,其检出率约为1%[1]。胎儿CNS异常的病因和机制尚不清楚。相关研究显示,大约 40% 的致病因素可能是环境和遗传因素[2]。胎儿CNS异常的临床表现包括:轻度脑室扩大、后颅窝增宽、脑积水、胼胝体发育不全(ACC)和前脑无裂畸形等。随着产前超声的发展,大多数胎儿CNS异常均可经产前超声检查发现[3]。通常建议超声异常的胎儿进行侵入性产前诊断,以确定其是否存在遗传异常,确定可能的病因,并评估胎儿的预后。传统的核型分析是诊断染色体异常的金标准,然而却很难确定染色体微缺失和使用核型分析进行微重复,且需要长时间的细胞培养。染色体微阵列分析(CMA)因其提供的高分辨率而越来越多地被用于医学领域的基因诊断,例如自闭症、智力障碍、发育迟缓、流产或产前诊断。目前国外指南建议当超声检测到胎儿存在一个或多个结构异常时,用 CMA 代替传统的核型分析[4-5]。CMA技术分为比较基因组杂交芯片和单核苷酸多态性微阵列芯片(SNP-array)两种类型,均可以检测染色体微缺失和微重复。SNP-array不仅可以检测基因组拷贝数变异(CNV),还可以检测单亲二倍体和嵌合体[6-7]。本研究应用全基因组SNP-array联合染色体核型分析,探讨二者联合应用在胎儿CNS异常产前诊断中的诊断价值。
1 资料与方法
1.1一般资料 选择2018-2020年到河北省承德市妇幼保健院和秦皇岛市妇幼保健院进行胎儿CNS异常产前诊断的患者275例。入组患者的孕周为13~39周,平均(26.21±7.84)周;年龄20~45岁,平均(32.44±7.83)岁;单纯性CNS异常组163例,CNS异常合并其他异常组112例。单纯性CNS异常指超声异常仅局限于CNS;CNS异常合并其他异常意味着胎儿除CNS异常外,心脏、泌尿、消化和其他系统也存在异常。单纯CNS异常163例,其中轻度脑室扩大62例,脑积水19例,后颅窝增宽10例,ACC 15例,蛛网膜囊肿16例,脉络丛囊肿 15例,小头畸形3例,室管膜下囊肿17例,小脑发育不全2例、脊柱畸形2例、沃二氏综合征1例、脑膨出1例。所有入组患者均为单胎妊娠,本研究经医院伦理委员会批准,患者及家属签署知情同意书。
1.2染色体核型分析 根据两个医院建立的常规方法,对275例CNS异常胎儿的绒毛、羊水、脐带血标本进行培养、收集、制备、G显带。采用GSL-120自动染色体扫描平台(Applied Imaging公司)对制备的样品进行采集分析。如疑为嵌合体或异常核型,则加倍计数,不少于 50 个分裂相。
1.3SNP基因分型芯片 使用Affymetrix公司的CytoScan 750k芯片和Illumina试剂盒按照标准操作程序进行基因组DNA扩增、杂交、扫描和数据分析。结果参考DGV(http://projects.tcag.ca/variation)、ISCA(https://www.iscaconsortium.org/)、OMIM(http://www.omim.org)、DECIPHER(htts://decinher.sanger.ac.uk/)等数据库。根据相应标准将结果分为CNVs异常、临床意义不明CNVs(VUS)和致病性CNVs。在CNVs异常的情况下,还对亲代样本进行检测,以确定变异的遗传性质及其临床意义。
1.4统计学处理 采用SPSS25.0统计软件进行数据分析。计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1染色体核型分析结果 275例CNS异常胎儿中,有22例胎儿有致病性染色体异常,异常率为8.00%(22/275),包括13-三体(3例)、18-三体(7例)、21-三体(5例)、其他染色体数目异常(1例)、染色体结构异常(6例)。单纯性CNS 异常的染色体异常率为4.91%(8/163),CNS异常合并其他异常的染色体异常率为 12.50%(14/112),差异有统计学意义(P<0.05)。见表1~2。
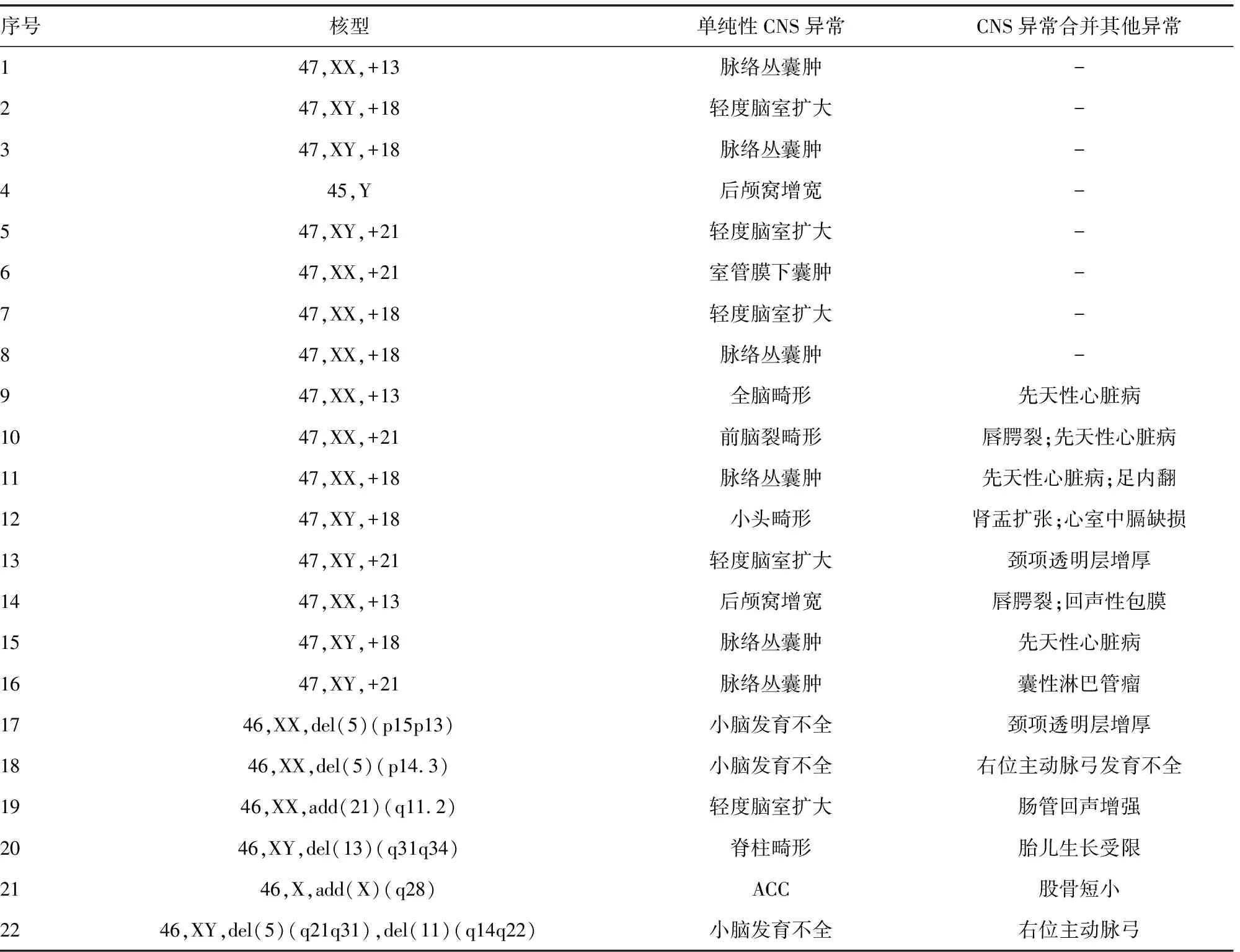
表1 胎儿CNS异常中的致病性染色体异常分析
2.2SNP-array分析 275例CNS异常胎儿采用SNP-array分析,除了染色体核型异常的22例胎儿之外(CNVs的结果与核型一致),另检测出23例CNVs异常胎儿,检出率为8.36%(23/275),其中致病性CNVs 15例,VUS 9例。163例单纯性CNS异常胎儿中,CNVs异常10例,其中致病性CNVs 7例,VUS 3例。112例CNS异常合并其他异常胎儿中CNVs异常13例,其中致病性CNVs 8例,VUS 5例。单纯性CNS异常组与CNS异常合并其他异常组致病性CNVs检出率分别为4.29%(7/163)和7.14%(8/112),差异无统计学意义(P>0.05)。CNS异常合并其他异常组的CNVs异常检出率为11.61%(13/112),高于单纯性CNS异常组的6.13%(10/163),但差异无统计学意义(P>0.05)。见表3~6。

表2 单纯性CNS异常组与CNS异常合并其他异常组中染色体异常情况(n)

表3 染色体异常胎儿SNP-array结果
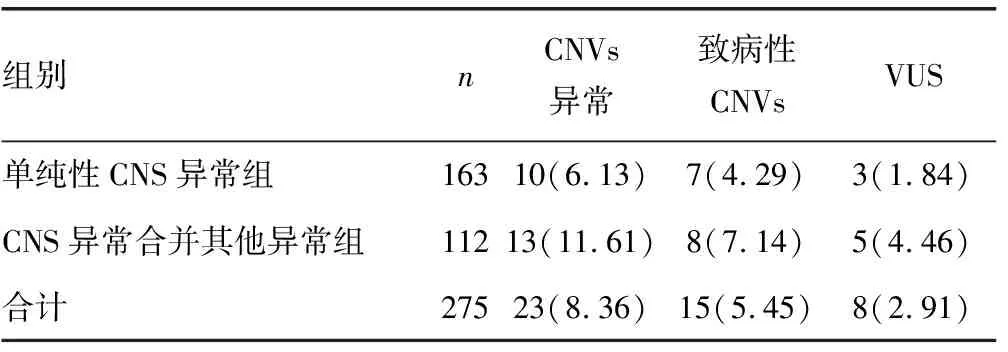
表4 单纯性CNS异常组与CNS异常合并其他异常组CNVs检出情况[n(%)]
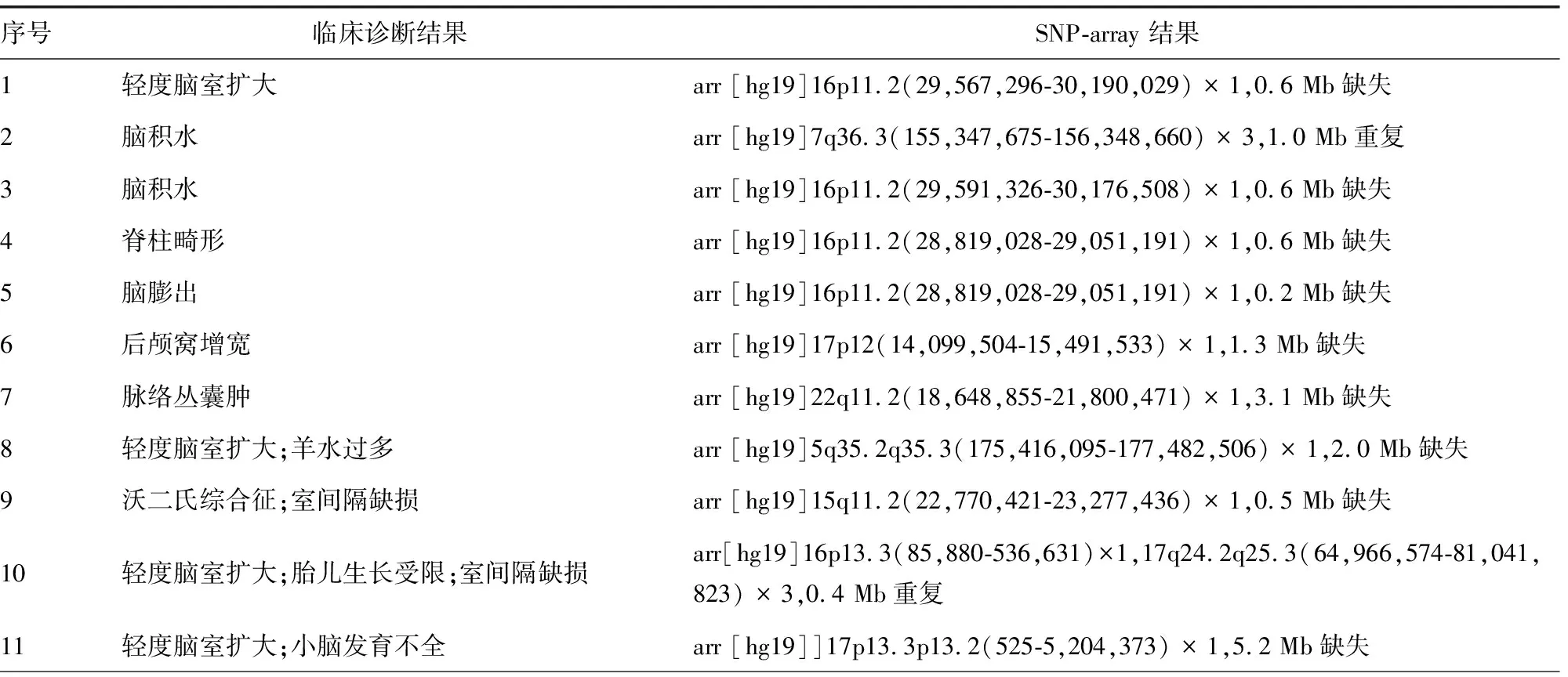
表5 CNS异常胎儿中致病性CNVs的SNP-array结果

表6 CNS异常胎儿中VUS的SNP-array结果
2.3染色体异常和致病性CNVs在单纯性CNS异常组中的检出率 单纯性CNS异常组胎儿中染色体异常(8例)和致病性CNVs(7例)的检出率为9.20%(15/163)。脉络丛囊肿(16.00%)、室管膜下囊肿(17.67%)和脊柱畸形(50.00%)的染色体异常和致病性CNVs检出率高于其他类型,但差异无统计学意义(P>0.05)。单纯性CNS异常组胎儿中以轻度脑室扩大最多,占38.04%(62/163),其中染色体异常和致病性CNVs占6.45%(4/62),见表7。

表7 163例单纯性CNS胎儿的表型特征
2.4临床结局 在275例CNS异常胎儿中,245例成功随访,剩余病例未能随访成功的原因包括患者拒绝随访、失联等。除染色体异常(22例)、致病性CNVs(15例)和VUS(8例)的胎儿被终止妊娠,另外有28例胎儿其核型分析和SNP-array结果显示正常,但仍然终止妊娠。
3 讨 论
遗传是导致胎儿发生CNS异常最主要的因素[8],CNS异常可导致胎儿脑脊液紊乱、左心室变形或者扩张,并且有极大概率导致胎儿多个脑室的异常改变[5]。胎儿CNS异常多数预后不良,且致残性高。目前通过产前超声筛查、遗传分析和临床咨询,可以评估CNS异常胎儿的预后[9]。严重畸形和染色体异常的胎儿可以及时终止妊娠,有效控制严重畸形胎儿的出生率,对指导优生优育、减少出生缺陷、提高新生儿人口素质具有重要的临床意义。本研究对伴或不伴其他超声异常的CNS异常胎儿进行染色体核型分析和SNP-array联合检测。染色体核型分析检出22例异常核型,染色体异常检出率为8.00%,这说明非整倍体和大片段染色体的异常会引起遗传的改变,扰乱基因间的平衡,从而导致胎儿多系统畸形。除了22例染色体核型异常(CNVs的结果与核型一致),SNP-array另检测到23例异常CNVs,其检出率为16.36%(45/275)。本次研究中的23例异常CNV片段的缺失或者微重复大小不同,传统的核型分析无法识别。研究表明,胎儿CNS异常的病因除了与染色体异常有关外,还与染色体微缺失和/或微重复有关[10]。SNP-array的使用可以弥补传统核型分析的不足,对于核型分析正常的胎儿出现CNS异常,应建议采用SNP-array进行进一步检测。染色体核型分析需要进行细胞培养,耗时长,另外需要具有经验的分析人员对染色后的标本进行计数,检测的周期较长,而且由于培养失败等问题易导致无法检测。SNP-array是一种基因芯片技术,属于CMA,与传统的核型技术相比具有更高的分辨率,可识别Kb水平的微缺失和微重复。SNP-array技术可额外发现6%~15%的染色体结构异常[11]。由于SNP-array技术不需要进行细胞培养,在临床的应用越来越广泛,尤其对于一些传统产前诊断染色体核型分析无法检测到的亚微结构CNVs的诊断很有价值[12]。
CNS异常合并其他异常组的CNVs异常检出率高于单纯性CNS异常组(11.61%和6.13%),但差异无统计学意义(P>0.05)。因此,对于有CNS异常表现的胎儿,特别是有多种CNS异常表现的胎儿,建议使用染色体核型和SNP阵列联合检测进行最终诊断。单纯性CNS异常组的染色体异常和致病性CNVs的检出率为9.20%。脉络丛囊肿、室管膜下囊肿和脊柱畸形的染色体异常和致病性CNVs检出率高于其他单纯性CNS异常胎儿。既往研究也表明,在通过CMA检测致病性CNVs的情况下,单纯性CNS异常胎儿的额外检出率为6.5%~8.3%,而这是传统的核型分析所不能检测的[13-14]。SNP-array检测技术发现的23例CNVs异常患者中,15例为致病性CNVs,其中有7例是大众熟知的微缺失/微重复综合征,5例16p11.2和2例22q11.2微缺失综合征。本研究中经SNP-array发现的5例16p11.2微缺失综合征有着不同的超声异常表现,轻度脑室扩大1例,脑积水、脊柱畸形、脑膨出各1例,其余1例除轻度脑室扩大外还有其他的超声异常。16p11.2微缺失综合征的发病率约为0.3%[15],主要临床症状包括智力障碍和自闭症谱系障碍。T-box转录因子6是导致16p11.2微缺失综合征患者椎体畸形的关键基因[1]。目前,关于16p11.2微缺失综合征胎儿的报道很少,只有少数研究报道了与16p11.2微缺失综合征相关的超声异常,包括心脏畸形、多囊肾、鼻骨缺失、单脐动脉、宫内发育迟缓等[16]。本研究经SNP-array 发现的2例22q11.2微缺失综合征均为脉络丛囊肿,只是其中1例除此之外表现了其他的超声异常。22q11.2微缺失综合征的发病率约为1/4 000,临床症状表现不一。本研究经SNP-array 还检测到1例17号染色体的p13.3p13.2 5.2M的缺失,这个缺失可导致Miller-Dieker综合征即无脑回畸形综合征,其发病率为1.2/100 000,通常的临床特征为ACC、小头畸形等。本研究中该病例的超声显示轻度脑室扩大、小脑发育不全和其他超声异常。
虽然SNP-array技术能够提高CNS异常胎儿的致病性遗传性变异的检出率,但是这种检测技术即CMA有其自身的不足,例如检测出的VUS病例使遗传咨询变得困难。根据文献报道[17],CMA对VUS的检出率为1.1%~6.0%。本研究中的275例CNS异常病例中,共有8例 VUS病例,包括单纯性CNS异常以及CNS异常合并其他异常,VUS在CNS异常中的检出率为2.91%,与以往报道检出率呈一致性。本研究中检测到的VUS病例中,有4例含有神经发育相关的易感基因,包括1例15q13.3重复、1例16p13.11重复、1例1q21.1q21.1重复、1例1q21.1缺失。神经发育的易感位点外显不全,可能表现为心血管疾病、认知障碍、行为障碍和智力障碍等[18]。神经发育的易感位点外显率不完全使产前遗传咨询面临极大挑战。而3p22.1缺失则仅包含1~3个OMIM基因,这些变异与神经系统发育无关,但超过了报告阈值。而18q11.2重复则包含了PIGN基因的16-31外显子,纯合突变导致多发性先天性abnormalities-hypokalemia-epilepsy综合征,临床表现为运动发育障碍、癫痫、多种畸形和各种先天性异常包括心脏、泌尿系统和胃肠系统[19-20]。因此近年来,下一代测序重点研究单基因突变检测[21],以为更好地评估胎儿预后提供更全面的方法。
本研究将核型分析与SNP-array相结合,可以帮助CNS异常胎儿的父母做出是否终止妊娠的决定。例如,在轻度脑室扩大的胎儿中,来自SNP-array阵列的正常结果表明胎儿可能有更好的预后,父母可以选择继续妊娠。在本研究成功随访的245例患有CNS异常的胎儿中,除外染色体异常和致病性CNVs的胎儿之外,另有28例患儿其核型和SNP-array结果显示正常,但仍然终止妊娠。所以即使核型和SNP-array结果正常,大多数胎儿CNS异常和多种畸形的父母仍然决定终止妊娠,因为他们认为这些异常的畸形或者疾病在产后得不到较好的治疗,出生后胎儿会具有严重的临床表现,如严重畸形、智力障碍等。与传统的核型分析相比,单核苷酸多态性阵列可以在CNS异常的胎儿中发现更多的CNVs异常[22]。
综上所述,染色体核型分析为是否存在染色体数目和结构变异提供重要的实验依据,但其最大的不足在于细胞培养失败与母体细胞污染等问题出现的概率较高,再加上无法检测染色体的微缺失/微重复,需要联合SNP-array检测进一步确定。SNP-array检测结果包括拷贝数变异、微缺失/微重复、染色体非整倍体数目异常、三倍体、单亲二倍体、杂合性丢失、嵌合体等,可以获得更精准的遗传信息,利于产前咨询,但是其劣势则是该检测方法价格昂贵,提高了临床推广的难度,希望后期可以降低价格以发挥其更大的优势。尽管如此,仍建议将SNP-array用于CNS异常胎儿的产前诊断,可以更好地进行产前评估和遗传咨询,并发挥联合检测的优势。

