氧化低密度脂蛋白、血清可溶性凝集素样氧化低密度脂蛋白受体-1与痛风患者亚临床动脉粥样硬化的关系*
郑雪娜,聂 豪,戢 操,李 敏
1.湖北医药学院附属人民医院血液内科,湖北十堰 442000;2.湖北医药学院附属十堰市太和医院内分泌风湿病科,湖北十堰442000
痛风的病理机制与嘌呤代谢异常、尿酸排泄障碍所致的高尿酸血症(HUA)及尿酸盐沉积有关,其主要症候群包括:单纯HUA、痛风性关节炎、痛风石形成以及痛风性肾病[1]。近年来,随着饮食结构的改变,痛风的发病率逐年升高,痛风并发症严重影响患者的生活质量[2]。流行病学研究发现,痛风与肥胖、高脂血症、糖尿病等代谢性疾病的发生密切相关,HUA是冠心病、脑卒中等动脉粥样硬化(AS)性疾病的共同危险因素,是患者致死、致残的潜在威胁[3-4]。因此,利用血清生物学标志物早期诊断和动态监测AS的发生,对改善心脑血管疾病的诊断、治疗和预后具有重要意义。氧化低密度脂蛋白(ox-LDL)在AS中的致病性已得到公认,被认为是AS性心血管疾病的潜在生物标志物[5]。凝集素样氧化低密度脂蛋白受体-1(sLOX-1)可结合氧化型低密度脂蛋白,促进冠心病的发生、发展,sLOX-1是LOX-1在血清中的存在形式,sLOX-1水平与AS密切相关[6]。本研究通过测定痛风患者血清ox-LDL和sLOX-1水平,并进行双侧动脉彩超检查,用颈动脉内膜中层厚度(IMT)和颈动脉微斑块来反映亚临床AS,分析痛风患者循环ox-LDL、sLOX-1水平以及血糖、血脂、胰岛素抵抗指数等其他AS常见危险因素与痛风患者出现亚临床AS的相关性。
1 资料与方法
1.1一般资料 根据2015年欧洲抗风湿病联盟和美国风湿病学会共同制定的痛风分类标准[7],于2020年6月至2021年10月纳入十堰市太和医院内分泌风湿病科门诊及住院的痛风患者68例作为研究对象。其中男64例,女4例;年龄39~73岁,平均(63.24±29.29)岁。排除标准:(1)肿瘤放疗、化疗后,骨髓增殖性疾病,急、慢性肾衰竭等所致的继发性痛风;(2)正在使用降尿酸药物、钙调蛋白酶抑制剂(他克莫司、环孢素)、利尿剂(氢氯噻嗪、速尿片)、抗结核药物(异烟肼、利福平)或水杨酸制剂;(3)有酗酒史;(4)既往或目前有明确心脑血管病史者;(5)高血压、糖尿病患者;(6)体质量指数(BMI)≥28 kg/m2的肥胖者。通过双侧颈动脉彩超检查结果,将痛风患者分为亚临床AS组(AS组)[共38例,其中男36例,女2例;年龄40~72岁,平均(55.34±13.56)岁;病程(8.12±3.34)年]和非亚临床AS组(non-AS组)[共30例,其中男28例,女2例;年龄39~69岁,平均(51.56±19.78)岁;病程(5.32±2.27)年]。另选取43例来自湖北医药学院附属人民医院体检中心的体检健康者作为对照组,其中男40例,女3例;年龄40~72岁,平均(53.28±10.26)岁。对照组排除BMI≥28 kg/m2的肥胖者,排除高血压、冠心病、脑卒中、糖尿病、肿瘤、感染性疾病和自身免疫性疾病患者。本研究已通过医院医学伦理委员会审核批准。
1.2方法
1.2.1颈动脉彩超测量方法 通过彩色多普勒超声仪(飞利浦,EPIQ 7)测量颈动脉IMT并评价动脉斑块。操作如下:选择双侧颈总动脉窦远端1 cm处及动脉窦部两段血管测量IMT,每段血管测量3个点的IMT,共计12个点,IMT取12个点的平均值。颈动脉IMT增厚定义:任何部位出现IMT>1.0 mm。符合以下任一标准,则动脉斑块形成:(1)局部IMT≥1.5 mm;(2)局限性隆起凸入管腔≥0.5 mm;(3)局部IMT增厚超过周边IMT≥50%。将颈动脉IMT增厚和(或)动脉斑块形成定义为亚临床AS。
1.2.2实验室指标的测定 采集研究对象空腹静脉血5 mL,置于离心管,以3 000 r/min离心10 min,分离血清,分装保存置于—80 ℃冰箱内保存。采用酶联免疫吸附试验(ELISA)测定血清ox-LDL和sLOX-1水平,酶标仪由英国Biochrom公司生产(型号:Anthos 2010),试剂盒由武汉USCN公司提供,按照ELISA试剂盒说明书操作。采用生化方法(日本,日立7060全自动生化分析仪)测定所有受试者血尿酸(UA)、空腹血糖(FBG)、空腹胰岛素、超敏C反应蛋白(hsCRP)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平;糖化血红蛋白(HbA1c)采用高效液相色谱法测定(日本,Arkray糖化血红蛋白分析仪)胰岛素抵抗指数(HOMA-IR)计算公式:空腹胰岛素×FBG/22.5。

2 结 果
2.1各组一般临床资料比较 AS组、non-AS组与对照组比较,年龄、BMI、FBG、TC、HDL-C和HbA1c差异均无统计学意义(P>0.05),AS组、non-AS组颈动脉IMT、UA、TG、LDL-C、hs-CRP、HOMA-IR均高于对照组,差异有统计学意义(P<0.05)。其中,AS组与non-AS组比较,颈动脉IMT、病程、HOMA-IR及hs-CRP水平均显著升高,差异有统计学意义(P<0.05),而UA、TG、LDL-C差异无统计学意义(P>0.05)。见表1。

表1 各组一般临床资料比较
2.2三组血清ox-LDL和sLOX-1水平比较 AS组患者血清ox-LDL[42.37(20.77,181.20)ng/mL]、sLOX-1[7.66(4.43,14.03)ng/mL]水平高于non-AS组[oxLDL:19.03(8.46,32.44)ng/mL,sLOX-1:5.70(2.41,10.87)ng/mL],差异有统计学意义(P<0.05),而non-AS组患者血清ox-LDL、sLOX-1水平则高于对照组[ox-LDL:10.71(4.22,14.74)ng/mL,sLOX-1:0.98(0.49,3.18)ng/mL],差异有统计学意义(P<0.05)。见图1、图2。

图1 三组ox-LDL水平比较
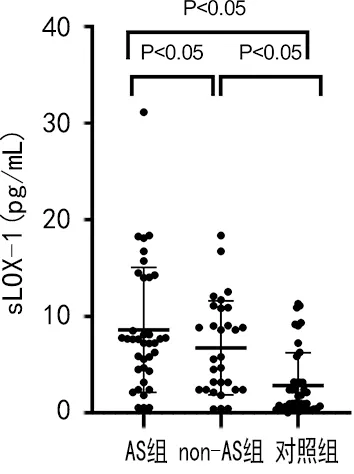
图2 三组sLOX-1水平比较
2.3痛风患者血清ox-LDL与sLOX-1的相关性分析 Spearman相关性分析结果显示,痛风患者ox-LDL与sLOX-1呈正相关(r=0.531,P<0.001)。
2.4血清ox-LDL和sLOX-1对痛风患者合并亚临床AS的诊断效能分析 单因素ROC曲线分析结果显示,血清ox-LDL水平诊断痛风患者合并亚临床AS的AUC为0.718(P=0.0023),血清sLOX-1水平诊断痛风患者合并亚临床AS的AUC为0.769(P=0.0002),见图3。

注:A为ox-LDL诊断痛风患者合并亚临床AS的ROC曲线;B为sLOX-1诊断痛风患者合并亚临床AS的ROC曲线。
2.5影响痛风患者颈动脉IMT的多因素Logsistic回归分析 以痛风患者年龄、性别、病程、BMI、ox-LDL、sLOX-1、UA、HOMA-IR、HbA1c、FBG、TG、TC、HDL-C、LDL-C作为自变量,颈动脉IMT作为因变量,进行多因素Logistic回归分析,结果显示,年龄、病程、TG、LDL-C、HOMA-IR、ox-LDL是痛风患者合并亚临床AS的影响因素。见表2。

表2 影响痛风患者颈动脉IMT的多因素Logistic回归分析结果
3 讨 论
流行病学调查发现,在过去的几十年里痛风的发病率持续升高,并有年轻化趋势,痛风、HUA及其密切关联的心脑血管疾病已成为危害人民身体健康的重要原因[8]。目前的观点认为AS是一种由脂代谢紊乱、血管内皮损伤、巨噬-单核细胞募集及迁徙、血管平滑肌细胞增殖、泡沫细胞形成等多种病理生理学机制介导,最终形成血管粥样硬化斑块的慢性炎症性过程[9]。HUA是痛风发生的病理学基础,美国一项回顾性研究表明,血尿酸水平每增加1 mg/dL,心、脑血管系统疾病病死率相应升高39%,循环高水平尿酸及其导致的尿酸盐结晶可通过损伤血管内膜、氧化应激效应和炎症募集等多种生物学作用参与AS的发生、发展[10]。
循证医学证据表明,与普通人群相比,痛风患者急性心肌梗死导致的病死率显著升高,且独立于单纯HUA患者,提示HUA可能不仅仅是痛风患者AS高发生率的原因,传统的AS危险因素如肥胖、高脂血症和糖尿病也是痛风患者常见的合并症,它们共同参与患者急性心肌梗死、脑梗死等不良预后事件[11]。本研究发现,两组痛风患者TG、LDL-C水平较对照组升高,符合致AS血脂谱的典型特征,国外其他研究则表明TG、载脂蛋白B(ApoB)等血脂成分可能同样参与痛风患者AS的发生[12]。
早期诊断并治疗AS是预防其发展成动脉缺血、闭塞而引起严重心脑血管疾病的重要方案,是改善患者预后的关键。基于颈动脉IMT及斑块形成的颈动脉彩超检查是诊断亚临床AS科学、简便的方法,是评估患者心脑血管疾病风险的良好指标[13]。本研究采用多点测量双侧颈动脉IMT作为评价亚临床AS的依据,发现痛风患者颈动脉IMT水平高于对照组,结果与李敏等[14]报道一致。提示痛风患者较健康人群具有更高的AS发生风险,故推荐对痛风患者进行颈动脉彩超筛查,以利于早期发现AS。
氧化应激效应是多种刺激因素导致机体氧化与抗氧化系统失衡,氧自由基团(ROS)增加,从而引起一系列组织损伤反应的过程,它主要通过两个方面促进AS的发生:一方面,ROS及其氧化产物作为上游功能性炎症信号分子,激活炎症信号通路,通过多种生物学效应引起动脉炎性反应;另一方面,ROS通过氧化作用引起脂质、核酸、蛋白质等大分子成分产生过氧化产物,ox-LDL即是LDL中的蛋白质及脂质成分受到ROS攻击而氧化修饰形成,可介导血管内皮细胞变性、坏死,内膜通透性改变,增加脂质在内膜的浸润,直接或间接造成血管内皮损伤从而参与AS[15]。LOX-1属于C型凝集素家族成员,最初发现于牛主动脉内皮细胞中,它主要识别ox-LDL,也能识别C反应蛋白、热休克蛋白等多种配体,参与AS的发生、发展。sLOX-1是LOX在血清中的存在形式,众多临床研究表明,sLOX-1与多种AS性疾病有相关性,尤其对冠心病的早期诊断有较高的特异度和灵敏度[16]。基础研究表明,作为ox-LDL配体,LOX-1介导了其大部分毒性作用,ox-LDL/LOX-1可通过激活核因子NF-κB、炎性体 Nod 样受体蛋白 3等炎症信号通路,诱导多种细胞分泌炎症因子(肿瘤坏死因子α、白细胞介素-1、白细胞介素-6等)、趋化因子及黏附分子,促进炎性细胞向内膜下趋化、黏附,引起血管炎症效应[17]。本研究结果显示,两组痛风患者ox-LDL、sLOX-1水平均较对照组升高,提示患者体内脂质过氧化效应增强。此外,AS组患者血清ox-LDL、sLOX-1水平高于non-AS组,而痛风患者血清ox-LDL与sLOX-1水平呈正相关,它们的一致性变化进一步验证其在痛风患者AS发病机制中潜在的促进作用,循环ox-LDL/sLOX-1可能通过活化下游炎症信号通路参与痛风患者AS的发生。本研究结果显示,AS组平均病程较non-AS组长,血清hs-CRP水平较non-AS组升高,提示长病程可能导致痛风患者体内微炎症状态的出现,而这种微炎症状态可能与脂质过氧化效应互为因果关系[17]。
临床中用于诊断AS的血清学特异性标志物相对缺乏,尽管较多研究显示冠心病、脑卒中等AS性疾病患者血清ox-LDL、sLOX-1有不同程度的升高,然而ox-LDL、sLOX-1是否可以作为AS的潜在生物标志物目前还不清楚[18]。本研究进行的单因素ROC曲线分析结果显示,ox-LDL诊断痛风合并亚临床AS的AUC为0.718,sLOX-1诊断痛风合并亚临床AS的AUC为0.769,二者均展现出较好的诊断价值。进一步作多因素Logisitic回归分析,结果表明ox-LDL是痛风患者合并亚临床AS的独立影响因素,提示联合检测痛风患者血清ox-LDL、sLOX-1对AS的早期诊断有一定临床意义。胰岛素抵抗(IR)是代谢综合征的重要组分,是2型糖尿病的基本病理生理学基础,可促进AS的发生、发展,HOMA-IR是衡量IR程度简便、实用的临床指标。已有研究表明,合并肥胖、高血压的痛风患者存在不同程度的IR与糖尿病[19]。本项研究中,尽管纳入的痛风患者未合并肥胖、糖代谢异常等情况,但AS组患者HOMA-IR显著升高,多因素Logisitic回归分析提示病程、血脂和HOMA-IR是痛风合并亚临床AS的独立危险因素。
综上所述,本研究结果表明痛风患者早发AS是多因素共同作用的结果,高脂血症和IR等AS传统危险因素在此过程中起促进作用,循环中的脂质过氧化产物ox-LDL及其受体sLOX-1水平的升高及其介导的炎症效应可能是患者AS发生的另一重要原因。然而,作为一个回顾性、横断面调查,本研究样本量较小,研究结论存在一定局限性,未来需进行前瞻性、大样本量的临床研究进一步验证,并需通过ox-LDL/sLOX-1致AS的基础研究,明确其在AS中的确切作用。

