浙江省部分地区肉鸡和蛋鸡的粪便菌群结构差异分析
唐 标,吴 静,王静鸽,3,郑 雪,吉小凤,钱鸣蓉,杨 华*
(1. 浙江省农业科学院 农产品质量安全危害因子与风险防控国家重点实验室,浙江 杭州 310021;2. 浙江省农业科学院 农产品质量安全与营养研究所,浙江 杭州 310021;3. 青海大学 农牧学院,青海 西宁 810016)
肉鸡和蛋鸡的养殖在我国畜牧养殖业中占据重要地位。不同品种的鸡在不同地方的生长环境、养殖规模、养殖设备不仅影响鸡的品质,还影响其粪便的微生物组成。蛋鸡多笼养,活动范围小;肉鸡养殖模式多样,既有散养也有笼养。因此两者的饲养方式以及养殖环境均大有不同。养鸡行业的集约化生产,带来了可观的经济效益,同时也产生了大量的排泄物。鸡粪通常作为肥料、饲料及沼气发酵被利用起来,但是鸡粪中具有许多病原菌、寄生虫卵、重金属及抗生素残留等有毒有害物质,对人类健康和环境构成潜在威胁。因此,在进行养殖场粪便资源化再利用的同时,深入研究不同种类的养鸡场粪便的菌群结构具有必要性。很多学者对鸡粪菌群结构进行了报道,邓雯文等用16S rDNA高通量测序技术研究鸡粪菌群变化,发现在门水平,各组均以厚壁菌门()、变形菌门()、拟杆菌门()3个菌门为主,对样品中潜在病原菌菌属进行分析,结果发现,拟杆菌()、不动杆菌()、假单胞菌()等13个菌属在鲜鸡粪中有较高的丰度。王学静等的研究表明散养鸡的益生菌丰度高于笼养鸡,而笼养鸡的致病菌丰度高于散养鸡。造成鸡肠道或粪便微生物菌群差异变化因素较多,因此,在不同地区和养殖环境下,引起蛋鸡和肉鸡粪便菌群差异性的原因还需进一步探究。
本研究基于16S rDNA扩增子高通量测序技术,对浙江省部分养鸡场粪便中的微生物菌群进行分析,研究了蛋鸡与肉鸡的菌群结构的差异,结合不同养殖场的不同养殖方式、饲养环境等因素,明确了蛋鸡和肉鸡的微生物菌群结构和差异性,对优化养殖方式及粪便资源化利用具有重要参考价值。
1 材料与方法
1.1 样品采集
随机选取浙江省养鸡规模较大的5个县市的养鸡场,共采集53个样品。在杭州市富阳区(FY)散养的白羽肉鸡场采集粪便样品14个,在桐庐县(TL)某散养肉鸡仙居鸡场采集粪便样品14个,两个肉鸡场均采用散养模式。在杭州市余杭区(YH)某蛋鸡厂采集海兰白粪便样品10个;在温州市(WZ)某养殖厂采集京红1号蛋鸡粪便样品8个;在台州市天台县(TT)某蛋鸡场采集海兰褐蛋鸡粪便样品7个,另外此养殖厂在喂养时添加了壳聚多肽。三个蛋鸡场均为笼养模式,样品为养殖场的蛋鸡和肉鸡的新鲜粪便,取样后干冰保存并运回实验室,置于-80 ℃冰箱保存备用。
1.2 基因组总DNA提取
用粪便DNA提取试剂盒(QIAampFast DNA Stool Mini Kit)提取所采样品的总DNA,具体提取方法参考说明书。每个粪便样品称取180~220 mg提取DNA,用1%的琼脂糖凝胶电泳检测抽提的基因组DNA的完整性,NanoDrop 2000分光光度计用于评估所提样品中DNA浓度与纯度。
1.3 16S rDNA扩增及Illumina Mi-Seq测序
采用引物338F 5'-ACTCCTACGGGAGGCAGCAG-3' 和806R 5'-GGACTACHVGGGTWTCTAAT-3' 对16S rDNA的V3-V4区进行扩增,PCR扩增体系(总体积为20 μL):2.5 mmol/L dNTP 4 μL,338F和806R各1 μL,rTaq Buffer(10×)2.5 μL,rTaq 酶0.3 μL, ddHO 11.2 μL。PCR扩增程序:95 ℃预变性 3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃再延伸5 min,4 ℃保存。扩增产物用1%的琼脂糖凝胶电泳进行检测,对于符合条件的PCR产物进行纯化回收,回收产物采用 TruSeqTM DNA Sample Prep Kit建库试剂盒进行文库构建,利用Illumina Mi-Seq平台(美吉生物医药科技有限公司,中国上海)进行上机测序。
1.4 高通量测序数据分析
使用美吉生物云在线平台(www.majorbio.com)进行数据分析。测序得到的原始数据经过质量评估,对序列质量进行质控和过滤区分样本,用Uparse 7.0.1090进行操作分类单元 (operational taxonomic unit,OTU)聚类,用Usearch 7.0进行OTU统计,OTU数量可以代表样品物种的丰度,从而进行高通量测序数据统计与质量分析;利用Mothur软件计算每个样品的OTU数量,根据Coverage指数、Chao1指数、Ace指数、Shannon指数和Simpson指数进行α多样性分析;利用Qiime 1.9.1计算门到种水平的丰度进行菌群结构分析及组间差异分析。
2 结果与分析
2.1 高通量测序数据统计与质量分析
53份样品共产生3 027 200条有效序列。平均长度为437 bp,由图1A可见,测序序列数大于30000时,曲线上升缓慢,表明测序深度与数据量合理,测序数据量继续加大,只会产生少量新的OTU。
在各分类水平上统计各样本的菌群,共获得20个门,44个纲,93个目,175个科,425个属,712个种1523个OTU。由图1B可知,蛋鸡OTU总数为1352,肉鸡OTU总数为1332。蛋鸡独有的OTU数为191,肉鸡独有的OTU数为171,两组样品在微生物菌群组成上存在差异。
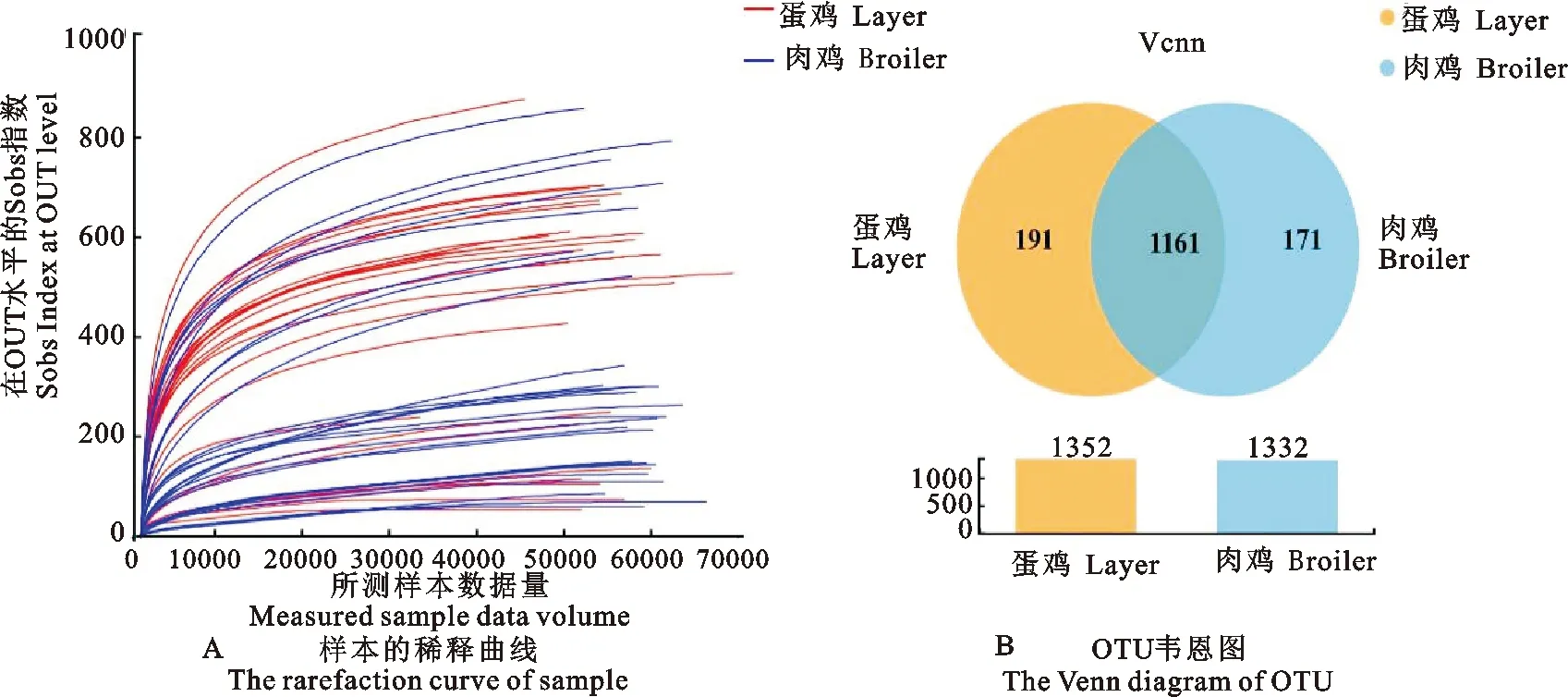
图1 16S rDNA高通量测序数据质量与统计Fig.1 16S rDNA high-throughput sequencing data quality and statistics
2.2 α多样性分析
Coverage指数代表了样品的覆盖率,所有样本的Coverage指数均大于0.99,说明测序结果可信。Ace指数和Chao1指数代表菌群的丰度,TL肉鸡场的样品中Ace指数和Chao1指数分别为612.70、609.99,均高于三个蛋鸡场的样品,这可能与肉鸡场的散养方式有关。Simpson指数越大,多样性越低。其中两个蛋鸡场WZ和TT的平均Simpson指数(0.17、0.10)均低于两个肉鸡场FY和TL(0.32、0.14)。Shannon指数和菌群的多样性正相关,Shannon指数越大,说明多样性越高,各组样本在OTU水平的Shannon指数如图2A所示。
三个蛋鸡场的平均Shannon指数(YH、WZ和TT: 3.35、3.79、3.78)均高于两个肉鸡场FY和TL(1.73、3.25)。如图2B所示,蛋鸡粪便的Shannon指数极显著高于肉鸡(<0.01),说明蛋鸡粪便样本的菌群多样性显著高于肉鸡。

图2 不同组样品在OTU水平的α多样性分析Fig.2 Analysis of α diversity of different groups at OTU level
2.3 菌群结构分析
在门水平上,蛋鸡和肉鸡的粪便菌群结构如图3所示,厚壁菌门(36.83%),变形菌门(29.79%),拟杆菌门(19.80%),梭杆菌门(Fusobacteria,8.62%)是所采样品的优势菌群。其中肉鸡粪便的变形菌门相对丰度高于蛋鸡(肉鸡FY: 71.20%,TL:25.11%,蛋鸡YH: 9.60%,WZ: 10.17%,TT:7.60%)。蛋鸡样品的拟杆菌相对丰度(YH、WZ和TT: 33.21%、28.13%、31.52%)高于肉鸡(FY和TL:1.69%,17.70%)。蛋鸡样品中梭杆菌门的相对丰度(YH、WZ和TT: 26.26%、5.47%和11.10%)高于肉鸡样品(FY: 0.003%,TL: 5.18%)。另外,蛋鸡场TT鸡粪样品中的厚壁菌门平均丰度(42.26%)高于其他两个蛋鸡场(YH和WZ)。

图3 蛋鸡和肉鸡粪便在门水平的菌群结构Fig.3 Bacterial communities structure of faeces of broiler and laying hen at the phylum level
属水平的粪便菌群组成热图如图4所示,所采样品的优势菌群有埃希氏菌-志贺氏菌(-,12.95%)、消化链球菌(,12.95%)、螺杆菌(,12.95%)、拟杆菌(12.30%)、梭菌属(,8.70%)和乳酸杆菌属(,4.36%)。肉鸡场(FY和TL)的埃希氏菌-志贺氏菌属(31.21%、17.49%)和螺杆菌(31.43%、2.55%)的平均丰度均高于其他三个蛋鸡场(0.02%、0.91%、1.50%)(1.71%、0.71%、2.02%)。

图4 不同组样品在属水平的菌群组成热图Fig.4 Heat map of bacterial communities composition of different groups of samples at the genus level
2.4 基于门水平和属水平的组间差异分析
为了解蛋鸡和肉鸡细菌菌群结构差异,对其进行了基于门和属水平的组间差异显著性检验。由图5A可知,在门水平上,变形菌门、梭菌门、互养菌门()和黏胶球形菌门()在蛋鸡和肉鸡之间的差异极显著(<0.01)。由图5B可知,在属水平上,埃希氏菌-志贺氏菌、螺杆菌、Bacteroides_barnesiae在两组样品之间的差异极显著(<0.01),另外还有4个属在两组样品之间差异极显著(<0.01: Fusobacterium_mortiferum, Rikenellaceae_RC9_gut_group, unclassified_g__Bacteroide,unclassified_o__Bacteroidales)。通过偏最小二乘法判别分析可知,蛋鸡和肉鸡均被分为不同的区域,这表明蛋鸡和肉鸡的菌有显著的差异,同一组内的粪便样本菌群的重复性良好(图6)。

图5 蛋鸡与肉鸡的组间差异显著性检验圆点对应的数值表示物种在两组中平均相对丰度的差值,圆点颜色显示为物种丰度占比较大的分组颜色,圆点上的I型区间为差值的上下限值;最右边为P值。Fig.5 Significance test of differences between broiler and laying henThe value corresponding to the dot represents the difference of the average relative abundance of species between the two groups.The color of the dot represents the grouping color with a large proportion of species abundance. The I-type interval on the dotrepresents the upper and lower limits of the difference. P value is on the far right.

图6 在属水平的菌群PLS-DA组间差异Fig.6 PLS-DA of bacterial communities at the genus level
3 讨 论
本研究中所采样品蛋鸡和肉鸡粪便优势菌组成类似。肉鸡粪便样品中,厚壁菌门(36.83%)、变形菌门(29.79%)、拟杆菌门(19.80%)、梭杆菌门(2.59%)依次为优势菌门;蛋鸡在门水平上的优势菌丰度从高到低分别为厚壁菌门(40.01%)、拟杆菌门(30.95%)、梭杆菌门(14.28%)和变形菌门(9.13%)。与前人报道类似,张俊华等的研究发现宁夏某养殖场蛋鸡粪便优势菌群主要由厚壁菌门、变形菌门、拟杆菌门组成;Schreuder等的研究报道蛋鸡粪便中门水平的相对丰度主要是厚壁菌门(40.0±0.9)%和拟杆菌门(45.5±0.9)%。另外,朱见深等的研究发现蛋鸡粪便菌群主要由厚壁菌门、变形菌门、拟杆菌门及Actinobacteria组成。
尽管主要菌群组成相似,但是相对丰度仍有差异,可能与喂料有关。本研究蛋鸡样品中梭杆菌门的丰度(14.28%)高于肉鸡样品(2.59%),在其他研究者的研究结果中未见到类似的梭菌丰度。另外,两个肉鸡场样品的拟杆菌的平均丰度(0.16%、7.90%)低于三个蛋鸡场(16.08%、11.16%、13.74%)。拟杆菌属参与许多重要的代谢活动,包括碳水化合物的发酵,肠上皮细胞中关键糖酵解酶的诱导,含氮物质的利用,胆汁酸的生物转化和病原体增殖的预防。已有研究表明鸡的饮食成份会影响肠道菌群,特别是消化道下端,喂高纤维和低脂类的饲料会增加拟杆菌门的丰度,而低纤维和高脂肪饲料则会增加鸡肠道菌群中厚壁菌门的丰度。Cesare等研究发现,饲喂低蛋白饮食会使肉鸡盲肠中大多数放线菌门的丰度增加,而厚壁菌门和变形菌门丰度降低。另外,益生元复合物经常被作为添加剂添加到饮用水或者饲料中,以促进畜禽肠道发育。据报道,甘露寡糖通常存在于酵母细胞壁中,可改变家禽肠道的微生物组成。Jung等证明了益生元刺激双歧杆菌的活性并改变了肉鸡的肠道菌群。本研究中,蛋鸡TT养殖场在喂养鸡的饲料中添加了壳聚多肽,结果其鸡粪样品中的厚壁菌门丰度高于本实验中其他两个蛋鸡场。这与前人的报道类似,如Shang等的研究也表明益生元相关复合物能够增加厚壁菌门的丰度。以上研究说明菌群差异与蛋鸡和肉鸡的饲料和添加剂相关。
鸡粪菌群结构及多样性差异还可能与养殖环境有关,可变因素较多。畜禽养殖场的生物气溶胶中含有微生物,可通过空气传播,养殖场的卫生条件、消毒方式、通风情况等均会影响养殖场的气溶胶。高敏等的研究发现蛋鸡舍内生物气溶胶浓度大于肉鸡,可能与消毒方式有关,蛋鸡场消毒时一般鸡在舍内,很难消毒完全,肉鸡一般在鸡出栏后进行消毒,消毒较为彻底,降低了残留细菌的传播风险。刘夏阳等的研究可印证这一观点,同一个养殖场,蛋鸡感染致病菌的概率大于肉鸡。此次研究中,蛋鸡粪便中菌群多样性高于肉鸡,可能与此有关。另外,本研究发现肉鸡中螺杆菌具有较高丰度,而它作为一种人畜共患病微生物,与十二指肠溃疡,胃溃疡,胃癌相关。肉鸡场(FY和TL)采用散养模式,可能会促进螺杆菌的传播,具有人畜共患微生物的传播风险。
4 结 论
此研究对浙江省部分地区蛋鸡和肉鸡粪便进行了16S rDNA扩增子高通量测序和分析,结果表明蛋鸡与肉鸡菌群差异较大,且蛋鸡粪便中的微生物多样性高于肉鸡,可能是与蛋鸡和肉鸡的饲养环境、饲养方式等因素有关,可为科学饲养和粪便废弃物利用提供思路。

