猪源大肠杆菌的分离鉴定及耐药性分析
何金娇,毛雪飞,孙国鹏,马萌萌,张 灵,吴云舟
(1.新乡学院 生命科学与基础医学学院,河南 新乡453003;2.东北农业大学 生命科学学院,黑龙江 哈尔滨150030)
大肠杆菌()是兽医临床上最常见的导致动物细菌感染的病原菌之一,亦是人及动物的肠道共生菌,其发病率和死亡率位于仔猪之首。随着我国养猪的规模化发展,大肠杆菌病逐渐由条件性疾病演变为常发性疾病,严重阻碍了养猪业的快速发展。在疾病的防治过程中,抗生素的大量使用导致了菌株耐药性的产生,目前出现了一种细菌耐多种药物的情况,而且大肠杆菌的耐药性也越来越严重。大肠杆菌耐药性机制的产生以及如何减少细菌耐药性,已经成为人们越来越关心的问题。目前,国内外对细菌耐药性的研究不仅仅停留在表型上,已经开始对耐药基因进行分子水平的研究。从分子层面研究细菌耐药性,能够更深入的揭示细菌的耐药机制和传播途径,更好的控制耐药菌株的产生和传播,为临床兽医用药和新药的研发提供科学基础和理论依据。本研究对河南省新乡市某规模化猪场进行大肠杆菌的分离鉴定、耐药性分析和耐药基因检测等初步研究,为深入研究耐药性及其机制、指导临床合理用药和防治猪源大肠杆菌病提供了一定的科学依据。
1 材料与方法
1.1 样品
2018年9~12月份从河南省新乡市某规模化猪场采集腹泻猪的肛门棉拭子。大肠杆菌标准菌株(ATCC 25922)购自中国兽药监察所。
1.2 主要试剂及引物
氨苄西林、万古霉素、复方新诺明、氯霉素、四环素、庆大霉素和左氧氟沙星等药敏纸片,伊红美蓝琼脂培养基和麦康凯琼脂培养基均购自杭州微生物试剂有限公司;细菌DNA提取试剂盒和革兰氏染色试剂盒均购自北京索莱宝科技有限公司;DL2000 DNA marker、Taq DNA聚合酶等,购自TaKaRa公司。
以GeneBank中查找的相关序列为模板,通过primer 5.0软件设计大肠杆菌16S rRNA,查找文献获得磺胺类1、喹诺酮类(6') --、-内酰胺类、四环素类、氨基糖苷类(3')-Ⅱ、多肽类-1、氯毒素基因的引物,送至上海英骏生物技术有限公司进行合成。序列如表1所示。
1.3 细菌的分离纯化
将无菌条件下采集的肛门拭子接种于营养肉汤中,37 ℃恒温振荡培养24 h后,涂布于伊红美蓝琼脂培养基,置37 ℃培养箱中培养12 h,挑取紫黑色并带有金属光泽的单个菌落,通过平板划线法将其再次接种于伊红美蓝琼脂培养基中进行纯化。从中挑取紫黑色并带有金属光泽的单菌落,然后通过平板划线法接种于麦康凯培养基,观察是否全是粉红色菌落。从中挑取特征明显的菌落划线于麦康凯培养基进行再次纯化,经革兰氏染色后于光学显微镜下观察细菌的染色情况和形态特征。
1.4 细菌的生化鉴定
制备生化鉴定培养基,将疑似大肠杆菌分离菌株接种于葡萄糖培养基、乳糖培养基、细菌微量生化鉴定管(三糖铁琼脂实验)进行鉴定。以大肠杆菌质控菌株ATCC25922作为对照。

表1 引物序列Table 1 Primer sequences
1.5 分离菌株的分子鉴定
在无菌条件下,将本实验所分离的各株大肠杆菌疑似菌株接种于LB培养基,培养12 h。然后按照细菌DNA基因组提取试剂盒说明书,提取大肠杆菌的基因组DNA,置于-20 ℃保存备用。
为了进一步确定分离菌株的类型,以基因组DNA为模板,采用表1中的相关上游和下游引物,扩增16S rRNA,并将ATCC25922作为阳性对照。PCR反应体系10 μL:Taq DNA 聚合酶 0.5 μL、10×PCR Buffer 1 μL、dNTPs 1 μL、上、下游引物各为1 μL、基因组DNA 1.5 μL、ddHO补至10 μL。反应条件为: 94 ℃预变性5 min,94 ℃变性1 min、退火温度为56 ℃、72 ℃延伸1 min,20个循环,72 ℃终延伸10 min,4 ℃保存。经1%琼脂糖凝胶电泳后,于凝胶成像系统中观察并拍照。并将扩增后的16S rRNA送上海英骏生物技术有限公司测序。
1.6 药敏试验
利用K-B法,对大肠杆菌进行药物敏感性试验。将鉴定后的大肠杆菌接种于LB培养基进行活化,然后将0.5麦氏浊度大肠杆菌纯培养物均匀地涂布在LB琼脂培养基上,室温下放置数分钟后,再用无菌镊子夹取药敏纸片,均匀贴在LB琼脂培养基上,培养18 h后观察并测量抑菌圈大小。以ATCC25922作标准质控菌株。判定标准:抑菌圈直径≥20 mm时,为极度敏感;15 mm≤抑菌圈直径≤20 mm时,为高度敏感;10 mm≤抑菌圈直径≤15 mm时,为中度敏感;0 mm≤抑菌圈直径≤10 mm时,低度敏感;抑菌圈直径=0 mm时,为不敏感或耐药。
1.7 耐药基因检测
以基因组DNA为模板,分别采用已合成的上游和下游引物,对分离鉴定后大肠杆菌的耐药基因进行PCR检测。PCR反应体系10 μL:Taq DNA 聚合酶 0.5 μL、10×PCR Buffer 1 μL、dNTPs 1 μL、上、下游引物各为1 μL、基因组DNA 1.5 μL、ddHO补至10 μL。反应条件为: 94 ℃预变性5 min,94 ℃变性1 min、退火1 min、72℃延伸1.5 min ,30个循环,72 ℃终延伸10 min,4 ℃保存。检测的耐药基因及其退火温度如表1所示。
2 结果与分析
2.1 细菌生长情况
混合菌涂布后,经37 ℃恒温培养18~24 h后,在伊红美蓝琼脂培养基上可以观察到带有紫色金属光泽,直径约为1 mm左右的边缘整齐光滑的菌落(图1A)。然后再通过平板划线法将初步筛选到的菌落接种于麦康凯培养基上,经37 ℃恒温培养18~24 h后,在麦康凯琼脂培养基上可以观察到圆形、边缘整齐、表面光滑湿润、直径约为1 mm左右的呈红色或粉红色凸起的菌落(图1B)。挑取经两次纯化培养后的菌株,进行革兰氏染色,在光学显微镜下可观察到试验菌株为革兰氏阴性菌,形态呈卵圆形短小杆菌,可初步鉴定为疑似大肠杆菌(图2)。
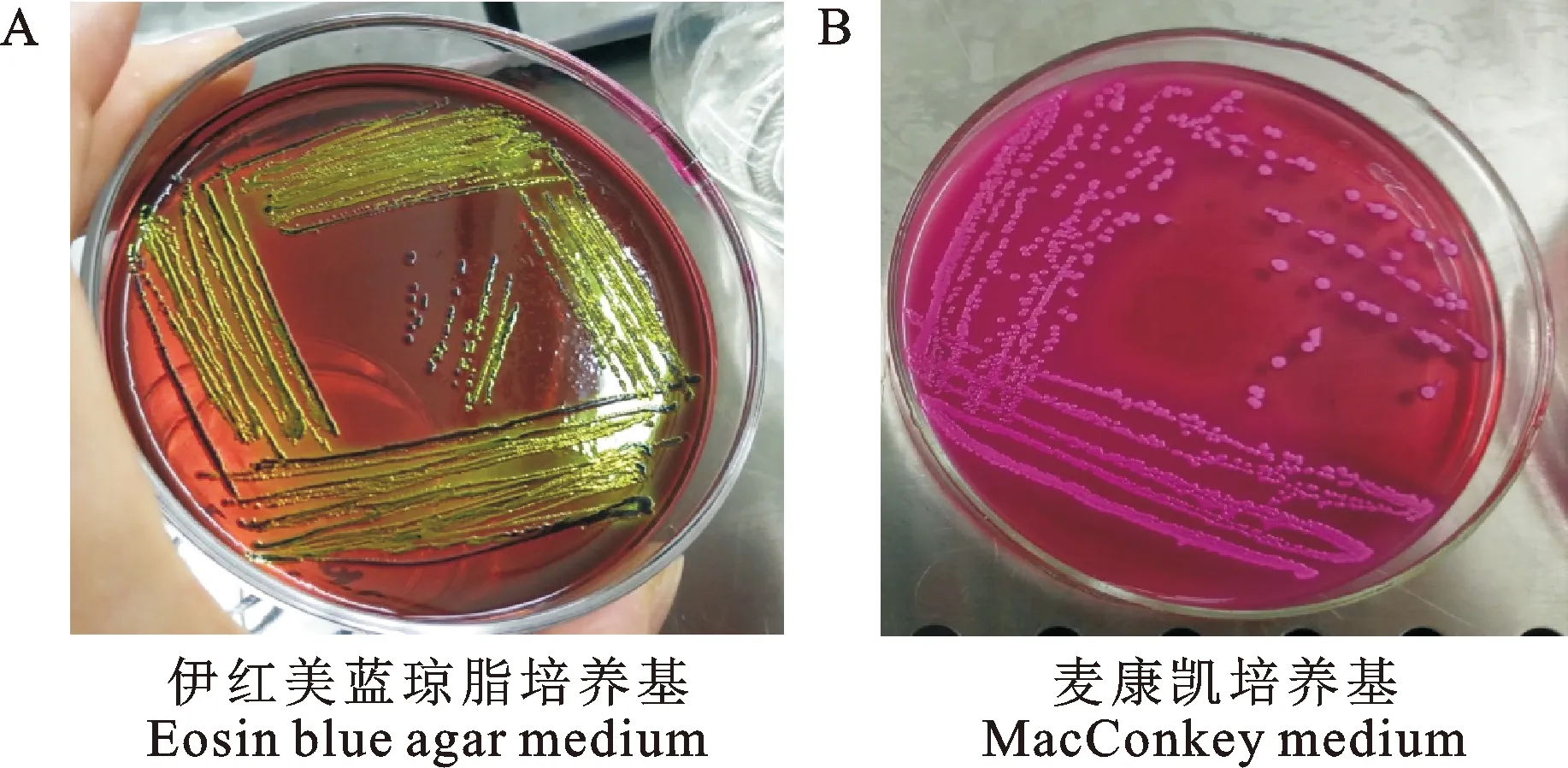
图1 纯化菌株的菌落形态Fig.1 Colony morphology of purified strains
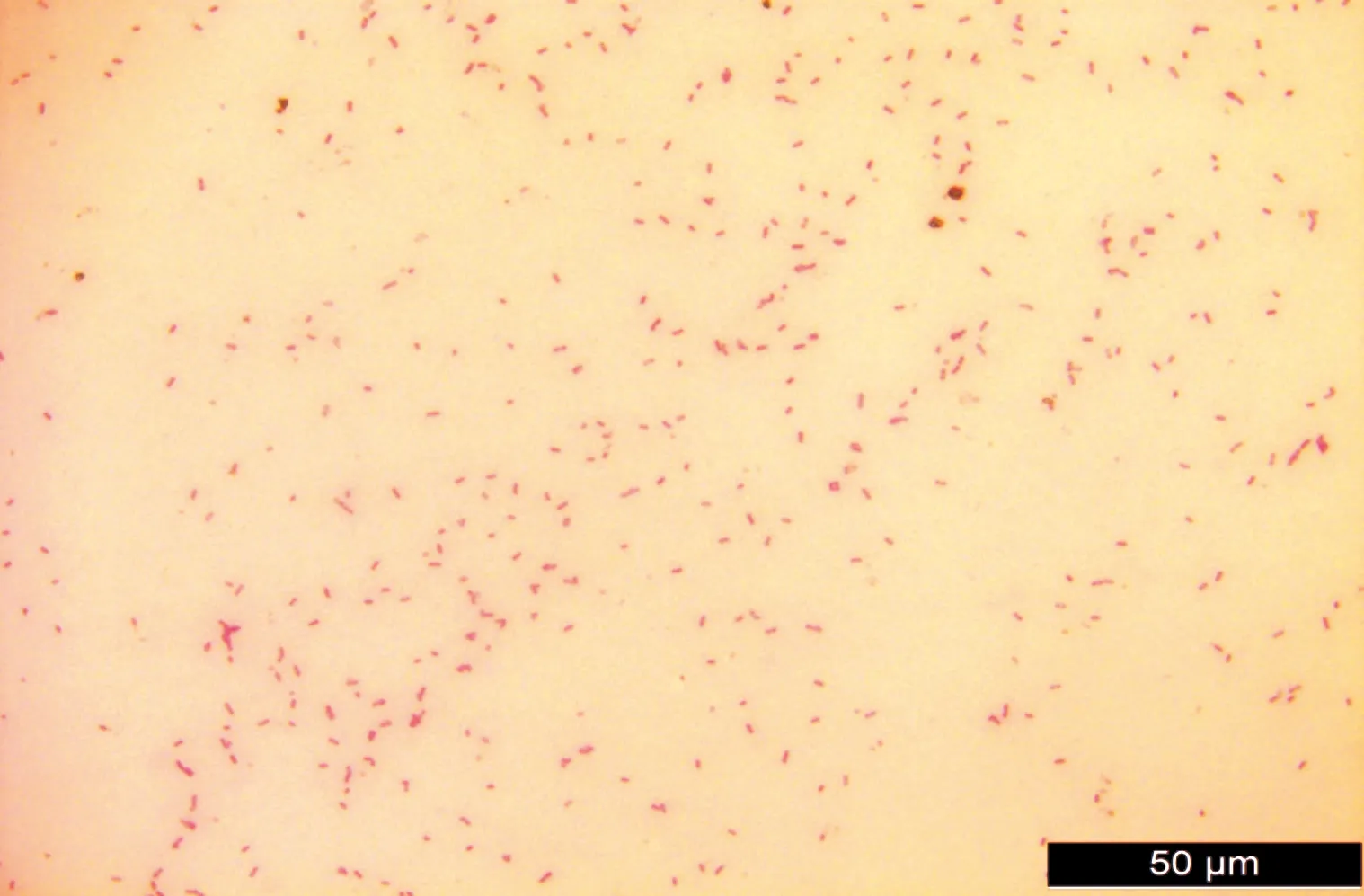
图2 分离菌株的革兰氏染色(40×)Fig.2 Gram staining of isolated strains (40×)
2.2 细菌的生化鉴定结果
将各分离菌株进行生化试验,通过观察发现分离的15株大肠杆菌疑似菌株均能发酵葡萄糖、乳糖产酸产气,呈阳性。且不产生HS,呈阴性,符合大肠杆菌的生化特性。
2.3 菌株的分子鉴定
分离的大肠杆菌疑似菌株经形态学、生化特性鉴定后的分离菌株,进行特异性16S rRNA的PCR扩增,扩增产物的凝胶电泳检测结果如图3所示,所扩增出的片段均为大小约为1 450 bp的片段,符合目的基因片段的长度大小,与设计引物目的基因片段大小相似,测序结果与16S rRNA(登录号:NR_024570.1)经DNAMAN比对分析同源性为99.04%。进一步确认了所分离的菌株为大肠杆菌。
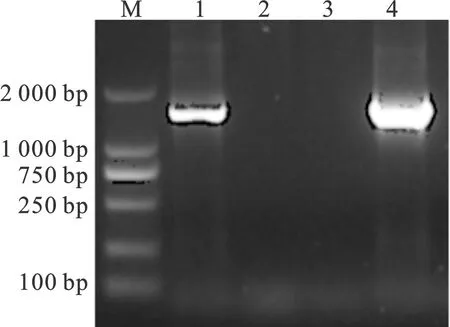
图3 纯化菌株的16S rRNA的PCR鉴定M. DL2000 DNA marker; 1. PCR鉴定;2~3. 阴性对照;4. 阳性对照Fig.3 PCR identification of 16S rRNA of purified strainsM. DL2000 DNA marker; 1. PCR identification;2~3. Negative control; 4. Positive control
2.4 药敏试验结果
由表2可知,15株大肠杆菌对氨苄西林、万古霉素、复方新诺明、氯霉素、四环素的耐药率均达到了100%,对庆大霉素的耐药率达到了60.0%,对左氧氟沙星的耐药率达到了26.7%,其中标准质控菌株则对所测试的抗生素大部分表现敏感。总体来看,该规模化猪场分离出的15株大肠杆菌无一株完全敏感,对β-内酰胺类、四环素类、磺胺类、多肽类和氯霉素类具有普遍的耐药性,临床上应尽量少使用或不使用这5种药物,对喹诺酮类和氨基糖苷类抗生素均具有较高的敏感性。
大肠杆菌多重耐药指数(MARI)的公式为A/BC,其中A是细菌总抗菌药物耐药值,B是检测时所使用的抗菌药物的数目,C是所进行检验的菌株数,MARI取值范围为0~1,MARI的数值越大,说明多重耐药的水平越高。在此次试验中,A为73、B为7、C为15,MARI为0.695。说明此次试验中分离菌株的多重耐药性较高,应引起养殖厂的重视。
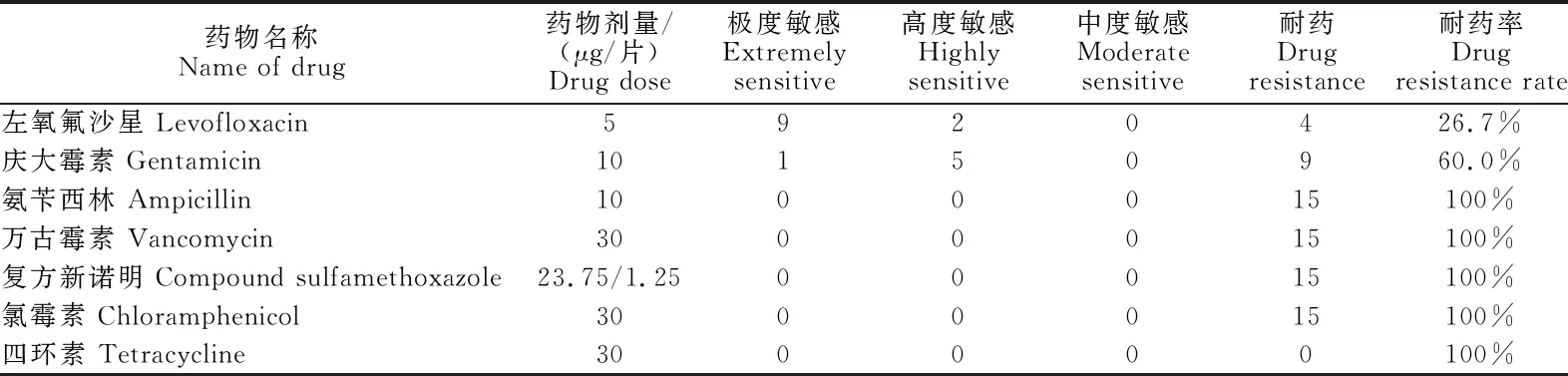
表2 15株大肠杆菌对7种抗菌药物的药敏试验结果Table 2 Susceptibility results of 15 strains of E. coli against 7 antimicrobial drugs
2.5 耐药性基因的PCR扩增
15株大肠杆菌分离菌株耐药基因的PCR检测结果汇总如表3所示,检出率最高的为氯霉素类的floR基因(100%),其次是β-内酰胺类的基因(80.0%),四环素的基因(26.7%),表明这些耐药基因可能是导致大肠杆菌对相应抗生素产生耐药的原因。
由于大肠杆菌在对某一种药物产生抗性继而发生基因突变时,突变的方向是不确定的,所产生的抗性基因是多种多样的,因此所带有的抗性基因并不是唯一的。在此次试验中对复方新诺明、万古霉素、左氧氟沙星、庆大霉素药物出现了100%抗性,而未检验出相应的1、-1、(6')--、(3')-Ⅱ基因,可能是因为检测的大肠杆菌所含的抗性基因为2、3、-2、-3、(3)-Ⅱ、中的一种,而不是此次试验所检测的1、-1、(6')--、(3')-Ⅱ基因。
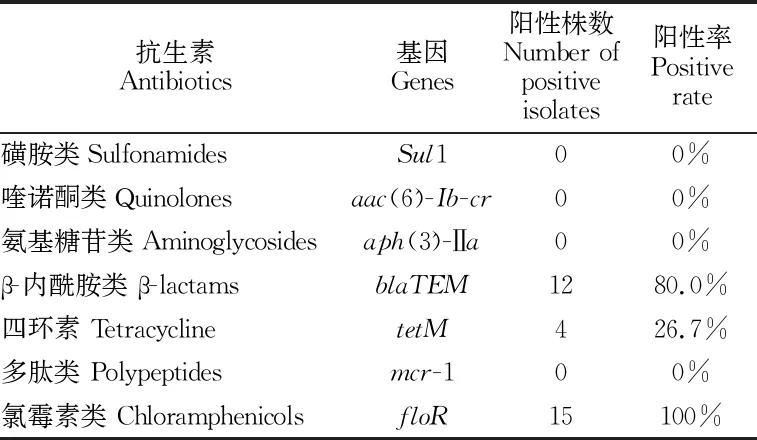
表3 大肠杆菌分离菌株的耐药基因分布率Table 3 Distribution of drug resistance genes of E. coli isolates
3 讨 论
细菌耐药性(AMR)已成为当代医学和制药公司面临的一个严重问题。耐药菌感染数量的增加已经严重威胁全球公共健康,其发病率和致死率均很高。任何治疗剂的成功使用都会受到从首次使用时起对该抗菌药物可能产生的耐受性或耐药性的影响。抗生素作为20世纪最重要的医学发现之一,在食源性动物疾病治疗中发挥了不可替代的作用。据统计,2010年,牛、鸡和猪每生产1 kg,动物的全球平均年抗菌药物消费量分别为45 mg/kg、148 mg/kg和172 mg/kg。2010年至2030年,全球抗菌药物消费量将增长67%,对中国来说,抗菌药物消费量的增长将达到99%。
此外我国猪源性食品总消费量和人均消费量居世界首位。猪源性食品的质量安全和养猪业的可持续健康发展与我们的健康密切相关。在养猪生产中,使用抗生素的过程中不仅杀灭了致病菌,也破坏了原有的正常菌群,长期使用造成了药物残留及耐药性的产生。大肠杆菌是人类和动物肠道中的主要栖居菌,从个体出生后即进入肠道,并终生携带。其耐药性的不断出现,以及耐药基因的交叉出现必然会导致以后疾病防治的困难。因此,为了避免新耐药菌株的产生,研制抗生素替代品已成为必然,否则必将导致大肠杆菌的耐药情况越来越严峻,对人类与动物的健康造成巨大威胁。
陈慧敏等从河南省不同地区采集腹泻死亡仔猪分离鉴定出8株致病性大肠杆菌,通过K-B法测定8株大肠杆菌对21种抗菌药物的耐药性。李金朋等研究表明,大肠杆菌对氨苄西林、氨曲南、庆大霉素、卡那霉素、利福平和克林霉素耐药,其中92.41%的大肠杆菌表现为多重耐药。张炳亮等研究表明,23株致病性大肠杆菌对抗生素类药物均有不同程度的耐药性,其中对青霉素、红霉素、四环素、卡那霉素、多西环素、氟哌酸、氨苄西林等7种抗生素的耐药性较强,且均在70%以上。而此次实验大肠杆菌的MARI为0.695,说明大肠杆菌的多重耐药性已较为严重。
耐药基因可通过质粒、整合子、转座子等移动元件在不同细菌间传播,也可在动物、人和环境间传播。细菌一旦获得耐药基因,就可以使相应的抗菌药失效,而当其获得多种耐药基因时,就会使该细菌引起的疾病变得难以救治。本试验从河南省新乡市某规模化猪场中分离了15株大肠杆菌,检测出氯霉素类基因(100%),β-内酰胺类基因(80.0%),四环素基因(26.7%)。与张明亮等对豫北地区大肠杆菌耐药基因的检测结果β-内酰胺类基因(100%),彭珂楠等对四川地区大肠杆菌耐药基因检测结果氯霉素类基因(81.82%)结果相近,说明大肠杆菌对氯霉素类及β-内酰胺类抗生素产生抗性已经是一个较为普遍的现象。从产生抗性的机理方面来说,β-内酰胺类耐药基因,通过表达β-内酰胺酶消减了β-内酰胺类抗菌药的杀菌作用;四环素类耐药基因,与细菌的核糖体结合,从而干扰细菌蛋白质的翻译来发挥抗菌药的作用;氯霉素类耐药基因通过特异/非特异的外排泵基因编码的外排泵系统使细菌获得耐药性。
本研究从大肠杆菌耐药率的方面揭示了新乡市养猪场抗生素的使用情况,对养猪场抗生素的使用提供了一定的理论基础及方向。通过对大肠杆菌携带耐药基因的基因型进行分析鉴定,为新乡市大肠杆菌耐药性产生的分子机理研究提供了参考,也为该病的临床治疗奠定了基础。

