硅/金属氧化物复合负极材料研究进展*
唐 梦,王 帅,吴沁宇,马扬洲,宋广生
(安徽工业大学 材料科学与工程学院,安徽 马鞍山 243032)
0 引 言
从太空船到深海潜水器以及普通电子产品,锂离子电池(LIB)已成为人类发展和生活中不可或缺的一部分[1-3]。自1970年提出并于1991年商业化以来[4],锂离子电池一直在追求更高的能量密度,更长的循环寿命,更高的安全性和耐用性。由于商用石墨阳极材料的容量低,导致能量密度提高受限,因此开发高容量的阳极材料显得尤为重要。在众多候选材料中,硅材料具有高理论容量(Li15Si4为3579 mAh/g)[5],因此受到学术界和商业界的广泛关注。然而硅负极在循环过程中存在巨大的体积膨胀[6]并伴随应力和应变的产生,这导致了许多严重的后果,例如引起硅负极材料的机械粉化[7]、连续生成不稳定的固体电解质膜(SEI)以及循环稳定性差等。同时硅材料固有电导率低[8],限制了锂离子在高电流密度下的传输。面对硅负极材料的电化学反应动力学低迷,人们提出了许多解决问题的方法,如图1所示硅的纳米化,新型电解液添加剂以及对硅材料进行表面包覆等方面进行改性提升。其中,包覆是对硅表面改性的有效手段之一,包覆的作用在于能够避免硅基体同电解液直接接触,形成更加致密的SEI膜同时有效缓解硅在(去)锂化中的体积膨胀;此外,包覆层还应具有良好的导电性,能够维持电极的完整性。因此,不少研究者把目光集中在表面包覆上,除了用石墨、石墨烯等碳源进行包覆之外,研究者们还发现金属氧化物也可用作包覆材料,将这类物质作为表面涂层与硅复合,用作锂离子电池负极材料,从而提高硅材料的电化学性能。

图1 阳极材料面临的挑战和解决措施[9-12]Fig.1 Challenges and modification strategies of Si-based anode materials[9-12]
然而,由于硅颗粒的刚性结构,传统的核-壳纳米结构中的单层金属氧化物或碳涂层都不足以承受硅颗粒的巨大体积变化,在长循环过程中容易发生断裂。因此,研究者们为了保证核-壳纳米结构在循环过程中的完整性,采用双涂层策略制备硅复合材料。此外,硅还和部分金属氧化物发生原位反应,利用生成的陶瓷相[41]以及置换出金属单质(Sn、Co等)对硅材料进行包覆,不仅可以充当缓冲层还增强了电荷传导。
本文总结了硅的电化学特性和储锂机制,对近几年硅/金属氧化物作负极材料,着重从金属氧化物对硅进行表面改性以及与之发生原位固态反应制备负极材料这两方面的合成和性能进行归纳和分析,并阐述了用金属氧化物改性硅负极材料尚待解决的问题和未来发展趋势,旨在研发新型硅基负极复合材料,提高动力锂离子电池的能量密度。
1 Si的储锂机制
充分了解硅负极材料的储锂机制和电化学储锂特性对提升其电化学性能有重要意义。硅材料的储锂机制不同于层状结构的石墨,是通过锂离子的嵌入和脱出进行的。图2a为Limthongkul等[13]通过热力学计算所得到的Li-Si合金相图,从图中可以看出生成了Li12Si7、Li7Si3、Li13Si、Li22Si5等嵌锂化合物[14-15]。图2(b)为硅材料的脱嵌锂曲线,黑色代表理论上高温条件下,随着嵌锂量的多少形成不同的锂硅合金;绿色和红色代表硅在室温下的充放电曲线,在第一次嵌锂过程中,嵌锂电位约为0.1 V,电位是一条很长的电位平台,在此过程中Li+进入硅晶格中发生合金化反应即生成亚稳态非晶相;在首次脱锂电位约为0.4 V,也表现为一条较长的电位平台。但是在之后的脱嵌锂过程中,长的电位平台消失,仅存在于首圈。研究表明,硅的结晶程度能够影响充放电曲线的形状,晶体硅在第一次锂化过程中经历了从晶体到非晶的相变,之后保持非晶状态。
Si嵌锂/脱锂过程可以描述如(1)、(2)、(3)所示:
嵌锂过程:
Si(crystalline)+xLi++xe-→LixSi(amorphous)
(1)
LixSi(amorphous)+(3.75-x)Li++ (3.75-x)e-→Li15Si4(crystalline)
(2)
脱锂过程:
Li15Si4(crystalline)→Si(amorphous)+yLi++ye-+Li15Si4(residual)
(3)

图2 (a) Li-Si合金相图[16];(b) 硅材料的脱嵌锂曲线[17]Fig.2 Li-Si phase diagram[16] and lithiation/delithiation curves of Si[17]
Obrovac M N等[18]通过原位XRD、原位TEM对硅负极在锂化/脱锂过程中的结构变化进行研究。嵌锂过程,当嵌锂电位大约60 mV时发生晶体硅转变为非晶Li15Si4(a- Li15Si4),但当嵌锂电位在60 mV以下,无定型的锂硅合金立即转变为Li15Si4晶体相 (c- Li15Si4),即富锂合金相。脱锂过程,c- Li15Si4转变成a-Si而不是c-Si。在随后的循环过程中,只有a-Si和c- Li15Si4之间的相转变。通过对Si纳米线锂化过程的相变研究,a- Li15Si4到c- Li15Si4的转变是自发的、一致的过程,不存在原子扩散或相分离现象。如果电极在70 mV以上循环,则可以避免c- Li15Si4的形成。c- Li15Si4先于其他化合物产生的原因在于其与a- Li15Si4在电子结构上的相似性。
2 硅/金属氧化物复合处理
2.1 表面包覆
由于硅的体积效应造成活性材料的粉化,难以形成稳定的SEI膜,破坏其导电网络,至今仍然在工业层面上没有得到进一步发展。在众多的解决措施中,表面改性[19-21]是一种有效提高硅电极电化学性能的方法,采用表面改性的材料主要有碳材料、金属、金属氧化物以及高分子聚合物等。其中金属氧化物做硅表面涂层因其优异的性能而受到越来越多的关注。金属氧化物层(Al2O3,TiO2,SnO2,等)通常包覆在Si颗粒表面,由于其绝缘性能和较高的介电性能,可作为人造SEI膜,不仅抑制了Si材料表面固体电解质膜的形成,而且缓解了硅颗粒在循环过程中的体积膨胀,保持了电极结构的稳定性。
早期研究主要集中在TiO2和Al2O3。2010年,Kim B E等[22]首次报道了以TiO2作为包覆层,通过改性溶胶-凝胶反应法合成Si@TiO2复合材料。在本研究中,通过在Si表面包覆多孔TiO2层,缓解了Si的体积变化,从而提高了循环性能。之后,Jiao X W等[23]通过溶胶-凝胶法和镁热还原法合成了含有中空结构的HN-Si@aTiO2纳米球,制备过程如图3(a)所示。复合材料表现出较高的容量性能和优异的循环稳定性。当电流密度为1 A/g时,纳米复合材料的初始比容量为2 804.6 mAh/g,ICE为78.47%循环100次后的放电容量为1 196.3 mAh/g。同时,HN-Si@aTiO2电极在5 A/g下循环500次后,仍具有524.6 mAh/g的高容量。显然,aTiO2外壳通过提供机械支撑和形成稳定的SEI膜改善了阳极材料的循环稳定性。中空结构有助于减轻在锂化过程中产生的机械应力。由于形成良好的结构,HN-Si@aTiO2电极具有优异的速率性能,如图3(c)所示,电流从低到高再恢复至低电流时,复合材料的可逆容量达1 698.7 mAh/g,表明HN-Si@aTiO2是高度可逆的。
作为另一种常用的涂层材料Al2O3,因其在缓解电解质副反应和改善电极结构和循环稳定性等方面发挥重要作用而备受关注。Fu L等[24]通过简单的溶剂热法和退火工艺成功合成表面覆有花瓣状Al2O3和充满硅颗粒的松果状碳微球,具体制备过程如图3(d)。研究结果表明:在80 ℃下,以0.5 A/g的电流在0.01~3 V循环(图3e),首次充放电比容量分别为2 576.4和2 923.6 mAh/g,初始库伦效率为88%,高于工业硅纳米球(~70%)。在如此低的电流密度下被激活70次后,将电极置于5 A/g的大电流密度下循环。电极在第90次循环后的可逆容量先降低到687 mAh/g,然后开始迅速提高,最后在第1 000次循环时达到1 405 mAh/g,库仑效率高达99%以上。Si@C@ Al2O3复合材料电化学性能的改善与其独特的结构密切相关,碳层和外层带有孔隙的Al2O3双重涂层的出现,防止了硅与电解液的副反应,缓解了硅在锂化/锂化过程中严重的体积膨胀;该结构中超薄的二维Al2O3纳米片和纳米结构的硅/碳微球之间的空隙,提供了超短的离子扩散和电子传输路径,从而增强了锂离子的存储动力学。

图3 (a) HN-Si@aTiO2纳米球制备工艺示意图;(b) HN-Si@aTiO2在5 A·g-1电流密度下的长期循环性能;(c)HN-Si和HN-Si@aTiO2的速率性能[23];(d)Si@C@Al2O3样品的合成过程示意图;(e) Si@C@Al2O3电极在5 A/g、80 ℃下的循环性能;(f) Si@C@Al2O3电极的速率性能[24]Fig.3 (a) Schematic illustration of the HN-Si@aTiO2 nanosphere fabrication process; (b) long-term cycling performance of HN-Si@aTiO2 at a current density of 5 A/g; (c) rate capabilities of HN-Si and HN-Si@aTiO2[23]; (d) schematic illustration of the synthesis process of Si@C@Al2O3 sample; (e) cycling performances of Si@C@Al2O3electrode at 5A/g at 80 ℃;(f) rate performances of Si@C@Al2O3 electrode[24]
Casino S[25]等报道采用反应溅射法在纳米硅的表面沉积一层Al2O3涂层,结果表明,与目前最先进的石墨基电池[26]相比,使用200 nm硅颗粒包覆5 nm Al2O3涂层作为阳极材料,可以使电池的能量密度和比能提高17%。事实上,在有Al2O3涂层的硅锂离子电池每循环的容量衰减率比未涂层的情况下降低了64%,比有碳涂层的[27]情况下降低了29%。因此,在改善硅薄膜锂离子电池容量衰减行为方面,Al2O3涂层比碳涂层更能有效降低活性材料损失。
Chen Y[28]他们课题组提出了一种以天然硅铁矿石为原料,采用熔融纺丝、球磨和脱合金工艺制备多孔Si/Fe2O3双网状复合材料的新工艺,该复合材料中含有大量的中孔结构,包括低容量Fe2O3网络和大容量Si网络。由于这种特殊的多孔结构,BM-48-4阳极具有良好的锂离子存储性能,在200 mAh/g循环100次后可提供697.2 mAh/g的可逆容量,从Si/Fe2O3阳极循环100次后的SEM图中可以看出电极能够保持原有的纳米片和纳米颗粒的结构(具有局部团聚),因此具有较好的结构稳定性。Yan Y等[29]同样的采用球磨、熔融纺丝和脱合金相结合的工艺,制备了Si/Fe2O3锚定的rGO框架。作为锂离子电池(LIB)的负极,在5 A/g的电流下200次循环后的可逆容量为1 744.5 mAh/g, 500次循环后的可逆容量为889.4 mAh/g。
Wang G[30]等通过溶剂热合成方法成功制备了以晶硅为核,非晶态氧化铌为壳的核壳Si@Nb2O5复合材料。如图4所示优越的电化学性能表现为:80次循环的比容量保持在2 256.4 mAh/g,CE保持约99%,显示了优越的长期稳定性,同时电极在1.5 A/g的电流密度下80次循环仍有754 mAh/g,显示了优异的倍率性能。结果表明,Nb2O5作为壳层在维持锂化和脱锂过程中电化学稳定性方面起着重要作用。

图4 (a)得到的Si纳米粒子和Si@Nb2O5复合材料的XRD谱图;(b) EDS谱图;(c)合成的Si@Nb2O5复合粒子的元素分布(d) Si@Nb2O5纳米复合材料前三个周期的电流-电压;(e)在第1、5、30和50个循环中的放电曲线;(f)在电流密度为200 mA/g时的充放电容量,库仑效率;(g)Si@Nb2O5电极在电流密度分别为200、750和1500 mA/g时的循环性能[30]Fig.4 (a) XRD pattern of Si nanoparticles and Si@Nb2O5 composites obtained;(b) EDS pattern; (c) elemental mappings of the as-synthesized Si@Nb2O5 composite particle;(d) current-voltage for the first three cycles of Si@Nb2O5 nanocomposites; (e) discharge curves in the 1st, 5th, 30th and 50th cycles; (f) charge and discharge capacity and Coulomb efficiency at current density of 200 mA/g; (g) cycling performance of Si@Nb2O5 electrode at current densities of 200, 750 and 1500 mA/g, respectively[30]
Kawade U V等[31]利用环戊二烯基反键轨道中存在的两个未配对电子,在低温条件下,利用双(环戊二烯基)镍(II) (C10H10Ni)在硅纳米片上均匀装饰了氧化镍(NiO)纳米粒子(15~20 nm),制备过程如图5(a)。在此研究中,他们采用不同质量比的NiO和Si制备了Si@NiO纳米复合材料。其中,SNO2(1∶1)复合材料的电化学性能最优。研究表明,初始放电容量为2 507 mAh/g,ICE为86%,此外电极具有较长的循环寿命,在400 mA/g的电流下循环500圈容量仍有1 260 mA/g。结果表明,最佳NiO浓度有利于锂离子的吸附,有利于锂离子向活性位点的迁移。长循环稳定性也证明了NiO成功地抑制了硅的结块生成。同时,NiO纳米颗粒增强了电极的机械稳定性,这可能有助于防止硅在重复(去)锂化过程中因体积膨胀而开裂。
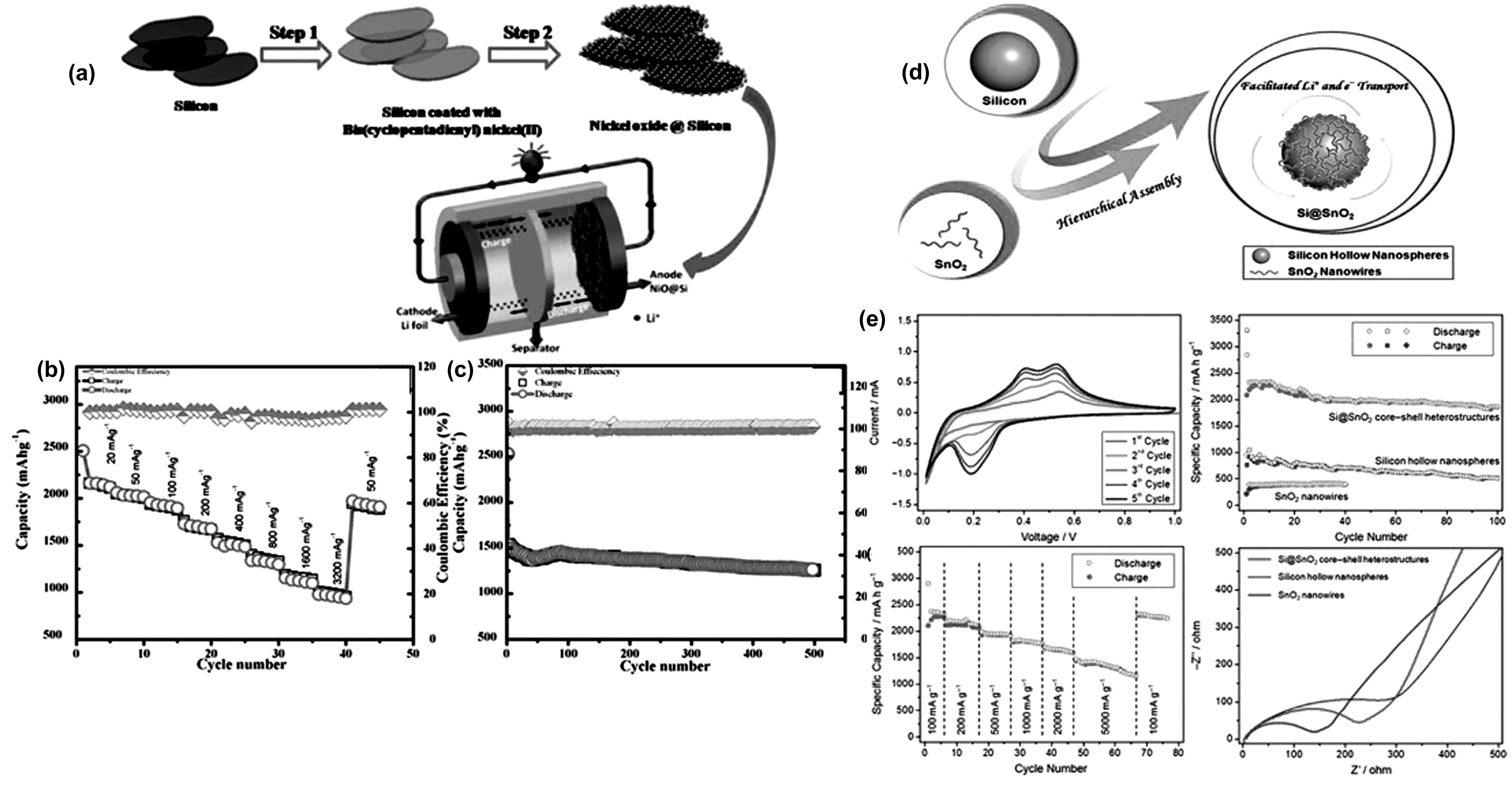
图5 (a)NiO@Si电极的制备示意图;(b)NiO@Si在不同电流密度下的速率性能; (c)NiO@Si在0.01 ~ 3 V的循环性能[31];(d)Si@SnO2核-壳结构的制备;(e)Si@SnO2电极的CV曲线、循环性能、倍率性能、阻抗图[32]Fig.5 (a) Schematic diagram of preparation of NiO@Si electrode; (b) NiO@Si rate performance at different current densities;(c) NiO@Si in 0.01~3 V cycle performance[31]; (d) preparation of Si@SnO2 core-shell structure; (e) Si@SnO2 electrode CV curve cycle performance ratio performance impedance diagram[32]
Zhu J等[32]研究了具有优异电化学性能的Si@SnO2负极材料。材料的形貌表明,SnO2均匀地覆盖在硅材料表面,涂层能有效地缓解硅材料的体积膨胀[33-34]。复合材料的整体结构为链状或支状结构,链状结构形成提高了导电率,保持了结构的完整性,缩短了扩散路径[35-36]。在第一次循环中,包覆在硅表面的SnO2转化为Sn和Li2O,Sn可以有效地改善硅材料的低导电性。通过EIS分析发现,经过200次循环后,电池的总电阻比纯硅电池的电阻降低了近46.53%。Si@SnO2和纯硅电极的循环性能如图5(e)所示。在第一个循环中,Si@SnO2电极的放电比容量为3 239 mAh/g ,高于纯Si的2 783 mAh/g,相对ICE分别为84.1%和67.6%。并且,在电流密度为0.2 A/g的情况下,Si@SnO2电极的第200次循环的可逆放电比容量为1 926 mAh/g。Zhou Z W等[37]针对硅的两个固有缺陷(体积膨胀大、固有电导率低),提出了一种用二氧化锡纳米线装饰硅空心纳米球的简易自组装方法,如图5d,通过这种互补的方式将二者的功能连接起来。纳米空心硅不仅能够提供更大的容量,还可以适应部分的体积膨胀;SnO2纳米线具有较高的导电性,可作为导电涂层,实现高效、连续的单向电子传输,从而提高硅的可循环性。由此产生的Si@SnO2核壳结构在可逆锂存储中具有显著的协同作用,在500 mA/g的电流100次循环后可提供高达1869 mAh/g的可逆容量。
Liu C等[38]也做了一些与金属氧化物涂层相关的工作,他们采用简单的球磨法成功制备蛋状结构的Si@Fe3O4@石墨烯(FLG)复合材料。图6(a)、(b)分别为Si@Fe3O4@石墨烯(FLG)复合材料的SEM和TEM图像。SEM图像显示复合材料具有球形分散颗粒的特征。从图6(a)可以看出,微尺寸的硅颗粒被外层紧密包裹。Si@Fe3O4@FLG的HTEM图像进一步证实了典型的硅芯颗粒,该颗粒具有双壳结构,由非晶Fe3O4和少量层状石墨烯。复合材料的电化学性能如图7所示,第一个循环和第50个循环后的充电容量没有变化仍为1580 mAh/g。随后,将电流提高到2 A/g,在活性材料活化之后的库伦效率提高至99%以上,并且在1 600次循环仍具有637 mAh/g的可逆容量,容量损失率仅为0.012%/次,低于之前报道的0.026%/次,证实了非晶Fe3O4的重要作用。

图6 Si@Fe3O4@FLG运行了200个循环[38]。(a)和(b)分别是Si@Fe3O4@石墨烯(FLG)复合材料的SEM和TEM图像;(c) SAED图;EDS元素分布图:(d) C, (e) Si, (f) Fe, (g) O and (h) FFig.6 Si@ Fe3O4@FLG ran for 200 cycles[38]: (a), (b) SEM and TEM images of Si@ Fe3O4@ graphene (FLG) composites; (c) SAED pattern; EDS elemental distribution maps:(d) C, (e) Si, (f) Fe, (g) O and (h) F

图7 (a) Si@ Fe3O4@FLG的恒流充放电曲线;(b)Si@ Fe3O4@FLG在0.01~3.0 V之间的循环伏安曲线;(c) Si@ Fe3O4@FLG的速率性能;(d) Si@ Fe3O4@FLG的循环性能[38]Fig.7 (a) Constant current charge-discharge curve of Si@ Fe3O4@FLG; (b) the cyclic voltammetry curve of Si@ Fe3O4@FLG between 0.01 V and 3.0 V; (c) rate performance of Si@ Fe3O4@FLG; (d) cyclic performance of Si@ Fe3O4@FLG[38]
Wang Q等[39]采用MIL-88-Fe作为Fe2O3/C层牺牲前驱体,通过简单的制备工艺,设计并制备了Si@Fe2O3/C复合材料。碳层不仅能加速电子迁移,还能避免Si和Fe2O3在电解液中的暴露,保证了复合材料优异的电极动力学和优异的结构稳定性。一方面,Fe2O3纳米粒子有助于提高电极的容量,另一方面,生成的Fe有助于提升电极的导电性,有利于实现电极的长循环。研究结果表明:如图8所示,以0.1 A/g的电流在0.01~2.00 V循环,首次充放电比容量分别为2 002.5和2 941.8 mAh/g,首次库仑效率达68.5% 。第100次和300次循环的放电比容量仍分别有958.6和680.7 mAh/g,且循环过程中的库仑效率保持在98%以上。

图8 (a) Si@Fe2O3/C电极的CV曲线和(b)放电曲线;(c)制备的原始Si、Si@Fe2O3/C和Si@C样品的循环性能和(d)倍率性能[39]Fig.8 (a) CV curves and (b) discharge-charge curves of Si@Fe2O3/C electrode; (c) cycling performance and (d) rate capability of the as-prepared pristine Si, Si@Fe2O3/C and Si@C samples[39]

表1 不同硅/金属氧化物复合负极材料的电化学性能Table 1 Electrochemical properties of different Silicon/metal oxide composite anode materials
2.2 原位反应
通过金属氧化物与硅发生固态化学原位反应,直接在硅表面生成硅化物和纳米金属,这些特定相能够有效缓解硅的体积膨胀和改善导电性。利用这一特点,Miao R等[40]通过简单的球磨和退火两步工艺制备了Si/Sn@SiOx-C (SSSC)负极材料,制备工艺如图9。为了研究Si -SnO2比例对材料电化学性能的影响,制备了3种不同的SSS样品,分别取0.9 g微米硅简记MSi和0.1 g纳米SnO2记为SSS-91、0.7 g MSi和0.3 g纳米SnO2记为SSS-73、0.5 g MSi和0.5 g纳米SnO2记为SSS-55。为了比较,同样的条件下也采用了MSi和纳米SnO2制备电极材料,分别记为Si和SnO2。随后,引入Ar和甲苯作为前体气体,将约100 mg SSS-73放入石英管炉中,并在900 ℃下加热25 min,以获得碳涂层复合材料(称为SSSC-73)。由于SSSC电极具有独特的结构,MSi机械还原纳米二氧化锡(nano-SnO2)原位引入金属锡(Sn)、内部SiOx基体和均匀的表面碳层,因此SSSC电极具有显著的速率性能和稳定的循环性能。图10所示,在0.5 A/g的电流下100次循环后的容量为1 102 mAh/g以及在2 A/g的电流下500次循环中保持95%的高容量,每个循环的容量损失小于0.01%。SSSC电极令人印象深刻的电化学性能与Sn的引入和双缓冲结构(内部SiOx基体和外部C层)的联合作用有关。

图9 Si/Sn@SiOx-C (SSSC)复合材料的合成示意图[40]Fig.9 Schematic diagram of Si/Sn@SiOx-C (SSSC) composite synthesis [40]

图10 (a) Si/C、SSSC-91、SSSC-73、SSSC-55和Sn/C电极100次循环性能和速率性能的比较(b);(c) SSSC-73电极在2 A/g速率下的长循环性能[40]Fig.10 (a) Comparison of 100 cycle performance and rate performance of Si/C, SSSC-91, SSSC-73, SSSC-55 and Sn/C electrodes (b); (c) long cycle performance of SSSC-73 electrode at 2 A/g rate[40]
Wu Y H等[41]将Si/CuO/VGCF(质量比89∶10∶1混合,VGCF是纳米碳纤维简记作V)放入球磨罐中,采用机械球磨的方式通过用Si将CuO中的Cu还原出来并与过量Si合金化生成缓冲相Cu3Si来制备造亚微米级的Si/Cu3Si-V聚集体(简记SCV)。随后用葡萄糖作为碳源,在高温800℃碳化而覆盖在SCV颗粒表面,记作为C-SCV或SCV@C,值得注意是,这里的碳层起到缓冲作用。由于惰性Cu3Si在充放电过程中不参与反应,因此可以作为结构稳定剂来增强电子转移以及SCV@C的完整性。这种负极材料在第一个循环时的充电比容量2101 mA/g,ICE为84.1%,在第100个循环结束时容量保持率为82.9%,提升了电极的循环稳定性。
Suh S等[42]利用原位固态反应将比例为9:1的Si和CoO在行星式球磨机内以150 r/min进行混合30min,然后将混合粉末放入通有Ar气氛的管式炉中,以 5 ℃/min的升温速率在900 ℃保温15 h后冷却至室温,最终得到Si/SiOx/Co的复合材料,图11所示。图12所示电化学性能,在电流密度分别为0.5、1、2、4,8和16 A/g,Si/SiOx/Co阳极的放电比容量分别为1 728、1358、1044、769、473和110 mAh/g。当电流密度重置为1 A/g时,原始Si的放电比容量下降,而Si/SiOx/Co复合材料具有出色的倍率性能,其原因是反应生成的Co金属提高了电极的电导率,促进了锂离子的扩散。通常碳充当有效的导电剂,但是由于循环后Si与碳之间的不良接触,Si电极中的导电网络恶化。相比之下,由于SiOx和Co金属之间的良好的界面结合强度,保证了其导电网络。此外,复合材料在2 A/g的电流下循环200次后,容量保持在1602 mAh/g,而Si的容量则为351 mAh/g,这种优秀的电化学性能的提高归因于Si/SiOx/Co复合材料中的纳米Co金属的缓冲和导电作用。

图11 Si/SiOx/Co复合材料的合成过程示意图[42]Fig.11 Schematic diagram of Si/SiOx/Co composite synthesis[42]

图12 (a) Si/SiOx/Co和Si电极在0.5 A/g到16 A/g电流下的倍率性能;(b) Si/SiOx/Co和Si电极在2 A/g电流下的循环性能[42]Fig.12 Rate performance of the Si/SiOx/Co and Si electrodes at current rates from 0.5 A/g to 16 A/g, and cyclic performance of Si/SiOx/Co and Si electrodes at 2 A/g current[42]
3 结 论
与传统的碳材料相比,硅作为锂离子电池负极材料具有更高的理论比容量、丰富的存储量且较低的成本,因此得到了研究者们的广泛关注。但是,由于半导体硅电导率较差,并且在嵌入的过程中将会使体积膨胀相较以往呈数倍增大,最高膨胀度可达370%。这将导致活性材料粉化并从集流体上脱落,进而使得容量迅速缩减。近年来,已经制定了各种策略来解决上述问题,例如将硅设计成纳米结构,碳材料、金属氧化物等涂层材料与硅复合等。其中,金属氧化物与硅复合作为负极材料取得了一定的成效,归纳总结如下:
其一,在硅表面沉积金属氧化物,生成的复合材料通常采用核壳结构,类似Si/C。金属氧化物可避免硅与电解液的直接接触,还可以作为缓冲硅材料体积膨胀的缓冲层,有效应对硅在重复充放电过程中内部产生的应变和应力,提高结构稳定性,还能改变表面性能,形成薄而稳定的SEI膜,防止极片的粉化。另一方面避免了硅颗粒发生团聚现象,提高电池的循环性能。
其二,部分金属氧化物在与硅复合的过程中发生原位固态反应引入导电金属或金属硅化物,生成的复合材料不仅提供了能够抑制体积膨胀的缓冲相,其导电相可增加与硅基体和铜集流体的连接,并能适应循环过程中硅体积的变化。同时还提供了有效的导电网络,有利于加快电子传输,缓解材料在脱嵌锂过程中的极化现象,提高了电化学性能。
硅/金属氧化物复合负极材料在提高循环稳定性方面有着很大的竞争优势,但依然存在一些需要解决的问题,例如:(1)包覆层厚度及包覆相与硅表面结合强度;(2)反应产物硅化物和金属最佳体积分数以及与硅表面的界面结构;(3)金属氧化物改性硅一般稳定性明显改善,但首次库伦效率(ICE)不高。针对这些问题,未来可以从以下几个方面研究:(1)适当的包覆层厚度使得锂离子电池的容量和循环性能达到最佳;(2)反应产物硅化物和纳米金属颗粒的比例以及与硅的最佳界面结构;(3)除此之外,还可以从粘结剂、电解液、尤其预锂化技术等开发来实现高ICE。总而言之,通过金属氧化物改性硅的结构优化,并与负极预锂化技术相结合,研发高容量循环稳定性及高首效的硅基复合负极材料的商业化应用,将是未来发展趋势。

