人参、大蒜混合发酵过程中微生物多样性、成分及抗氧化能力分析
葛长锌,李雅倩,董微巍,周 鑫,徐孟休,李官浩,*,朴春香,*
(1.延边大学农学院,吉林 延吉 133000;2.青岛大学化学化工学院,山东 青岛 266000;3.金乡蒜通天下仓储有限公司,山东 金乡 272202)
人参(C. A. Mey)是五加科人参属的干燥根,是我国名贵中药材之一,从古至今一直被誉为“百草之王”。其主要活性成分为人参皂苷、多糖、多肽等物质,人参具有抗衰老、抗肿瘤、保护心脏、降血糖以及免疫调节等多种药理作用。传统上,常见的人参为白参和红参,近年来,基于一种新的加工方法开发了新的人参制品——黑参。黑参含有的人参皂苷分型多于人参,提高人参的营养价值,但需要9 次蒸制,加工时间长、消耗大、成本高,限制了其发展和推广。
大蒜(L.)是世界上最重要的作物之一,通常用于烹饪辅料,除此之外它也具有许多生理功能,如抗氧化性、抗菌性、抗癌性以及预防心血管疾病等。但是由于大蒜具有很强的刺激性气味和辛辣味,因此,近年来,研究人员通过各种处理方法,例如热处理、陈化和发酵等,以消除其刺激性气味并改善大蒜的适口性。因此,大蒜发酵产品黑蒜得以诞生。黑蒜是将整个大蒜鳞茎在高温控湿条件下加工而制得的产品,因其味道酸甜、质地柔软、营养成分丰富以及具有多种健康特性而在世界范围内广受欢迎。
人参和大蒜都具有多种生物活性物质,具有较好的药用和食用价值,且近年来都发展出了高温加工制品黑参和黑蒜。但由于人参产量低、价格高,限制了黑参产业的发展;而大蒜不仅种植面积广、产量高,且价格便宜。此外,有研究表明黑参与黑蒜复配使用可显著促进肝癌HepG-2细胞凋亡,对提高黑参的抗癌作用具有促进作用。因此,本实验通过比较人参发酵、大蒜发酵及人参和大蒜混合发酵产物的微生物群落变化、成分变化以及抗氧化活性变化,研究大蒜对黑参发酵的促进作用,旨在为降低黑参制作成本、促进黑参产业的发展提供理论依据。
1 材料与方法
1.1 材料与试剂
大蒜、人参 市售;无水乙醇、甲醛、氢氧化钠、无水碳酸钠(均为分析纯) 天津市科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 日本和光纯药工业株式会社;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 北京酷尔化学科技有限公司;5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF) 北京索莱宝科技有限公司;过硫酸钾 上海阿拉丁生化科技股份有限公司;没食子酸(分析纯)、福林-酚 上海源叶生物科技有限公司。
1.2 仪器与设备
RE-52AA旋转蒸发仪 上海豫明仪器有限公司;Synergy H1酶标仪 美国BioTek公司;LC-2030液相色谱仪 日本岛津公司;DF-101S集热式恒温加热磁力搅拌器 上海凌科实业发展有限公司;T6新世纪紫外分光光度计 上海普析通用仪器有限责任公司。
1.3 方法
1.3.1 样品制备
黑参、黑蒜发酵:参考于蒙娜液态发酵黑蒜方法并加以修改,取人参和新鲜剥皮大蒜,研磨成泥,分别取10 g参泥和蒜泥加入4 mL蒸馏水,放入自封袋中,于75 ℃条件下进行液态发酵,共发酵26 d。发酵期间每隔2 d取一次样,置于-80 ℃冰箱中备用。
人参和大蒜混合发酵(参蒜):在进行预实验的前提下,以人参、大蒜1∶1为混合比例,按照上述方法进行发酵和取样。
提取液的制备:称取适量样品于锥形瓶中,以料液比1∶20(g/mL)加入60%乙醇溶液,在40 ℃、600 W超声条件下提取30 min,提取液抽滤澄清后于50 ℃条件下旋转蒸发至原体积的1/3,冷冻干燥备用。
1.3.2 样品DNA提取及扩增
使用MN NucleoSpin 96 Soi试剂盒进行微生物群落总DNA提取,扩增引物为F(ACTCCTACGGGAGGCAGCA)和R(GGACTACHVGGGTWTCTAAT),扩增程序:95 ℃预变性5 min,25 个循环(95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s),然后72 ℃稳定延伸7 min,最后在4 ℃进行保存。
1.3.3 Illumina Novaseq测序
使用Illumina Novaseq 6000,分别对细菌16S rRNA V3-V4高变区序列进行测序分析。
1.3.4 成分分析
还原糖含量借鉴于蒙娜的方法,以葡萄糖为标准;总酚含量采用福林-酚法,以没食子酸为标准,结果以没食子酸当量(mg/g)表示;总酸含量测定采用GB/T 12456—2021《食品中总酸的测定》;5-HMF含量的测定采用GB/T 18932.18—2003《蜂蜜中羟甲基糠醛含量的测定方法 液相色谱-紫外检测法》。
1.3.5 人参皂苷含量测定
参考房柳等的方法并加以修改,发酵产物经水饱和正丁醇3 倍体积萃取,5 000 r/min离心5 min,取上清液,反复3 次;将萃取出的萃取液旋转蒸发至膏状,加入1 mL色谱甲醇,转移至液相瓶内,使用高效液相色谱仪进行分析。
检测条件:色谱柱为ZORBAX SB-C柱(250 mm×4.6 mm,5 μm);柱温35 ℃;流速0.8 mL/min;流动相为乙腈(A)、水(B),洗脱程序见表1;检测波长203 nm;进样量15 μL。
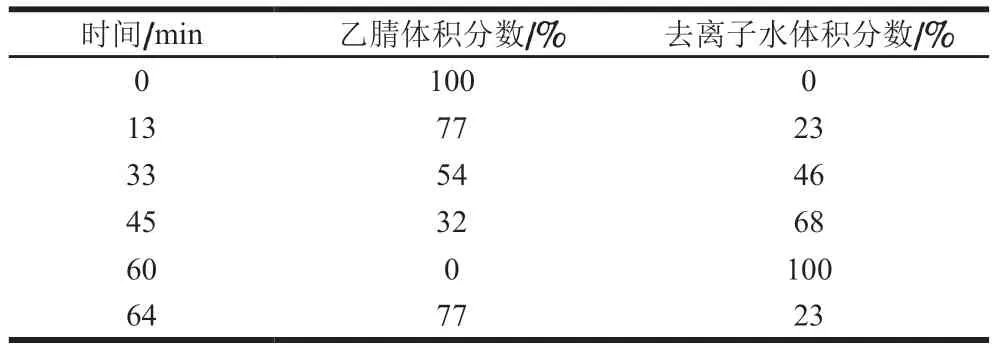
表1 梯度洗脱程序Table 1 Gradient elution program
1.3.6 抗氧化能力测定
1.3.6.1 DPPH自由基清除率
参照Ren Feiyue等的方法并适当调整。吸取25 μL样液于96 孔板中,加入200 μL DPPH溶液(100 μmol/L),室温避光30 min。然后通过酶标仪测定在517 nm波长处的吸光度。使用200 μL乙醇溶液代替DPPH溶液作为空白样品组。以25 μL乙醇溶液和200 μL DPPH作为对照组,225 μL乙醇溶液作为空白组。所有实验进行3 组平行,按照式(1)计算DPPH自由基清除率:
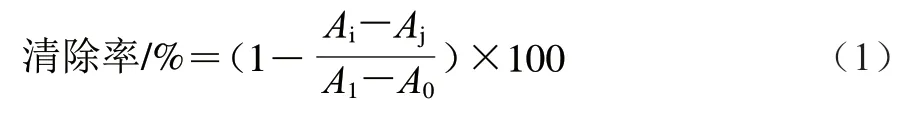
式中:为样品组吸光度;为空白样品吸光度;为对照组吸光度;为空白组吸光度。
1.3.6.2 ABTS阳离子自由基清除率
参考Xie Xiaolin等的方法。将7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾在室温条件下避光反应12~16 h,制得ABTS储备液。用磷酸盐缓冲液将ABTS溶液稀释至为2.0±0.1,制得ABTS工作液。吸取25 μL提取液于96 孔板中,加入200 μL ABTS工作液,避光静置8 min,然后在734 nm波长处测定吸光度。以200 μL磷酸盐缓冲液代替ABTS工作液作空白样品组。以25 μL磷酸盐缓冲液和200 μL ABTS工作液作为对照组,以225 μL磷酸盐缓冲液作为空白组。所有实验进行3 组平行,按照式(2)计算ABTS阳离子自由基清除率:

式中:为样品组吸光度;为空白样品吸光度;为对照组吸光度;为空白组吸光度。
1.4 数据统计分析
使用Excel 2016和SPSS 24.0软件进行数据计算和分析,采用Duncan分析,<0.05,差异显著。基于Illumina-MiSeq测序平台,使用BMKCloud进行微生物群落结构分析。
2 结果与分析
2.1 微生物多样性分析
2.1.1多样性分析
多样性反映单个样品物种丰度及物种多样性,有多种衡量指标。ACE指数和Chao1指数衡量物种丰度即物种数量的多少。相同物种丰度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性,Shannon指数和Simpson指数越大,说明样品的物种多样性越高。

表2 发酵过程中微生物菌群的α多样性Table 2 α-Diversity indices of microbial flora during fermentation
各个样品质量控制后,在16S rRNA序列中分别得到73 487、65 085、65 825、45 853、66 986、60 803、68 265 条有效序列。基于可操作分类单元(operational taxonomic units,OTU)数的稀释曲线和Shannon曲线趋于平缓(图1),表明本研究的测序深度足以代表样品的微生物结构,说明测序数据足够后续分析。此外,分别以ACE、Chao1、Simpson指数和Shannon指数等参数描述不同时期样品中微生物群落的丰度和多样性(表2)。在发酵过程中样品的微生物群落丰富度呈现先上升后下降趋势并在第8~12天达到峰值,随着发酵的进行,Simpson指数趋于稳定,Shannon指数逐渐上升并且在第20天达到峰值,说明在发酵第20天时,参蒜发酵产物的微生物群落多样性最高。

图1 各样品微生物的稀释曲线(A)和Shannon曲线(B)Fig. 1 Rarefraction curves (A) and Shannon curves (B) of microorganisms in each sample
2.1.2 微生物群落结构分析
根据OTU分析结果,对样品数据在门和属水平上进行分类学分析。在门水平上,共检测出34 个门,为了简化图表,只显示丰度前20的门。其中丰度排名前10的门分别为Epsilonbacteraeota、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、蓝藻细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)。以上10 种菌门的相对丰度在样品中达到95%以上,表明在门水平上参蒜发酵过程中微生物菌群结构具有明显的稳定性。
由图2可以看出,在第0天,人参和大蒜的优势菌门为蓝藻细菌门和变形菌门,随着加工时间的推移,其微生物群落结构发生显著改变,各个发酵时期厚壁菌门微生物丰度显著增加,而蓝藻细菌门丰度显著下降,发酵20 d后微生物丰富最高的为厚壁菌门26.09%,其次为变形菌门23.49%;因此,可以看出人参、大蒜以及参蒜的微生物群落组成具有明显差异,在参蒜中第1优势菌门由蓝藻细菌门转变为厚壁菌门,其原因可能是随着高温发酵时间的延长,不利于大多数抗逆性较差的微生物生长,而厚壁菌门的微生物抗逆性强能够适应高温环境,从而成为优势菌门。
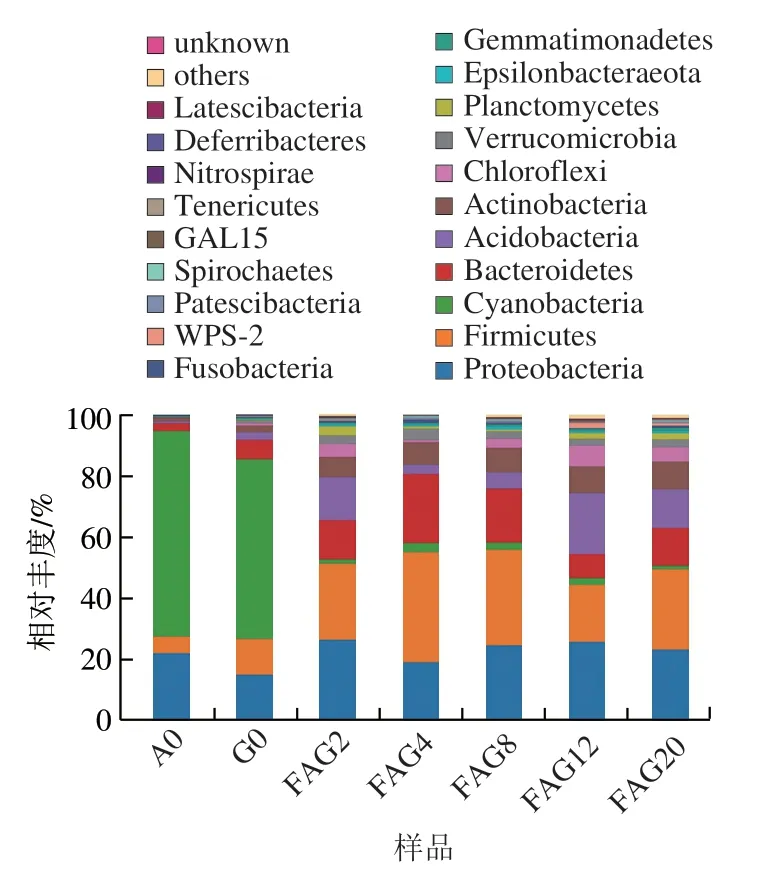
图2 混合发酵样品微生物群落结构(门水平)Fig. 2 Microbial community structure of co-fermented samples at phylum level

图3 混合发酵样品微生物群落结构(属水平)Fig. 3 Microbial community structure of co-fermented samples at genus level
由图3可知,混合发酵后样品与人参和大蒜在属水平上存在较大的差异。所有样品共检测到699 个属,图中只显示了相对丰度前20的属,并将其他物种合并为others在图中显示。其中,参蒜的优势菌属为uncultured_bacterium_f_Muribaculaceae、uncultured_bacterium_f_Lachnospiraceae、拟杆菌属()、uncultured_bacterium_o_Subgroup_2、乳杆菌属()、uncultured_bacterium_o_Acidobacteriales和uncultured_bacterium_c_Subgroup_6;在人参和大蒜中,第一优势菌属分别为Aegypius_monachus_black_vulture和uncultured_bacterium_o_Chloroplast,在整个发酵过程中这两种属的丰度逐渐降低,在第20天时其丰度分别为0.08%和0.90%;在发酵后期,参蒜中的第一优势菌属为uncultured_bacterium_f_Lachnospiraceae,它是一种目前还不能进行实验室培养的菌属,其菌种特性和生理功能还有待进一步研究;此外,随着发酵时间的延长乳杆菌属相对丰度逐渐增加并成为优势菌属,最终相对丰度为2.78%;乳杆菌属微生物是常见的益生菌,具有抑制病原菌的生长、增强机体免疫功能以及产生有机酸等功能,因此乳酸杆菌属的大量生长可以抑制其他病原微生物的生长繁殖,同时其产生的有机酸还可以起到改善发酵产物风味的作用。
2.1.3 参蒜混合发酵微生物群落代谢功能比较分析
通过比较人参、大蒜以及不同发酵阶段参蒜的京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路数据,可以分析出它们的微生物群落代谢差异。所有样品共形成6 条一级代谢通路以及44 条二级代谢通路,6 大类一级代谢通路分别为代谢通路、遗传信息处理、环境信息处理、细胞过程、人类疾病以及生命系统。由图4可知,各样品中全局及概要图代谢通路的丰度最高,该通路与基础代谢有关,其丰富越高表明微生物代谢活性越强,有利于发酵过程中营养和活性物质的形成与转化。其次,碳水化合物代谢的丰度也较高,三羧酸循环、丙酮酸代谢、磷酸戊糖和糖酵解途径等是碳水化合物的主要代谢途径,这些代谢会产生大量的有机酸如柠檬酸、乙酸、丁酸等,使得参蒜的pH值逐渐降低,从而抑制其他杂菌生长,上述有机酸的产生还可能对参蒜的风味产生影响,促进其酸甜口味的形成,此外,乳酸菌在糖代谢过程中除了正型乳酸发酵产生乳酸外,还会异型乳酸发酵产生乙醛、丙酮等挥发性芳香化合物,能促进参蒜香味的形成;而其他与食品风味物质形成相关的代谢途径(氨基酸代谢、脂代谢、辅助因子和维生素代谢)在各个时期代谢通路丰度比值也较高且稍有变化,氨基酸代谢能将大分子蛋白降解成容易被身体吸收的氨基酸或肽类物质,其中一些代谢物可能具有抗菌活性和抗肿瘤活性,大大提高了产品的生理功能;通过脂质代谢通路,脂肪被分解为游离脂肪酸,再进一步代谢形成醛等挥发性风味物质,促进最终产品风味的形成。
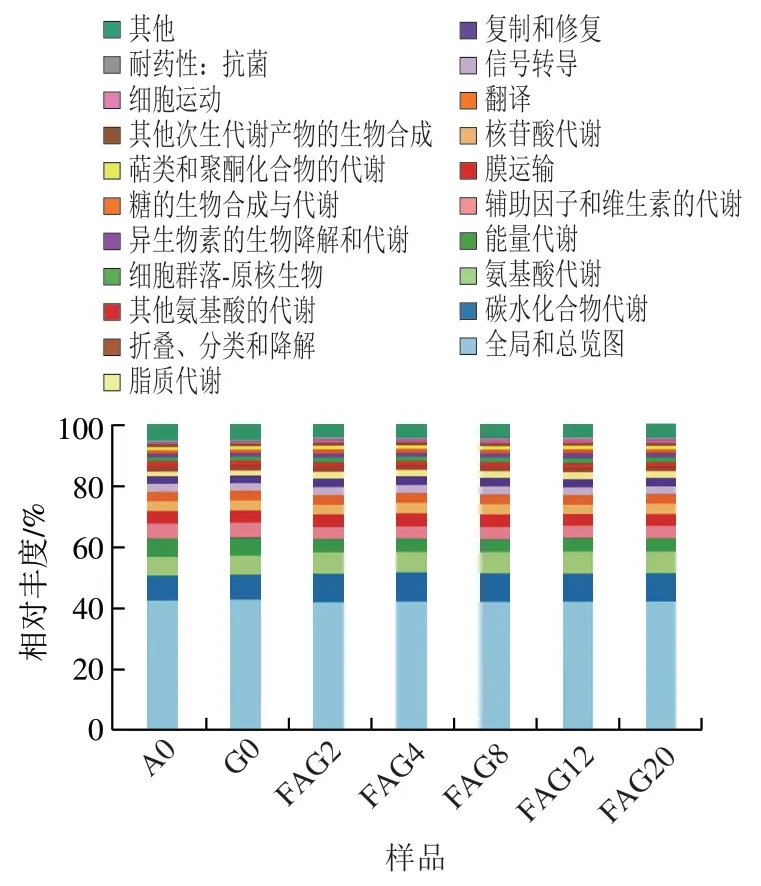
图4 混合发酵过程中各样品基因KEGG代谢通路分析Fig. 4 KEGG metabolic pathway analysis of genes in each sample during co-fermentation
2.2 不同发酵样品成分分析
2.2.1 还原糖含量
大蒜中的碳水化合物主要由果聚糖组成,人参中也含有大量多糖,主要为中性糖和酸性果胶,发酵过程中,高温加热直接导致多糖降解,从而导致还原糖含量显著上升。由图5可知,随着发酵时间的延长黑蒜中还原糖含量逐渐升高,在第20天达到峰值后下降,第24天还原糖含量为89.63 mg/g;人参单独发酵后还原糖含量缓慢上升,12 d后趋于平稳,第24天含量为55.39 mg/g;人参与大蒜1∶1混合发酵后还原糖含量显著上升,并于第24天达到最高值161.60 mg/g;实验表明,黑参的还原糖含量最低,但人参与大蒜混合发酵后可显著提高其还原糖含量,含量越高甜味越大,有助于改善黑参风味。

图5 不同发酵时间还原糖含量的比较Fig. 5 Comparison of reducing sugar contents at different fermentation times
2.2.2 总酸含量
总酸含量是评判黑蒜风味的指标之一,当总酸含量在15~40 mg/g范围内时,酸味适中,风味佳;但是当其超过40 mg/g时,其酸味过重,口感差。从图6可以看出,随着发酵的进行,黑蒜、黑参和参蒜总酸含量均呈现上升趋势,最终总酸含量依次为23.33、38.33 mg/g和33.33 mg/g。实验表明,黑参酸度最高,与参蒜的总酸含量差异不显著,黑蒜总酸含量显著低于黑参和参蒜;三者的总酸含量都在15~40 mg/g之间,说明他们的酸味都比较适中,风味较好。因此,大蒜和人参混合发酵并不会显著改变产品的总酸含量,对其酸味不会造成影响。

图6 不同发酵时间总酸含量的比较Fig. 6 Comparison of total acid contents at different fermentation times
2.2.3 总酚含量
多酚类物质是具有潜在促进保健作用的植物性化合物,并且其抗氧化作用可防止一些慢性病的发生,具有潜在的促进健康的作用。由图7可知,随着发酵时间的延长,黑蒜、黑参以及参蒜的总酚含量均显著提高,最终含量分别为2.55、2.11 mg/g和2.61 mg/g,总酚含量分别提高了4.64、11.72 倍和8.42 倍,总酚含量上升的主要原因是大分子化合物分解释放出较多酚羟基。实验表明,黑参的总酚含量最低,但在加入大蒜混合发酵后可显著提高其总酚含量,有利于多酚类物质的积累,多酚类物质含量越高,其保健功效越好。

图7 不同发酵时间总酚含量的比较Fig. 7 Comparison of total phenol contents at different fermentation times
2.2.4 5-HMF含量
5-HMF是美拉德反应的中间产物,在面包、饼干等食品中较为常见,含量高时可表现出毒性。根据图8可知,5-HMF的出峰时间为10.776 min,通过保留时间进行定性;对黑蒜、黑参和参蒜的5-HMF含量进行分析,其保留时间分别为10.596、10.576 min和10.434 min,与标准品出峰时间一致,可判定为5-HMF;根据标准曲线进行含量计算,黑蒜、黑参和参蒜的5-HMF含量分别为(96±0.19)、(145±0.35)、(109±3.70)μg/g。实验结果表明,人参单独发酵时其5-HMF含量显著高于黑蒜和参蒜。因此,采用人参和大蒜混合发酵可显著降低生产过程中潜在有害物质5-HMF的形成,提高其食用安全性。

图8 5-HMF标准溶液液相色谱图Fig. 8 Liquid chromatogram of 5-HMF standard solution
2.3 黑参和参蒜人参皂苷含量对比
目前,从人参等中药中分离鉴定出的人参皂苷有100余种,其中人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf和Rg1占总人参皂苷的90%以上,被认为是主要的人参皂苷;研究发现,人参皂苷的次级代谢产物具有更强的生物活性,通常被称为稀有人参皂苷,并且人体胃肠道对主要人参皂苷的吸收非常差,而稀有人参皂苷更容易被人体吸收并发挥作用;因此,促进主要人参皂苷转化为稀有人参皂苷是提高黑参营养价值和功能性的有效手段。
通过液相色谱法对黑参和参蒜发酵过程中各人参皂苷含量进行测定,结果图9所示。随着发酵过程的进行,Re、Rg1、Rf、Rb1、Rc、Rb2、Rg2等主要人参皂苷含量逐渐下降,Rg3、Rh2等稀有人参皂苷的含量逐渐上升,说明在发酵过程中主要人参皂苷逐渐转化为功能活性更强的稀有人参皂苷;在第0天时,添加大蒜组的主要人参皂苷含量低于人参组,从第6天开始参蒜组的稀有人参皂苷含量高于黑参组,同时发酵结束后参蒜稀有人参皂苷转化率为61.65%,显著高于黑参组的24.29%。因此,大蒜与人参混合发酵有助于提高稀有人参皂苷的转化率,对提高黑参的营养价值和生理功能具有促进作用,但加入大蒜后转化率显著提高的作用机制还有待进一步研究。
图9 人参和参蒜发酵过程中皂苷含量变化Fig. 9 Changes in saponins contents in ginseng and ginseng garlic during fermentation
2.4 不同样品抗氧化能力比较
2.4.1 DPPH自由基清除率
DPPH自由基在有机溶剂中是一种稳定的自由基,颜色呈紫红色,在517 nm波长下有强吸收。当体系中存在抗氧化物质时会与其孤对电子配对,吸收将减弱或消失,而吸收减弱的程度则可以反映自由基清除物质的活性。如图10所示,随着发酵时间的延长,黑蒜、黑参和参蒜的DPPH自由基清除能力均呈现上升趋势,发酵结束后DPPH自由基清除率分别达到了53.29%、58.10%和56.61%,但三者之间无显著差异,说明混合发酵能对黑蒜、黑参本身的抗氧化活性无显著影响,能很好地保持其抗氧化能力;发酵后抗氧化能力的提升可能得益于总酚含量的上升以及Amadori化合物的产生;此外,人参中含有的多糖类物质也具有很好的抗氧化活性,发酵过程中由于黑参中还原糖含量变化较小,说明其多糖分解较少,因此,人参多糖也可能对黑参抗氧化能力的提高起促进作用。

图10 不同发酵时间DPPH自由基清除率的比较Fig. 10 Comparison of DPPH radical scavenging capacity at different fermentation times
2.4.2 ABTS阳离子自由基清除率
从图11可以看出,不同发酵阶段样品的ABTS阳离子自由基清除能力随时间延长而上升,发酵结束后黑蒜、黑参和参蒜的ABTS阳离子自由基清除率分别达到了74.65%、90.34%和90.32%。结果表明,黑参和参蒜的ABTS阳离子自由基清除能力无显著差异,并且显著优于黑蒜。

图11 不同发酵时间ABTS阳离子自由基清除率的比较Fig. 11 Comparison of ABTS radical cation scavenging capacity at different fermentation times
3 结 论
通过液态发酵法分别制备黑蒜、黑参和参蒜并对其微生物多样性、主要成分及抗氧化能力进行比较。微生物多样性分析表明,所有样品共检测出34 个门和699 个属,参蒜的第1优势菌属为uncultured_bacterium_f_Muribaculaceae,乳杆菌属也是优势菌属之一,并对其风味具有一定影响;结合KEGG代谢通路分析,参蒜与大蒜和人参的代谢通路无明显差异,丰度最高的全局及概要图、碳水化合物代谢和氨基酸代谢对参蒜发酵过程中的成分变化及风味形成具有贡献;成分分析结果显示,参蒜的还原糖和总酚含量显著高于黑参,总酸含量与黑参无显著差异,潜在有害物质5-HMF含量显著降低;此外,混合发酵后稀有人参皂苷转化率显著提高;在抗氧化方面,有研究表明黑蒜和黑参均具有良好的抗氧化能力,而参蒜的DPPH自由基清除能力与黑蒜、黑参无显著差异且ABTS阳离子自由基清除能力显著优于黑蒜,表明参蒜具有良好的抗氧化功能。
上述实验结果表明,传统的九蒸九制黑参制备方法过于繁琐,而液态发酵法不仅操作简单,还有利于黑参营养价值和生理功能。因此,参蒜是一种值得开发和研究的新型保健食品,在后续研究中应进一步优化参蒜发酵工艺,应用到工业化的生产当中,为促进黑参产业的发展提供理论依据。

