江西省青钱柳自然居群的群体遗传结构与基因流研究
刘亚林,叶林江,寇一翾,范邓妹,张志勇,程珊梅*
(1.江西农业大学 农学院,江西 南昌 330045;2.景德镇学院 生物与环境工程学院,江西 景德镇 333400)
【研究意义】青钱柳[Cyclocarya paliurus(Batal.)Iljinsk.]隶属于胡桃科青冈属(Cyclocarya),是中国特有的单种属植物[1],广泛分布于江西、浙江、江苏等省[2]。青钱柳为风媒传粉,树干通直;果具圆形翅,形似串串铜钱,有很高的庭院观赏价值;其叶味甘,具有显著的降血糖功效[3]。它是一种集药用、保健、用材和观赏等价值于一身的多用途树种,在国内多地被推广种植[4-5]。青钱柳具有与地理环境密切相关的遗传多样性和遗传分化[6-7],同时江西省被认为是青钱柳的冰期避难所之一[8],江西省青钱柳自然居群分布广泛,有较高的遗传多样性。江西省三面环山,北部的鄱阳湖盆地,中部的丘陵低山和平原,使其整体呈现出一个开口朝北的“簸箕”状,地理位置较为独立,是一个研究小尺度基因流的理想生态单元。【前人研究进展】近年来对青钱柳遗传背景的研究较少,且主要集中在探究其大尺度范围遗传分化、不同种源的遗传多样性和遗传驯化方面。周一旸等[9]利用SRAP 技术,发现青钱柳各种源种群间变异大,同时种源内也高度分化。Kou 等[8]综合叶绿体和核基因两种遗传标记,得出青钱柳有很长的进化历史,具有武夷山脉和云贵高原东侧两个冰期避难所。陈秀娟等[10]利用ISSR 分子标记,对青钱柳种质资源进行亲缘关系研究,发现青钱柳种质在长期的适应和进化过程中形成了广泛的遗传变异,个体间遗传差异大。Li等[11]利用ISSR 和SSR 分子标记发现青钱柳群体间遗传分化较低,遗传变异主要存在于群体内。
【本研究切入点】综合前人研究发现,青钱柳有高度的种内分化,这与地理环境密切相关。但前人研究主要是在全国范围探讨其遗传多样性和遗传结构,并未关注到独特的小区域中的遗传分化,尤其是小尺度的基因流。而江西省周围山脉是与邻省的自然地理界线,能够隔绝大量外界基因流的干扰,是研究这些问题的一个理想的独立生态单元。分子标记受生理条件和环境因素的影响较小,近年来开发出许多评估遗传多样性和进化关系的分子标记,如RFLP、AFLP、ISSR 和SSR 等标记[12]。SSR 标记具有共显性、效率高、可重复等突出优点,是鉴定种源多样性的理想分子标记[13]。Fan 等[14]为青钱柳开发了28 对SSR 引物,本研究以此为基础开展试验。【拟解决的关键问题】探究江西省青钱柳居群的遗传分化和基因流方向,能够获得大量有关青钱柳居群遗传多样性和自然演替的信息。由此能够阐明独立生态单元中青钱柳的基因流和遗传分化趋势,地理环境和气候变化对种群内和种群间多样性和遗传结构的影响[15],进而选出适应江西省气候的广适性青钱柳种源,为其今后的育种和药用提供资源支持。
1 材料与方法
1.1 样品采集和总DNA提取
研究样品采集于江西省境内26个青钱柳的自然居群(表1),共283份样品。每个居群均在1 km×1 km的范围内采集,每棵植株均采取健康幼嫩叶片并立即用硅胶干燥,同时记录详细采集信息,带回实验室-20 ℃低温保存备用。
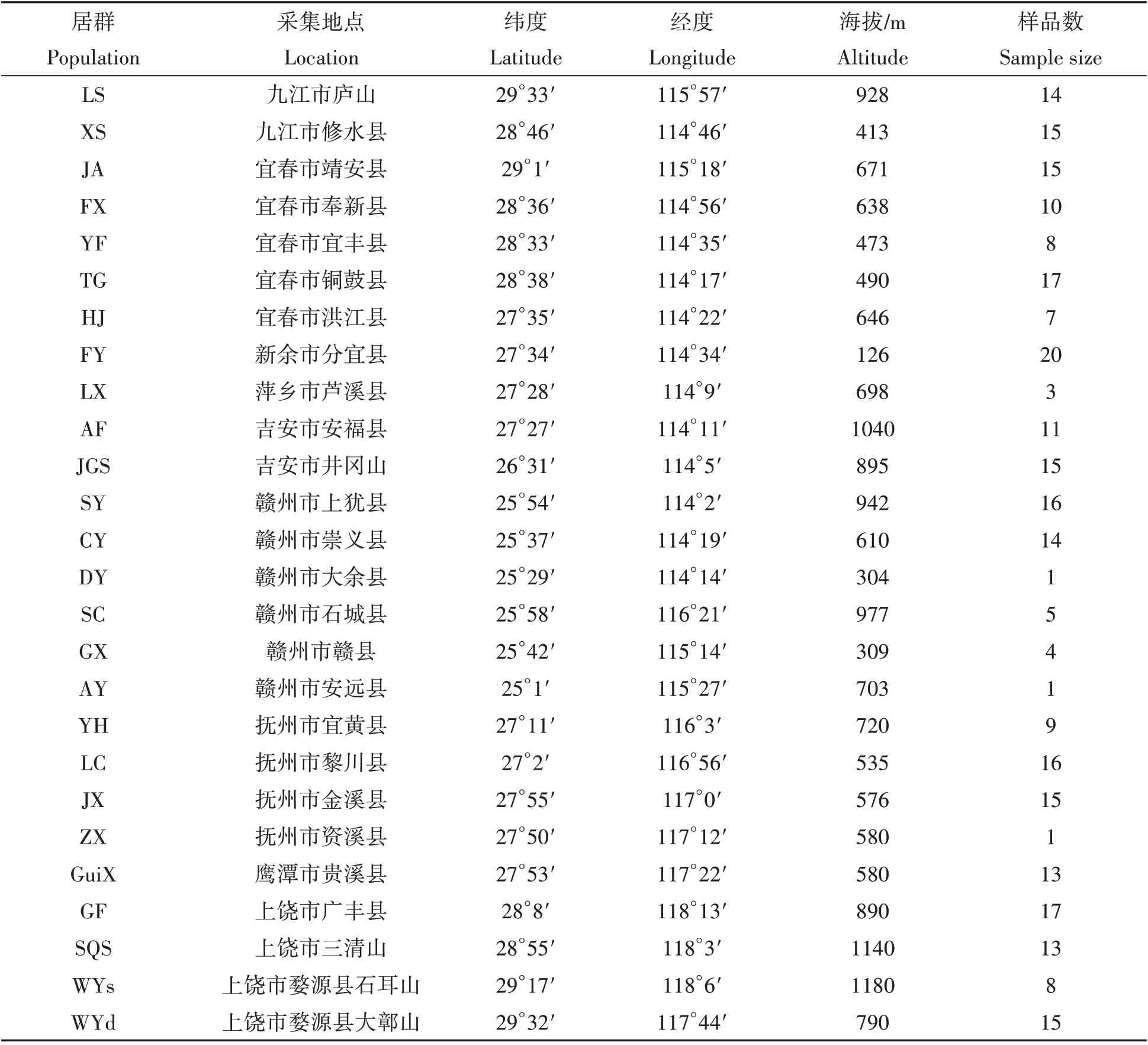
表1 江西省青钱柳自然居群样品信息[17]Tab.1 The sample information of Cyclocarya paliurus in Jiangxi Province
采用改良CTAB 方法,从已经被硅胶干燥的叶片组织中提取总DNA[16]。在10 g/L 琼脂糖凝胶中,通过与已知标准lambda DNA 进行比较来评估分离DNA 的浓度。然后,将分离的基因组DNA 稀释并保存在4 ℃下进行PCR扩增。
1.2 微卫星引物和PCR扩增
挑选来自不同居群的24份DNA样品,利用聚丙烯酰胺凝胶电泳检测,从已开发的青钱柳微卫星引物中筛选出8 对清晰的多态引物(表2)。利用筛选出来的8 对引物对青钱柳26 个居群的283 个个体进行PCR。在每个正向引物序列的5'端附加一个M13(5'-CACGACGTTGTAAAACGAC-3')引物,用荧光标签标记(FAM/TAM,Applied Biosystems,Foster City,CA,USA)。PCR 产物通过毛细管电泳分离,使用ABI 3730 XL自动测序仪(美国应用生物系统公司),以LIZ-500为内标。使用Gene Mapper v.4.0软件(Applied Biosystems,Foster City,CA,USA)分析色谱图。后续分析时为了避免误差,将删除样品数少于3的居群。
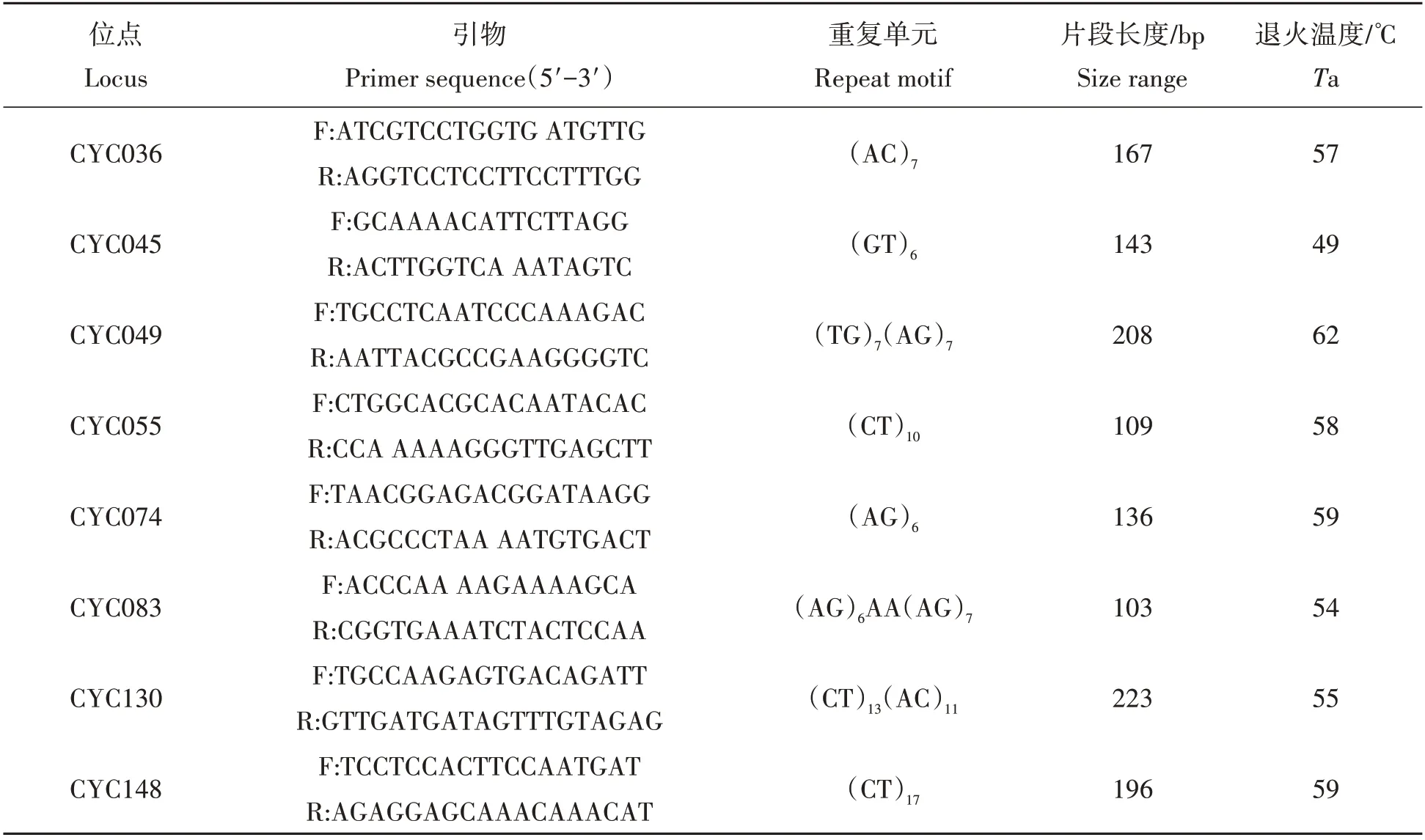
表2 青钱柳8对微卫星引物[14]Tab.2 Characteristics of eight microsatellite primers in the Cyclocarya paliurus
1.3 数据分析
GeneMarker v2.2.0 软件[18]根据每个荧光标记、序列长度定义等位基因,读取并记录每个等位基因的大小。利用GENEPOP v.3.4 软件[19]进行Hardy-Weinberg 平衡和连锁不平衡(LD)检测,并对其显著性水平进行Bonferroni 校正[20]。使用GenAlEx v6.5[21]计算了各位点的Shannon 多样性指数(I)、观测杂合度(HO)、期望杂合度(HE)和基因流(Nm),以及居群平均等位基因数(NA)和有效等位基因数(NE)。用Cervus v3.0.7 计算各位点多态信息含量(PIC)[22]。Arlequin v3.11 软件[23]进行F-统计[24]以计算各居群近交系数(FIS)、遗传分化系数(FST)值。
STRUCTURE 2.3.4 软件[25]分析试验材料的群体遗传结构,使用100 000 个循环,10 000 个MCMC 重复,应用混合祖先模型,K值范围为1到10,每个值迭代10次。利用网站程序structure Harvester,根据ΔK值确定最佳种群结构和亚群数(http://taylor0.biology.ucla.edu/structureHarvester/)。通过POPGENE v1.32软件[26],基于Nei’距离构建UPGMA树。基于STRUCTURE和UPGMA树分组结果,对所有进行分组,使用GenAlEx v6.5进行主成分分析(PCoA)。
为了比较现代和历史时期的迁移率,使用了BAYESASS 3.4.0[27]和Migrate v3.6.8[28]软件。这两个程序都会生成参数,从中可以推断出基因流迁移率的可比测量值(m:每代由遗传移民组成的人口比例)。但每一个程序都会在不同的时间尺度上估计该参数:BAYESASS 使用贝叶斯方法和MCMC 抽样来生成m值,Migrate通过贝叶斯法推测突变比例迁移率(m)。Migrate v3.6.8使用合并法来估计成对种群之间的相对有效种群大小(θ)。
2 结果与分析
2.1 遗传多样性
对江西青钱柳的居群-位点组合(176个)进行哈迪温伯格平衡(HWE)检测,以及在各自的居群水平对每个微卫星位点对(28个位点对)进行连锁不平衡(LD)分析。结果经校正后[20],13个居群-位点组合偏离HWE平衡(P<0.05),1个位点对存在连锁不平衡现象。
8 个微卫星位点在江西省青钱柳自然居群277 个个体中共检测到81 个等位基因,每个位点的等位基因数为7~15 个,平均为10.125;平均观测杂合度(HO)为0.610;平均期望杂合度(HE)为0.597;平均Shannon 多样性指数(I)为1.178;平均多态信息含量(PIC)为0.664(表3)。
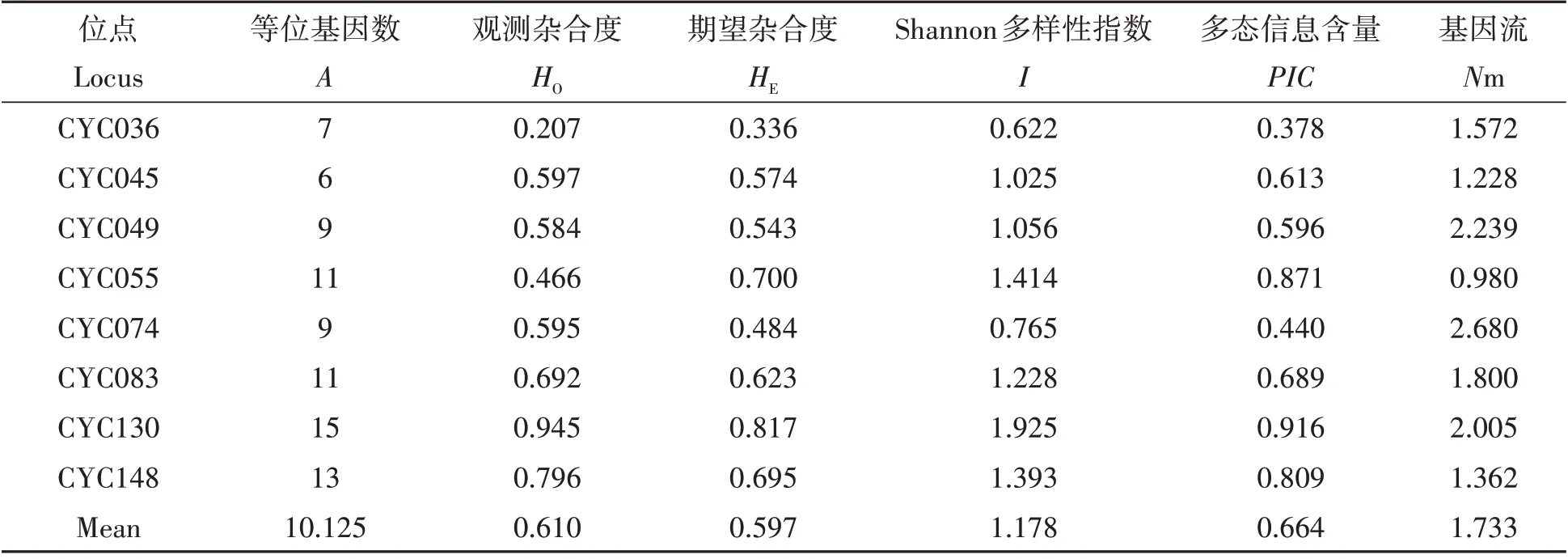
表3 青钱柳在8个微卫星位点的遗传多样性Tab.3 Summary of genetic statistics and gene flow of eight loci in the Cyclocarya paliurus
各居群的平均等位基因数(NA)从2.375(居群GX)至6.500(居群LC),平均值为4.875。观测杂合度(HO)和期望杂合度(HE)居群间差异不大,变化范围分别为0.467(居群XS)~0.750(居群JA)和0.441(居群GX)~0.664(居群YH 和LC),见表4。以上数据表明,江西省青钱柳自然居群遗传多样性水平中等偏高,各居群遗传多样性差异不大。

表4 青钱柳22个居群在8个微卫星位点的遗传多样性Tab.4 Genetic diversity of Cyclocarya paliurus from 22 populations using eight SSR primers
2.2 江西省青钱柳自然居群遗传结构
各居群的遗传分化系数(FST)差异很小,变化范围是0.093~0.102,平均值为0.097(表4)。根据对种群分化系数的划分[17],江西省青钱柳自然居群间为中度分化。江西省青钱柳居群内近交系数(FIS)除居群XS(0.207)和JX(0.110)为显著,居群SQS(0.163)为极显著和居群LC(0.184)为极其显著,其他居群近交不显著,平均近交系数为0.029(表4)。
对江西省青钱柳的22 个自然居群进行Structure 聚类分析,根据ΔK的评判结果,确认K=3 为最佳分组数(图1)。虽然江西省境内的青钱柳居群的遗传组分为3组,但它们在大部分居群间存在基因渗入现象,组分间未完全分开。不同组分在地理分布上有一定的规律,红色类型的遗传组分较多分布在江西的西北部,黄色的遗传组分主要分布在江西中部,而绿色的遗传组分主要分布在江西的东南部(图1a)。Nei’距离的UPGMA 树聚类结果与青钱柳居群的地理分布位置有一定关系(图2a),与Structure 聚类结果也有一定相似。
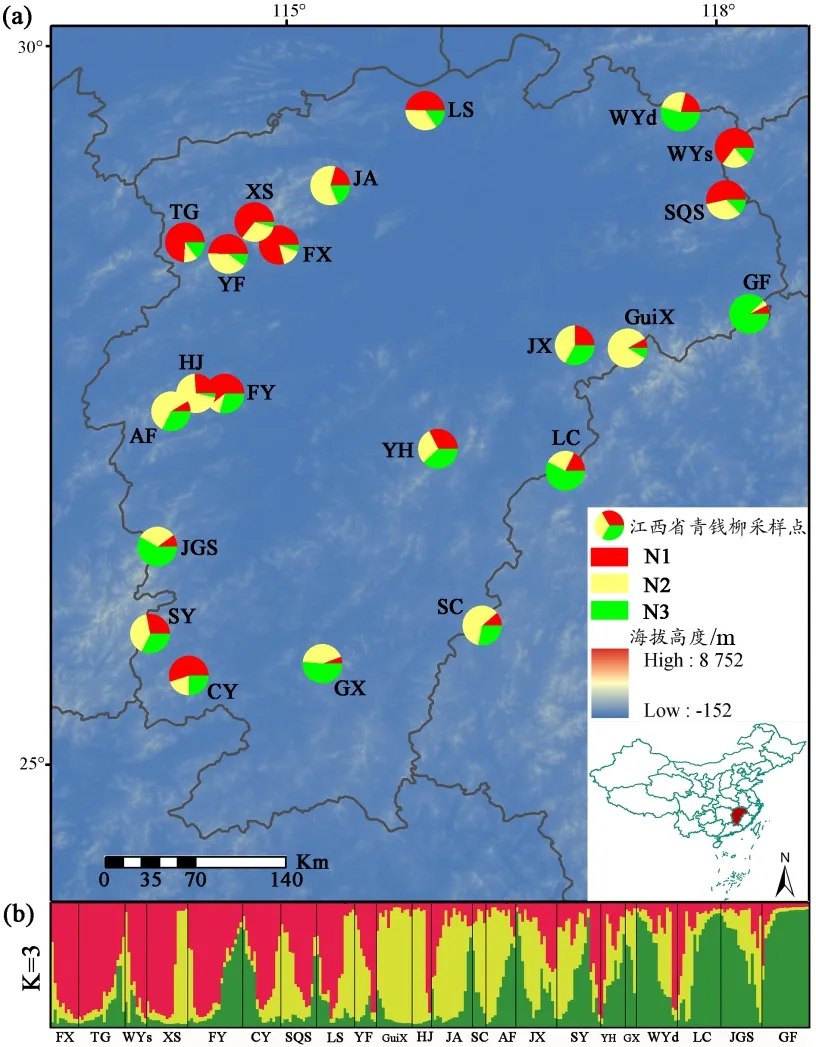
图1 基于8对微卫星引物的江西青钱柳自然居群Structure分析Fig.1 Natural population structure analysis of C.paliurus in Jiangxi Province based on 8 pairs of microsatellite primers
基于Structure 和UPGMA 树聚类分析结果(图1,图2a),将22 个居群分为3 组,分别为居群内主要为红色遗传组分的为N1(包括9个群体,分别为FX、TG、WYs、XS、FY、CY、SQS、LS、YF)、主要为黄色遗传组分的为N2(包括7 个群体,分别为GuiX、HJ、JA、SC、AF、JX、SY)、主要为绿色遗传组分的为N3(包括6 个群体,分别为YH、GX、WYd、LC、JGS、GF)。将这3组进行主成分分析(PCoA),它们在坐标上有聚类倾向(图2b),与Structure不同遗传组分的分组和分布格局相符合。
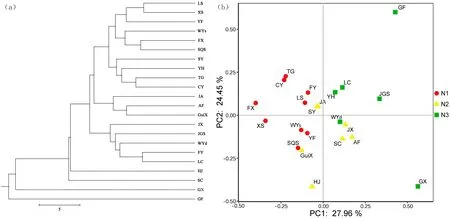
图2 基于8对微卫星引物遗传距离数据构建的江西青钱柳自然居群聚类分析Fig.2 Cluster analysis of natural populations of C.paliurus in Jiangxi Province based on genetic distance data of 8 pairs of microsatellite primers
2.3 居群间基因流
江西青钱柳自然居群之间的基因流,除位点CYC055(0.980)外,其他位点检测出的基因流(Nm)都大于1,并且平均基因流为1.733(表3),说明居群间的现代基因流较大,每代有一个以上的移民。同时,通过Migrate 软件估算,发现3 个组之间的历史基因流迁移率和现代基因流迁移率都较大,变化范围分别为0.002 7~0.020 5和0.004 5~0.062 8(图3)。
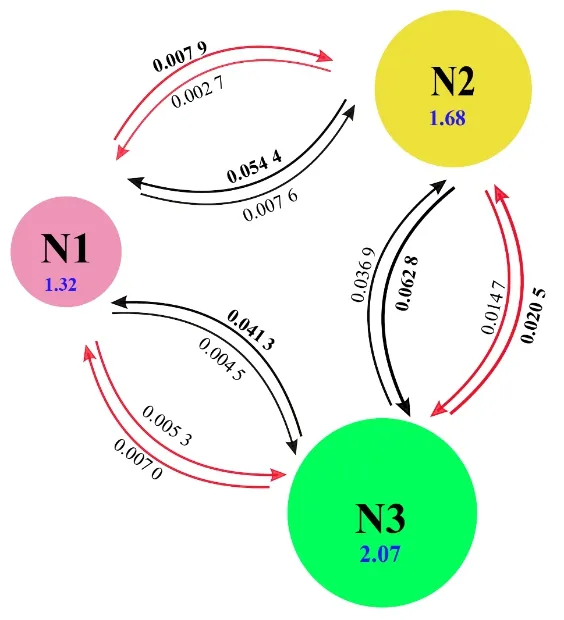
图3 江西青钱柳3个组之间的历史基因流迁移率(红色箭头)和现代基因流迁移率(黑色箭头)Fig.3 Historical gene flow mobility(red arrow)and modern gene flow mobility(black arrow)between the three groups of C.paliurus in Jiangxi Province
现代基因流迁移率与历史基因流迁移率相比较大,且3 个组分之间存在不对称的双向基因流(图3)。N1 组的现代基因流迁移率向其他两组迁出量远比迁入量小得多。而N2 组的历史基因流迁移率由其他两组向N2 组迁入较强,现代基因流迁移率向其他两组迁出较强。N3组的历史基因流迁移率向其他两组迁出较强,但现代基因流迁移率中两两组分之间N2 向N3 迁入较强,N3 向N1 迁入较强。N1、N2 和N3 组的有效种群大小(θ)分别为1.32、1.68 和2.07(图3)。
以上数据表明,江西省青钱柳历史和现代基因交流频繁,并且现代更显著。从历史和现代的基因流可以看出,N1 组种群在历史上是扩张的,而在现代是收缩的;N2 组居群在历史上是收缩的,现代是扩张的;N3组居群虽然有效种群最大,但它受到N2组较强的基因渗入,进而开始渗入N1组。
3 结论与讨论
3.1 整体上较高水平的遗传多样性
基于SSR 分子标记,本研究在江西省青钱柳自然群体中检测到高水平的多态性(HE=0.597、I=1.178)(表3),与李晓春等[11]利用SSR 标记得出的青钱柳遗传多样性(HE=0.404、I=0.626)相比较高,其原因与研究采用的标记数量、采样范围和材料个体数量有关。但陈秀娟等[10]利用ISSR 和周一旸等[9]利用SRAP 标记都得出了青钱柳种质资源具有丰富的遗传多样性的结论,与本研究结果相符。青钱柳的异二歧开花习性(青钱柳的自然群体中有两种交配类型)[29],可能是导致自然居群遗传多样性水平较高的原因之一。整体上江西青钱柳自然居群间遗传多样性水平差异不大,但居群GX 遗传多样性相比较小(HE=0.441)(表4),推测这与GX居群采样数较少有关。
3.2 江西省青钱柳自然居群的遗传结构与基因流
平均Nm 大于1,大部分居群近交不明显,原因可能是青钱柳花粉和种子的传播能力较强,并且江西省中部较多的盆地和平原为不同居群的基因交流提供了条件。但少数存在轻微的近交,如居群LC、SQS和XS,推测可能由于野生青钱柳多处于深山或保护区内,居群被郁闭的森林环境和山脉遮挡,导致花粉和种子传播受到影响。
Structure、UPGMA 树和主成分分析(PCoA)聚类分析结果表明江西省青钱柳自然居群的遗传组分为3 组,N1、N2 和N3,有一定的地理分布规律,大部分居群间存在基因渗入。Migrate 软件分析得出现代基因流迁移率与历史基因流迁移率相比较大,且3个组分之间存在不对称的双向基因流。并且从历史和现代的基因流迁移率可以看出,N1组种群在历史上是扩张的,而在现代是收缩的;N2组居群在历史上是收缩的,现代是扩张的;N3 组居群虽然有效种群最大,但它受到N2 组较强的基因渗入,进而开始渗入N1组。结合江西省内青钱柳居群的遗传结构和基因流结果,笔者推测江西省青钱柳自然居群存在中部和南部种群向北部基因渗入迁移的趋势,同时中部种群利用地理优势迅速向四周扩散。
江西省青钱柳自然居群遗传组分为3 组,历史和现代基因流共同作用,导致形成当代较高水平的遗传多样性。江西省中部主要为盆地和平原,为居群间的基因交流减少了阻碍,导致居群间分化不明显,遗传结构不清晰,但也使得该物种在这个独特的生态单元中表现出高水平的遗传多样性(尤其是西北部)。或许从环境适应性的角度来看,江西省南部居群具有优势,然而中部居群凭借基因流向四周迅速扩散的成效已经十分明显。
3.3 江西省青钱柳种质资源的保护与开发
大量研究发现青钱柳药用价值与种源密切相关[7],保护自然种质资源有利于其药用价值的进一步研究。近年来基于青钱柳资源利用和产业化发展,使得培育的人工林范围不断扩大,该树种摆脱了濒危的处境。但青钱柳自然居群是物种遗传多样性的基础,是其种质资源的源头。本研究调查发现该树种多以单株形式分布,大部分群体内个体数较少,种质资源的保护开发迫在眉睫。并且由于其木材价值较高,近年来自然群体中成年大树遭受了严重的砍伐,导致部分居群内个体数量减少。同时青钱柳是一个喜阳树种,但部分个体分布在郁闭的深林,严重制约了该物种的自然更新。
根据该物种在江西省的遗传背景,结合其面临的严峻形势,提出了以下科学保护建议。青钱柳江西省各居群具有较多遗传分化,对大部分种群实施就地保护可以使其维持进化潜力[6,30]。同时对不同人群,尤其是青少年,普及珍稀动植物保护知识的工作可有效保护现存居群个体。针对深林和单个形式分布的个体,可以采取开辟林窗和人工传粉等方法解决该物种自然更新困难的问题,扩大种群个体数量[31]。而对于开发种质资源,可选取遗传多样性水平高的种群材料,如居群YH 和LC;东南部居群(尤其是居群GF)在环境适应性上具有优势,可开发为广适性种源。
致谢:江西省教育厅科学技术研究一般项目(GJJ170248)同时对本研究给予了资助,谨致谢意!

