太子参参须多糖对免疫抑制小鼠的保护作用
乔 石, 闵思明, 胡惠宇, 曾 丽, 杜蓥蓥, 周梦圆, 曾靖祺, 张炎达, 马玉芳
(1.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002;2.福建农林大学 福建省兽医中药与动物保健重点实验室,福建 福州 350002;3.福建贝迪药业有限公司,福建 宁德 355399)
环磷酰胺是使用最广泛的抗肿瘤剂,可导致白细胞减少、骨髓抑制和免疫抑制[1].在药理试验中,连续3 d以80 mg·kg-1CY腹腔注射小鼠,可构建良好的免疫抑制小鼠模型[2],表现为体重减轻、脱毛和精神不振等.CY能减少T细胞、B细胞的绝对数量[3]、淋巴细胞的自发增殖以及IFN-γ、IL-2和IL-4的分泌[4].
太子参,又名孩儿参、童参等,临床应用悠久,具有良好的药用价值和保健作用[5].太子参参须是太子参的不定根和根尖部分,占太子参总质量的10%~15%[6],在加工过程中常留块根而弃参须,造成太子参资源的浪费.块根和参须两者均含有多糖和皂苷,参须多糖和皂苷含量分别为18.79%和0.25%,其中,参须多糖含量是块根多糖含量的53.73%[7],值得开发利用.太子参参须多糖(radix pseudostellariae fibrous roots polysaccharide, RPFRP)对免疫抑制小鼠的免疫功能具有调节作用[8],其可以促进小鼠脾淋巴细胞体外增殖及细胞因子分泌[9]以及修复免疫抑制小鼠的脾脏损伤[10],但关于RPFRP对免疫抑制小鼠保护作用的研究较少.本试验通过给小鼠灌服RPFRP两周后腹腔注射环磷酰胺,检测相关的免疫学指标,探讨RPFRP对免疫抑制小鼠的保护作用,为太子参参须的利用提供依据.
1 材料与方法
1.1 供试材料
1.1.1 太子参参须多糖 太子参参须(Radixpseudostellariaefibrous roots)由福建贝迪药业有限公司提供;RPFRP由本实验室制备并保存[8],多糖含量为60%.
1.1.2 试验动物 选取体重为(18±2) g的清洁级雄性昆明小鼠[8],检验合格,编号为0005714,购自福建医科大学实验动物中心.
1.1.3 主要试剂 CY(CC30152825)购自Baxter Oncology GmbH公司;RPMI-1640培养基(AC10238685)购自HyClone公司;胎牛血清(HQ202103)购自CellMax公司;APC Anti-Mouse CD3e(85-17-0031-81)、FITC Anti-Mouse CD4(FMF004-1000U)、PE Anti-Mouse CD8a(CB4286178)购自Tonbo Biosciences公司;反转录试剂盒(S09FG211)、荧光定量PCR检测试剂盒(21317600)购自Promega公司;淋巴瘤细胞(YAC-1)(QC228)购自上海钦诚生物科技有限公司.
1.1.4 主要仪器 包括独立送风隔离笼具(IVC-Ⅱ型,苏州市苏杭科技器材有限公司产品)、X-22R台式高速冷冻离心机(美国,Beckman)、倒置显微镜(日本,Nikon)、CO2培养箱(美国,Thermo)、SW-CJ-2G双人单面净化工作台(苏州净化设备有限公司产品)、Infinite M200 Pro多功能酶标仪(瑞士,Tecan)、PCR仪(美国,BIO-RAD Thermal Cycler)和Real-time PCR仪(美国,BIO-RADCFX96TM Real-time System).
1.2 试验方法
1.2.1 试验动物分组与处理 96只清洁级KM雄性小鼠经1周适应性饲喂后, 随机平均分成CK组(空白组),CY组(模型组),RPFRP低、中、高剂量(50、100、200 mg·kg-1)组和APS组(阳性组).第1~14天,CK组和CY组小鼠分别灌胃双蒸水,RPFRP组和APS组分别灌胃相应剂量的RPFRP和APS,第15~17天,CK组腹腔注射生理盐水,其余各组分别腹腔注射80 mg·kg-1的CY.各组小鼠采食、自由饮水.
1.2.2 小鼠血清细胞因子的检测 末次给药24 h后,小鼠摘眼球采血,3 000 r·min-1离心10 min,收集血清,置-20 ℃保存.ELISA法检测血清中IL-2、IL-4、IL-6和IFN-γ含量[11],具体操作方法见试剂盒说明书.
1.2.3 小鼠脾淋巴细胞悬液的制备 采用断颈脱臼法迫杀小鼠,75%乙醇浸润,无菌取脾,灭菌研钵中研碎脾脏,加入PBS后混匀,过滤得脾细胞悬液,离心留沉淀;加入2 mL红细胞裂解液,离心,PBS洗涤3次,再以1 500 r·min-1离心5 min;加入2 mL RPMI-1640完全培养液,涡旋混匀,台盼兰染色计数,活细胞应大于95%,调整细胞浓度至2×106个·mL-1,备用[12].
1.2.4 小鼠脾脏NK细胞活性的测定 96孔板中加入100 μL脾细胞悬液(1.5×107个·mL-1)作为效应细胞,另取等量指数生长期的YAC-1靶细胞(3×105个·mL-1)作为试验孔(效应细胞与靶细胞的体积比为50∶1),另做效应细胞对照孔(50 μL效应细胞悬液+50 μL完全培养液)、靶细胞对照孔(50 μL靶细胞悬液+50 μL完全培养液)和空白对照孔(100 μL完全培养液)[10].于37 ℃、50 mL·L-1CO2培养4 h.随后向各孔加入50 μL MTT液(2 mg·mL-1),再置37 ℃、50 mL·L-1CO2培养4 h;取出该板,离心,弃上清,按每孔150 μL加入DMSO溶液,于细胞板振荡器上避光充分振荡,以酶标仪492 nm处测定各孔D值,计算各组NK细胞杀伤活性.计算公式如下:
NK细胞杀伤率/%={D(靶细胞对照组)-[D(试验组)-D(效应细胞对照组)]/D(靶细胞对照组)}×100
1.2.5 小鼠脾淋巴细胞增殖的检测 采用MTT法检测小鼠脾淋巴细胞的增殖.96孔板(除空白孔)中加入100 μL脾细胞悬液(1.5×106个·mL-1),空白孔中加入100 μL RPMI-1640完全培养液,RPFRP协同ConA或LPS的试验孔分别加100 μL ConA或LPS(ConA, LPS终质量浓度分别为4、10 μg·mL-1)[13].于37 ℃、50 mL·L-1CO2条件下培养44 h,随后各孔加入50 μL MTT液(2 mg·mL-1),再置37 ℃、50 mL·L-1CO2条件下培养4 h;取出96孔板,离心,弃上清,各孔加入150 μL DMSO,于细胞板振荡器上避光振荡混匀,采用酶标仪测定各孔D492 nm值 .用刺激指数(SI)表示淋巴细胞的增殖能力,SI=D492 nm(试验孔)/D492 nm(空白孔).
1.2.6 小鼠脾脏T淋巴细胞亚群的检测 取适量脾细胞悬液(细胞数约106个),分别加入稀释后的CD3+、CD4+和CD8+[4]单抗10 μL(0.05 g·L-1),混匀,4 ℃避光孵育15 min;加入1 mL红细胞裂解液,15 min后,离心[10]弃上清;洗涤离心后用300 μL中性PBS重悬,经流式细胞仪检测.同时设CD3+、CD4+和CD8+单独染色标记管各1支、空白对照管1支.
1.2.7 小鼠脾细胞凋亡的检测 取脾细胞悬液,离心留下层沉淀,用PBS洗涤2次,再离心,收集(1~5)×105个细胞.分别加入500 μL的Binding Buffer液悬浮细胞、5 μL Annexin V-FITC混匀后,再加入5 μL Propidium Iodide,室温避光反应5~15 min;1 h内上流式细胞仪检测各组小鼠脾细胞的凋亡[14].
1.2.8 小鼠脾细胞因子及转录因子的mRNA转录水平检测 取脾细胞悬液,经TRIzol提取总RNA,反转录为cDNA后作为模板,利用qRT-PCR检测各组小鼠IL-2、IL-4、IL-6、IFN-γ、T-bet、GATA-3 mRNA的转录水平.各引物见表1,以β-actin为内参基因[14].计算公式为:
相对表达量=2-ΔΔCt,
ΔΔCt=(Ct目的基因-Ctβ-actin)试验组-(Ct目的基因-Ctβ-actin)对照组
Ct= -1/lg(1+Ex)·lgX0+lgN/lg(1+Ex)
式中,X0为初始模板量,Ex为扩增效率,N为荧光扩增信号达到阈值强度时扩增产物的量.
1.3 数据统计
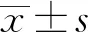
2 结果与分析
2.1 RPFRP对免疫抑制小鼠血清细胞因子含量的影响
从表2可知:与CY组相比,RPFRP各组和APS组IL-4含量显著升高(P<0.05);RPFRP高剂量组IL-6含量显著升高(P<0.05);RPFRP中、高剂量组和APS组IFN-γ含量显著升高(P<0.05).

表2 RPFRP对免疫抑制小鼠血清中IL-2、IL-4、IL-6、IFN-γ含量的影响1)
2.2 RPFRP对免疫抑制小鼠NK细胞活性的影响
从表3可知:与CK组比较,各组NK细胞杀伤活性均显著降低(P<0.05);CY组NK细胞杀伤活性最低,且RPFRP中剂量组和APS组NK细胞杀伤活性显著高于CY组(P<0.05).

表3 RPFRP对免疫抑制小鼠NK细胞杀伤活性的影响1)
2.3 RPFRP对免疫抑制小鼠脾T、B淋巴细胞增殖的影响
从表4可知:较CK组,各组小鼠T、B细胞刺激指数均显著降低(P<0.05);但与CY组相比,RPFRP中、高剂量组和APS组小鼠T细胞的刺激指数均显著升高(P<0.05),RPFRP低、中剂量组和APS组小鼠B细胞的刺激指数显著升高(P<0.05).
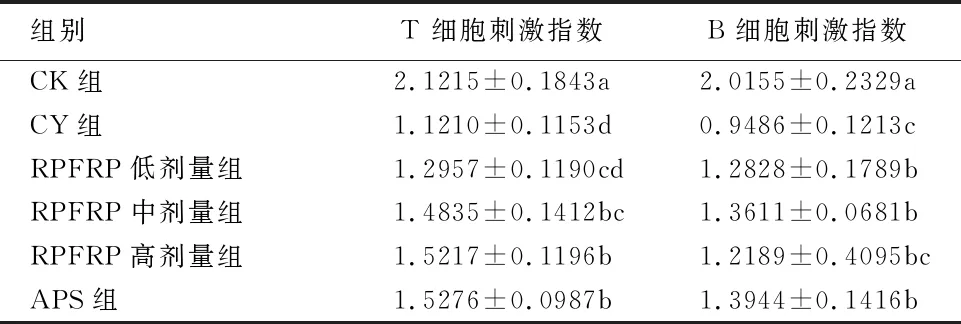
表4 RPFRP对免疫抑制小鼠淋巴细胞增殖的影响1)
2.4 RPFRP对免疫抑制小鼠脾T淋巴细胞亚群的影响
从表5可知,与CK组相比,CY组脾脏中CD3+、CD4+、CD8+及CD4+/CD8+细胞比例均显著降低(P<0.05).较CY组,RPFRP各组CD3+比例均显著提高(P<0.05),RPFRP低、高剂量组和APS组的CD3+、CD4+和CD8+比例均显著提高(P<0.05),RPFRP中、高剂量组和APS组的CD4+/CD8+比值显著升高(P<0.05).

表5 RPFRP对免疫抑制小鼠脾CD3+、CD4+、CD8+、CD4+/CD8+比例的影响1)
2.5 RPFRP对免疫抑制小鼠脾淋巴细胞凋亡的影响
如图1所示:各组早期凋亡率和总凋亡率以及CY组晚期凋亡率较CK组均显著升高(P<0.05);与CY组相比,RPFRP各组和APS组早期凋亡率、晚期凋亡率和总凋亡率均显著下降(P<0.05).
FITC+/PI-:早期凋亡率.FITC-/PI+:晚期凋亡率.TOTAL:总凋亡率.不同小写字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05).
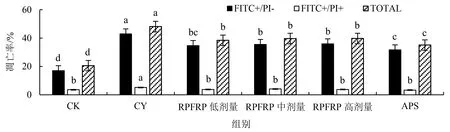
2.6 RPFRP对免疫抑制小鼠脾淋巴细胞因子及转录因子mRNA转录水平的影响
如图2所示,与CK组相比,CY组、RPFRP各组及APS组IL-2 mRNA、IL-4 mRNA和T-bet的转录水平显著降低(P<0.05),CY组和RPFRP低剂量组的IL-6的mRNA转录水平显著升高(P<0.05),CY组与RPFRP低剂量组IFN-γ的mRNA转录水平显著降低(P<0.05);CY组、RPFRP低、高剂量组GATA-3的转录水平显著升高(P<0.05),CY组和RPFRP各组T-bet/GATA-3比值显著降低(P<0.05).与CY组相比,RPFRP低剂量组IL-2的mRNA转录水平显著升高(P<0.05),RPFRP中、高剂量组和APS组IL-6的mRNA转录水平显著下降(P<0.05),RPFRP中、高剂量组和APS组IFN-γ的mRNA转录水平显著升高(P<0.05),RPFRP低、中剂量组和APS组T-bet的转录水平显著升高(P<0.05),RPFRP各组和APS组T-bet/GATA-3比值显著升高(P<0.05).
不同小写字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05).
3 讨论
T细胞在免疫系统中起重要作用,具有多种类型.目前已知CD4+T细胞可转化为两种效应表型:T辅助细胞1型(Th1)和T辅助细胞2型(Th2),前者驱动免疫应答朝向细胞免疫,而后者促进体液或过敏反应[15].Th细胞亚群的功能取决于产生的细胞因子的特定类型,如Th1细胞的GM-CSF(粒细胞和巨噬细胞集落刺激因子)、IL-2、IFN-γ和TNF-α,Th2细胞的IL-4、IL-5、IL-6和IL-10[16].本研究发现:较CY组,RPFRP中、高剂量组和APS组的IFN-γ含量显著升高,RPFRP各组和APS组的IL-4含量显著升高,RPFRP高剂量组的IL-6含量显著升高.表明RPFRP对免疫抑制小鼠细胞因子的分泌有调节作用,进而调节其机体的免疫反应.
NK细胞活性测定是分析机体细胞免疫功能的重要手段之一[17],常用于衡量细胞非特异性免疫的状况.其活性会因表面表达的各种抑制性分子而减弱,研究发现其不仅与抗肿瘤、抗病毒和免疫调节有关,当机体发生自身免疫疾病时也能参与其中[18].研究表明,白扁豆多糖中、高剂量组可明显提高免疫抑制小鼠NK细胞的活性[19].本试验结果显示,小鼠注射CY后NK细胞活性显著降低,但RPFRP能有效拮抗其降低作用,表现出对NK细胞活性的增强作用,与以上研究结果一致.
脾淋巴细胞(T/B淋巴细胞)的增殖是对抗原或有丝分裂原诱导的刺激的反应,是一种典型的非特异性免疫应答[20].T淋巴细胞及其分泌的淋巴因子与适应性或细胞介导的免疫反应有关;B淋巴细胞和分泌抗体的浆细胞是参与体液免疫反应的关键因素.通常,T淋巴细胞免疫是通过ConA刺激的细胞增殖来检测的,而B淋巴细胞免疫是通过LPS诱导的细胞增殖来检测.本试验结果显示:CY组小鼠T、B淋巴细胞刺激指数均降低,即CY可抑制脾淋巴细胞的转化.RPFRP可使小鼠脾淋巴细胞刺激指数较CY组显著升高(P<0.05),说明RPFRP可以改善CY对脾淋巴细胞转化的抑制作用.
目前研究证明,T淋巴细胞亚群的数量和比例是评估内部免疫平衡最有价值的参数,细胞免疫状态的评价指标有CD3+、CD4+、CD8+含量和CD4+/CD8+比例,CD4+/CD8+比例升高表明免疫反应的上调,反之则表明免疫反应降低[21].Huang et al[22]研究表明,中、高剂量荔枝果肉多糖可提高由CY导致免疫损伤小鼠CD4+/CD8+的比值.研究表明[23],通过CY造成小鼠的免疫抑制模型,其CD3+、CD4+和CD4+/CD8+比例明显低于正常小鼠.而本试验结果显示:CY组显著下调了CD3+、CD4+、CD8+以及CD4+/CD8+比例,导致机体内免疫功能失调,RPFRP对上述指标均有显著的上调作用,在一定程度上能够纠正这种失衡,也进一步表明RPFRP对CY引起的免疫抑制状态有明显的保护作用.
淋巴细胞的凋亡涉及到机体免疫系统相关疾病的发生与发展,如凋亡数目过多则会引起免疫功能障碍[24].刺五加多糖可抑制因CY所致小鼠脾淋巴细胞早期凋亡、晚期凋亡和总凋亡率的升高[25].本研究结果同样显示,RPFRP能显著抑制小鼠腹腔注射CY后细胞各期凋亡率的升高,从而起到对免疫抑制小鼠的保护作用,进一步验证了以上结论[24-25].
T-bet和GATA-3可以调节Th细胞分化为Th1和Th2细胞,在维持Th1和Th2型免疫反应的动态平衡中发挥着重要作用[26].Chakir et al[27]研究表明,Th1/Th2的变化可通过T-bet/GATA-3的变化来表示.研究[28]表明,Th1、Th2型细胞的变化可通过检测IFN-γ和IL-4的含量来间接得知.本研究结果显示,CY可显著降低小鼠IL-2 mRNA、IL-4 mRNA和T-bet的转录水平,而一定浓度的RPFRP可显著提高免疫抑制小鼠IL-2 mRNA、IFN-γ mRNA和T-bet mRNA的转录水平以及T-bet/GATA-3比值,表明RPFRP可以通过调节免疫抑制小鼠细胞因子mRNA和转录因子的转录水平来调节相关细胞因子转录因子的分泌,从而促使免疫抑制小鼠的细胞免疫水平趋于正常状态.
本文研究结果表明,RPFRP通过调节小鼠血清细胞因子的分泌,提高NK细胞的杀伤活性,促进脾淋巴细胞的增殖,调节T淋巴细胞亚群数量,减少脾淋巴细胞的凋亡,调节小鼠脾细胞因子及转录因子mRNA的转录水平,从而发挥其对免疫抑制小鼠的保护作用.太子参参须多糖有望在动物应激和免疫佐剂等方面发挥一定的作用.

