LAG-3及肿瘤浸润淋巴细胞在食管鳞状细胞癌患者预后中的作用
刘 尧,靳 晶, 孙雪梅,刘 静,王肖肖,刘月平*
(1. 河北医科大学第四医院病理科,河北 石家庄 050011;2. 河北医科大学第四医院肿瘤研究所,河北 石家庄 050011;3. 河北省廊坊市中医医院体检中心,河北 廊坊 065000)
食管癌是世界范围内常见的癌症相关死亡原因之一,其是东亚和中东地区的主要组织学类型[1]。对于食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)患者的预后并没有明显改观。因此,开发新的免疫治疗靶点和寻找有效的ESCC分子预测因子和替代治疗方法迫在眉睫。在肿瘤微环境中,肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)越来越受到关注,有许多证据表明ESCC中TILs数量增加[2-3]。有研究表明,TILs表面可见淋巴细胞活化基因3(lymphocyte activating gene 3,LAG-3)的高表达[4]。在多种肿瘤中也发现了LAG-3的免疫调节作用,包括肝细胞癌、肾细胞癌、胶质瘤等[5-7]。LAG-3不仅能调节T细胞的功能,其与预后也存在关联[8]。本研究中回顾性分析60例ESCC患者,探讨LAG-3的表达、TILs及其相关性,并评估LAG-3在ESCC中的预后价值。
1 资料与方法
1.1一般资料 筛选2018—2019年河北医科大学第四医院经手术切除后病理诊断明确且术前未进行新辅助治疗的ESCC手术患者60例,所有切片均由2位高年资病理医师复阅核实,根据WHO第5版消化系统肿瘤病理学和遗传学分类标准进行,确定诊断无误。按照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)和国际抗癌联盟(Union International Center of Cancer,UICC)联合发表的第8版临床分期进行分期。60例ESCC患者均经随访中心电话随访或来院复查,随访截止时间为2020年12月。
所有入选患者均同意手术样本使用且签订书面同意书,且本研究经医院伦理委员会批准。
1.2试剂及仪器 ST5020染色机、脱水机、包埋机购自徕卡显微系统(上海)贸易有限公司;苏木素、伊红购自武汉博尔夫生物科技有限公司;RM2135石蜡切片机购自徕卡显微系统(上海)贸易有限公司;兔抗人LAG-3单克隆抗体购自Abcam公司(EPR20261);全自动免疫组织化学机购自深圳市永年科技有限公司;聚合酶链反应(polymerase chain reaction,PCR)引物为上海生工生物工程股份有限公司合成。紫外分光光度计购自美国NanoDrop公司,PCR 仪购自日本TAKARA公司。
1.3方法 60例ESCC标本均经3.7%多聚甲醛固定,常规脱水、透明及石蜡包埋;将蜡块固定于RM2135石蜡切片机上,切成4 μm厚的薄片,45 ℃水中展片和贴片,以及56 ℃恒温箱中烤片,常规进行苏木精-伊红染色(hematoxylin-eosin staining)。免疫组织化学采用EnVision两步法进行,抗体稀释浓度为1∶150,DAB显色,苏木精复染。石蜡切片脱蜡、水化及自来水冲洗,根据试剂说明书对组织进行抗原修复,切片阳性对照为人正常扁桃体组织,阳性标准为细胞质着色。
1.4染色结果判定 LAG-3免疫组织化学染色定位于细胞质,人正常扁桃体组织可见散在LAG-3阳性信号,在ESCC中,LAG-3阳性表达于TILs上,而肿瘤细胞上为阴性。TILs的评估根据浸润程度分为低度浸润(TILs<10%)、中度浸润(10%≤TILs<40%)和高度浸润(TILs ≥40%)[9]。
1.5组织总RNA的提取 将冻存于液氮罐中ESCC组织取出,提取 RNA(操作按试剂盒说明书进行)。 用紫外分光光度计测定总 RNA纯度和含量,在260 nm和280 nm处的紫外吸光度值比值在(2.0±0.1)之间。分别取RNA 5 μg进行逆转录,操作过程按试剂盒说明书进行,以18 s rRNA为内参照。LAG-3所使用的引物上游为5′-GGTACCG-CCACCATGTGGGAGGCT-3′,下游为5′-ATGG-TGAGAGCCTCCACCCCCGAGGTGGCCTGCT-3′。
1.6统计学方法 应用SPSS 27.0统计软件分析数据。Spearman相关性分析LAG-3的表达与临床病理特征的的关系,Kaplan-Meier生存分析和多因素COX回归分析评估患者无进展生存期(progression-free survival,PFS)和预后影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1临床资料 60例ESCC患者年龄42~77岁,平均(63.4±9.2)岁;肿瘤直径1.0~5.8 cm,平均(3.34±1.41)cm;肿瘤位于食管上段8例,中段32例,下段20例;肿瘤分化程度为高分化者19例,中分化者27例,低分化者14例;TNM分期Ⅰ~Ⅱ期为24例,Ⅲ~Ⅳ期为36例;淋巴结阳性的患者48例,淋巴结阴性的患者12例;低度TILs 21例(35.0%),中度TILs 27例(45.0%),高度TILs 12例(20.0%);LAG-3阳性23例,阴性37例。
2.2LAG-3在食管鳞状细胞癌中的表达情况 免疫组织化学染色观察LAG-3在食管鳞状细胞癌中阳性表达位于细胞质,且阳性信号位于肿瘤浸润淋巴细胞上,其在食管鳞状细胞癌中的阳性率为38.3%(23/60),LAG-3阴性率为61.7%(37/60)。Spearman相关性分析显示,LAG-3的表达与TILs呈正相关,而与肿瘤分化程度和TNM分期呈负相关(图1,表1),差异有统计学意义(P<0.05)。

图1 食管鳞状细胞癌中LAG-3的表达(SP ×200)

表1 60例食管鳞状细胞癌中LAG-3的表达与临床病理学特征的关系Table 1 Relationship between the expression of LAG-3 and clinicopathological features in 60 cases of esophageal squamous cell carcinoma (例数)
用RNA提取试剂盒对对正常食管黏膜组织和ESCC组织抽提细胞总RNA,并利用 RT-PCR检测LAG-3的mRNA相对表达量,我们发现ESCC组织中LAG-3 mRNA表达明显高于正常食管黏膜组织(图2)。
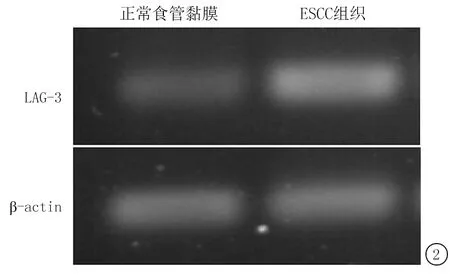
图2 正常食管黏膜组织和ESCC组织中LAG-3 mRNA的表达水平
2.3食管鳞状细胞癌中TILs状态 观察了全部ESCC的HE切片,并进行了TILs的评估,TILs在食管鳞状细胞癌中有不同程度的浸润。在60例ESCC患者中,低度TILs占35.0%(21/60),中度TILs占45.0%(27/60),高度TILs占20.0%(12/60)。TILs状态与LAG-3呈正相关,与肿瘤分化程度和TNM分期呈负相关(图3,表2)。

图3 食管鳞状细胞癌中TILs状态(HE ×200)

表2 60例食管鳞状细胞癌中TILs状态与临床病理学特征的关系Table 2 Relationship between TILs and clinicopathological features in 60 cases of esophageal squamous cell carcinoma (例数)
2.4预后分析 60例ESCC患者从确诊时开始计算生存时间,截止时间为2020年12月,随访时间12~36个月,平均24个月。随访期内死亡5例,病死率为8.3%。Kaplan-Meier生存分析结果显示:患者无进展生存期与TNM分期(HR=3.887,95%CI:2.106~6.387,P<0.001)、淋巴结状况(HR=3.132,95%CI:1.875~5.109,P=0.031)、LAG-3(HR=3.477,95%CI:2.125~5.386,P=0.035)及TILs(HR=3.512,95%CI:2.322~5.271,P=0.041)有关,差异有统计学意义(图4)。多因素COX回归分析结果显示:患者无进展生存期与TNM分期(HR=4.105,95%CI:2.217~6.489,P<0.001)、LAG-3(HR=3.789,95%CI:2.176~6.103,P<0.001)有关。

图4 患者无进展生存率与临床病理特征的关系
3 讨 论
免疫治疗是当今肿瘤治疗领域最具前景的发展方向之一,癌症免疫疗法自2013年被科学杂志评为“年度突破”以来,癌症免疫学提出了一种完全不同的治疗癌症的方法,它针对的是宿主免疫系统,而不是肿瘤细胞[10]。免疫检查点是调节自我耐受和逃离免疫系统的最重要的免疫球蛋白。目前开发较为成熟的受体靶点包括程序性死亡受体1(programmed death receptor 1,PD-1)及其配体程序性死亡配体1(programmed death ligand 1,PD-L1)和TILs上的细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated molecule-4,CTLA-4)[11-14],但由于在其相关的抗体治疗过程中患者出现了原发性耐药,新的抗肿瘤靶点的开发与探寻成为新的探究热点。由于肿瘤细胞可通过免疫检查点受体来躲避免疫系统的杀伤和识别,这就促使阻断免疫检查点受体成为近年来肿瘤免疫治疗的新方法和新思路。
淋巴细胞活化基因3(lymphocyte activation gene 3,LAG-3)是一种免疫球蛋白超家族的成员,其全称为淋巴细胞活化基因3(lymphocyte activation gene-3),它能负向调控T细胞[15]。Triebel等[16]于1990年发现了LAG-3这一免疫球蛋白,LAG-3分子的cDNA克隆首次被分离出并发现了LAG-3的免疫调控机制。Baixeras等[17]于1992年通过试验验证了LAG-3的主要配体是主要组织相容性复合体Ⅱ类分子 。新近的研究表明, LAG-3的一个重要的功能性配体被发现,即为纤维蛋白原样蛋白1(fibrinogen-like protein 1,FGL1),并揭示了肿瘤免疫中FGL1-LAG-3通路的功能[18]。Shan等[19]综述了LAG-3的结构及功能,提出它是一种由498个氨基酸构成的Ⅰ型跨膜蛋白样的免疫抑制性受体,它可以选择性表达在活化的T细胞、树突细胞和NK细胞上。LAG-3免疫球蛋白由4种具有高度同源性的胞外免疫球蛋白超家族类似(IgSF-like)结构域(D1~D4)构成,其对T细胞的调节功能与PD-1类似,主要作为递送抑制信号的受体起作用[20]。LAG-3蛋白具有负向调节T细胞的功能,在维持机体免疫系统稳态和促进肿瘤免疫逃逸和发挥免疫功能方面发挥了重要角色[21]。作为一种很有潜力的免疫检查点之一,在肿瘤免疫治疗方面LAG-3表现出了很好的效果,治疗上发挥了重要的作用[22]。在本研究的食管鳞状细胞癌队列中,纳入了60例术前未经新辅助治疗的ESCC患者,分析并探究了LAG-3在食管鳞状细胞癌中的表达情况,评估其预后价值并分析其与TILs的相关性,为将来进一步的研究打下坚实的基础,为将来的临床干预和研究提供一定的参考价值。近年来许多研究都证明了LAG-3作为一种免疫抑制性受体在肿瘤中具有较好的预后预测价值。一项Ⅱ期结肠癌的临床研究表明,LAG-3的评估有助于预测结肠癌患者的预后,并能筛选出可能从辅助化疗中受益的患者,因此,LAG-3可作为Ⅱ期结肠癌患者的预后生物标志物[23];Asano等[24]的研究表明,LAG-3可能成为三阴性乳腺癌和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌等高度恶性乳腺癌的生物标志物,可以预测新辅助治疗的效果;Wang等[25]的研究表明, LAG-3的表达与CTLA-4表达相关,LAG-3阳性表达与ESCC预后不良有关;而一项关于软组织肉瘤的研究,LAG-3在肿瘤浸润淋巴细胞上的表达与较差的存活率相关[26]。在纳入的60例ESCC患者中,LAG-3的阳性率为38.3%,LAG-3的表达与肿瘤分化程度、TNM分期和TILs有关,即LAG-3阳性信号更多见于肿瘤高、中分化的患者,且只表达于TILs上,而在肿瘤细胞上不表达,且LAG-3在TILs上的表达在TNM分期Ⅲ~Ⅳ期的患者低于Ⅰ~Ⅱ期的患者。RT-PCR检测也证实了LAG-3在ESCC中的相对表达量高于正常食管黏膜组织。LAG-3的表达更趋向于肿瘤高、中分化、TNM分期较早、TILs越高的患者中,提示这些患者将来的预后可能是较好的。在肿瘤微环境中,TILs的存在也是决定免疫检查点抑制剂抗肿瘤效果的重要因素。肿瘤中高度淋巴细胞浸润与良好的预后相关,TILs状态也成为了一个预后有用的指标。在LAG-3高表达的患者中,TILs存在相对较高。TILs状态与LAG-3呈正相关,与肿瘤分化程度和TNM分期呈负相关。患者的生存分析也证明了LAG-3是与预后高度相关的,提示LAG-3是生存率的独立预测因子。
总之,LAG-3表达的降低与TNM晚期显著相关。此外,TILs越多,LAG-3表达水平越高,生存率也越高,提示LAG-3和TILs联合可作为ESCC预后有价值的生物标志物。后续将进一步扩充数据量,以提高数据支持和ESCC患者免疫检查点抑制剂治疗的可能性。

