脾多肽对化疗所致血小板减少症雌鼠的疗效及促血小板生成的机制研究*
王如玥,谢飞,王欣,李红玉
(兰州大学1.生命科学学院,2.药学院,甘肃兰州 730000)
化学治疗药物(简称化疗)干预是临床上治疗癌症常用方案之一,但不可避免地给患者带来一系列严重的不良反应。化疗引起的血小板减少症是众多不良反应之一,其与剂量限制性毒性骨髓抑制紧密相关[1]。当血小板减少严重时需中断化疗,可能危及患者生命[2]。目前,国内治疗血小板减少症的主要方法为输注血小板,其主要药物为重组细胞因子白细胞介素11(rhIL-11)、重组人血小板生成素(rhTPO)[3]。然而输注血小板不仅疗效改善持续时间短,还会增加输血过敏性反应的风险[4]。重组细胞因子因作用机制不同,应用也受到多方面限制,如:rhIL-11 具有心血管毒性[5];rhTPO 使患者产生中和性抗体,可能导致药效下降[6]。因此,现有方案并不能完全满足化疗需降低血小板减少风险的需求,寻找安全有效的新药物、新方案具有极高的应用价值。脾多肽注射液是一种提取自小牛脾脏的天然多肽类药物,其成分为分子量<6 kD 的多肽、游离氨基酸、核酸和总糖。临床中脾多肽注射液用于改善肿瘤患者的免疫功能,减少不良反应[7]。有研究显示脾多肽注射液能够缓解化疗后的骨髓抑制并恢复患者的骨髓造血功能[8]。因此,评估脾多肽注射液对化疗所致血小板减少症的疗效并进一步研究其相关机制至关重要。
1 材料与方法
1.1 实验动物
85 只SPF 级昆明雌性小鼠[实验动物生产许可证号:SCXK(甘)2015-0001,实验动物使用许可证号:SYXK(甘)2018-0002],6~8 周龄,体重(20±2)g,适应性饲养1 周,由兰州大学实验动物中心提供。
1.2 主要试剂
重组人血小板生成素rhTPO(沈阳三生制药有限公司,批号:201804016),卡铂(山东齐鲁制药有限公司,批号:WB2J1611029),脾多肽注射液(吉林丰生制药有限公司,批号:20170926),血小板稀释剂、1%草酸铵水溶液、瑞氏-吉姆萨复合染液、牛血清白蛋白BSA(北京索莱宝科技有限公司),红细胞裂解液、PE-大鼠抗小鼠CD41 抗体(美国BD Biosciences 公司),小鼠干细胞因子ELISA 试剂盒、小鼠血小板生成素ELISA 试剂盒(武汉华美生物工程有限公司)。
1.3 主要仪器
PH100-2A41L-A 型普通生物学光学显微镜(上海凤凰光学仪器六厂),血球计数板(上海求精生化试剂仪器有限公司),CT15E 型高速离心机、CF16RX Ⅱ型低温高速离心机(日本HITACHI 株式会社),BX53 型正置荧光显微镜(日本奥林巴斯株式会社),LSRFortessa 流式细胞分析仪(美国BD Biosciences 公司),680 型酶标仪(美国Bio-Rad公司)。
1.4 方法
将雌鼠随机分为对照组、模型组、rhTPO 阳性对照组[3000 u/(kg·d)]、脾多肽注射液低剂量组[6 mg/(kg·d)]及脾多肽注射液高剂量组[60 mg/(kg·d)],分别为20 只、20 只、20 只、5 只和20 只。其中,脾多肽给药剂量以雌鼠与人等效剂量换算获得[9]。
1.4.1 血小板计数各组分别选取5 只雌鼠。化疗第1 天,正常组腹腔注射0.3 mL 生理盐水,其他4 组单次腹腔注射0.3 mL 卡铂(70 mg/kg),复制血小板减少症模型[10];次日起,rhTPO 阳性对照组、脾多肽注射液低剂量组、脾多肽注射液高剂量组腹腔注射0.3 mL 相应药物,正常组和模型组腹腔注射等量0.3 mL 生理盐水,均1 次/d,连续15 d。各组从化疗前1 天(第0 天)开始隔日尾静脉采血,光学显微镜下计血小板数。
1.4.2 实验动物分组及干预分别选取对照组、模型组、rhTPO 阳性对照组和脾多肽注射液高剂量组15 只雌鼠。化疗第1 天,正常组腹腔注射0.3 mL 生理盐水,其他3 组单次腹腔注射0.3 mL 卡铂(70 mg/kg),复制血小板减少症模型[10]。第2 天起,rhTPO 阳性对照组及脾多肽注射液高剂量组腹腔注射0.3 mL 相应药物,正常组和模型组腹腔注射0.3 mL 生理盐水,1 次/d,连续6 d。
1.4.3 骨髓巨核细胞计数化疗第8 天,每组抓取5 只雌鼠,取单侧股骨,预冷2 mL PBS 并分次冲洗髓腔至颜色发白,将获得骨髓细胞收集至EP 管中。以2 900 r/min 离心5 min,收集骨髓细胞,加入等量50%卵清稀释液,轻柔混匀,吸取骨髓稀释液,置于载玻片上,涂片,自然干燥后,瑞氏-吉姆萨复合染液染色,显微镜下100 倍计数全片骨髓巨核细胞。
1.4.4 骨髓巨核细胞百分率的检测化疗第8 天各组收集雌鼠骨髓细胞,以2 900 r/min 离心5 min,弃上清液,加入裂解液除去红细胞[11]。洗涤后通过白蛋白梯度分离法[12]富集骨髓巨核细胞,镜检可见浓缩2~3 倍的巨核细胞。然后用预冷2 mL PBS洗涤富集后的骨髓巨核细胞2 次,PE-大鼠抗小鼠CD41 抗体对巨核细胞进行染色,室温避光孵育20 min 后洗涤,重悬细胞转至流式管中上机检测[13]。
1.4.5 血清细胞因子水平的检测化疗第8 天各组摘取雌鼠眼球采血,4℃静置过夜,以3 200 r/min 离心5 min,收集血清,酶联免疫吸附法检测雌鼠血清细胞因子SCF 和TPO 的水平。根据标准品质量浓度在酶标仪450 nm 处读取光密度值,绘制标准曲线并计算血清细胞因子含量。
1.5 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用Tukey HSD 法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组不同时间点雌鼠血小板计数比较
各组雌鼠化疗前及化疗后2 d、4 d、6 d、8 d、10 d、12 d、14 d 和16 d 血小板计数比较,经重复测量设计的方差分析,结果:①不同时间点血小板计数有差异(F=22.413,P=0.000);②各组血小板计数有差异(F=6.822,P=0.006);③各组血小板计数变化趋势有差异(F=6.326,P=0.008)。由于脾多肽注射液低剂量组较模型组在化疗后的给药周期内未显著提高血小板计数,故本研究用脾多肽注射液高剂量组开展后续研究。见表1。
表1 各组不同时间点雌鼠血小板计数比较 (n=5,×109/L,±s)
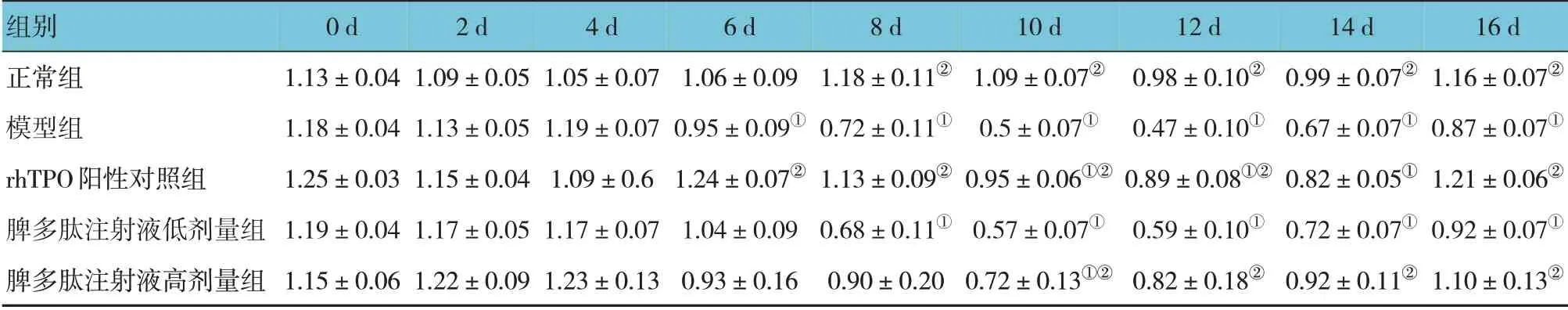
表1 各组不同时间点雌鼠血小板计数比较 (n=5,×109/L,±s)
注:①与0 d比较,P <0.05;②与模型组比较,P <0.05。
组别正常组模型组rhTPO阳性对照组脾多肽注射液低剂量组脾多肽注射液高剂量组16 d 1.16±0.07②0.87±0.07①1.21±0.06②0.92±0.07①1.10±0.13②0 d 1.13±0.04 1.18±0.04 1.25±0.03 1.19±0.04 1.15±0.06 2 d 1.09±0.05 1.13±0.05 1.15±0.04 1.17±0.05 1.22±0.09 4 d 1.05±0.07 1.19±0.07 1.09±0.6 1.17±0.07 1.23±0.13 6 d 1.06±0.09 0.95±0.09①1.24±0.07②1.04±0.09 0.93±0.16 8 d 1.18±0.11②0.72±0.11①1.13±0.09②0.68±0.11①0.90±0.20 10 d 1.09±0.07②0.5±0.07①0.95±0.06①②0.57±0.07①0.72±0.13①②12 d 0.98±0.10②0.47±0.10①0.89±0.08①②0.59±0.10①0.82±0.18②14 d 0.99±0.07②0.67±0.07①0.82±0.05①0.72±0.07①0.92±0.11②
2.2 各组雌鼠化疗后骨髓巨核细胞数量比较
镜下观察巨核细胞形态特征,其细胞核及胞体较其他细胞大,且随着巨核细胞的成熟,核多为不规则形态,胞质愈丰富。细胞染色后,深紫色部分为核,浅紫色部分为胞质(见图1)。正常组、模型组、rhTPO 阳性对照组和脾多肽注射液高剂量组的骨髓巨核细胞数量分别为(402.67±79.51)个、(122.67±42.08)个、(437.33±101.51)个和(304.00±34.92)个,经单因素方差分析,差异有统计学意义(F=16.246,P=0.000)。进一步两两比较,模型组低于正常组(P<0.05),rhTPO 阳性对照组、脾多肽注射液高剂量组高于模型组(P<0.05)。
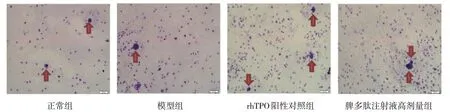
图1 4组雌鼠骨髓巨核细胞涂片 (瑞氏-吉姆萨染色×100)
2.3 各组雌鼠化疗后骨髓巨核细胞占比比较
正常组、模型组、rhTPO 阳性对照组和脾多肽注射液高剂量组雌鼠骨髓巨核细胞百分率分别为(15.3±1.87)% 、(9.02±1.88)% 、(15.4±2.50)% 及(12.9±1.07)%,经单因素方差分析,差异有统计学意义(F=12.420,P=0.000)。进一步两两比较,模型组低于正常组(P<0.05),rhTPO 阳性对照组高于模型组(P<0.05),脾多肽注射液高剂量组高于模型组(P<0.05)。该结果与骨髓巨核细胞计数观察结果变化趋势相似。见图2。

图2 4组雌鼠骨髓巨核细胞百分率的流式细胞图
2.4 各组雌鼠化疗后血清细胞因子水平比较
各组雌鼠血清细胞因子SCF、rhTPO 水平比较,差异有统计学意义(P<0.05),模型组高于正常组(P<0.05),脾多肽注射液高剂量组SCF 水平低于模型(P<0.05),rhTPO 阳性对照组rhTPO 水平低于模型组(P<0.05)。见表3。
表3 4组雌鼠化疗后血清细胞因子水平比较(n=5,pg/mL,±s)
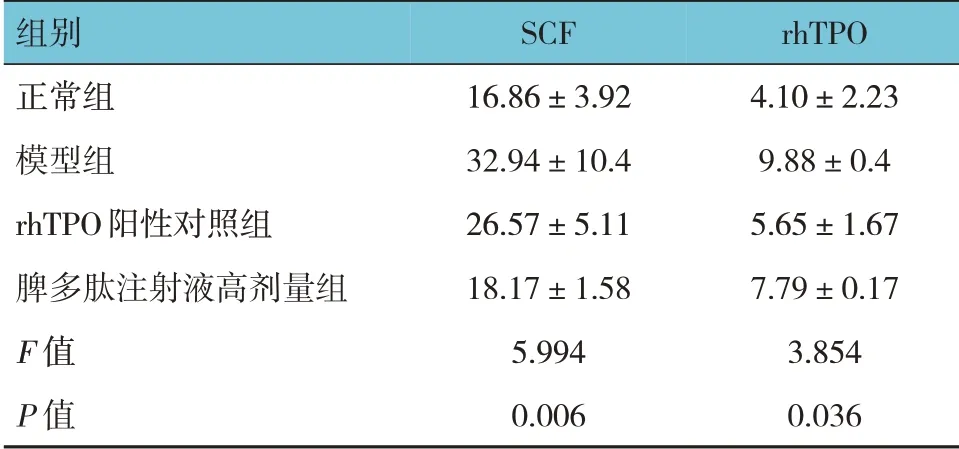
表3 4组雌鼠化疗后血清细胞因子水平比较(n=5,pg/mL,±s)
组别正常组模型组rhTPO阳性对照组脾多肽注射液高剂量组F 值P 值SCF 16.86±3.92 32.94±10.4 26.57±5.11 18.17±1.58 5.994 0.006 rhTPO 4.10±2.23 9.88±0.4 5.65±1.67 7.79±0.17 3.854 0.036
3 讨论
血小板在止血和血管修复中发挥重要作用,血小板数量过低可能导致患者致命性出血[14]。在临床上化疗会导致癌症患者血小板减少,甚至增加出血风险[15]。例如,卡铂、吉西他滨或紫杉醇等化疗药物在治疗中可能会导致血小板减少,这一剂量限制性毒性对化疗效果造成很大影响[16-17]。为了确保化疗顺利进行,临床中化疗时不得不根据患者出血和血小板计数情况,给予细胞因子药物或输注血小板[18]。脾多肽注射液广泛应用于肿瘤化疗的辅助治疗,不仅能够调节机体免疫力,增加化疗患者的耐受性,还对化疗患者的骨髓起保护作用[19]。研究表明,脾多肽注射液能有效改善化疗后肺癌患者的血细胞计数情况[20],提示脾多肽可能具有改善血小板减少的作用。本研究评估脾多肽对卡铂化疗后雌鼠血小板计数的作用情况。结果表明,70 mg/kg卡铂第8~16 天成功复制了稳定的血小板减少症模型。同时,60 mg/(kg·d)脾多肽注射液干预后,于第10~16 天显著上调了雌鼠的血小板数量,说明该剂量下的脾多肽注射液能够改善血小板减少。
巨核细胞是骨髓中能够产生血小板的常见大型多倍体细胞,由骨髓中的造血干细胞发育而来[21]。骨髓巨核细胞经过成熟以及血小板前体的形成和释放,最终让血小板释放至外周血中[22]。当化疗药物引起骨髓抑制时,与血小板生成途径相关的干细胞、祖细胞及巨核细胞会受到不同程度的破坏,从而导致血小板的生成途径减少[23-24]。有研究发现脾多肽能够增加化疗后雌鼠骨髓有核细胞的数量,改善化疗导致的骨髓抑制[25]。因此,笔者通过骨髓巨核细胞的检测,进一步研究脾多肽对化疗后雌鼠血小板减少症的作用机制。化疗第8天,显微镜观察骨髓巨核细胞发现,模型组雌鼠骨髓巨核细胞数量显著减少,这与用卡铂复制大鼠血小板减少症模型后,巨核细胞于第9 天显著减少的结果相似[26]。巨核细胞数量的减少可能与卡铂导致的造血干细胞增殖显著减少有关[27]。高剂量脾多肽干预后,模型鼠骨髓巨核细胞数量增加。采用流式细胞术检测巨核细胞在骨髓有核细胞中的百分率,试验结果与镜下观察结果相似。这进一步提示了脾多肽可能与化疗后骨髓巨核细胞数量的增加有关,从而改善了血小板生成障碍。
细胞因子与血小板生成途径密切相关,其在促进造血细胞增殖和分化上具有重要作用[28]。骨髓微环境中,TPO 能够刺激巨核细胞增殖分化[29]。SCF 参与维持造血干细胞、祖细胞的存活,促进造血干细胞、祖细胞增殖,以及巨核细胞的增殖[30-31]。因此笔者进一步研究了脾多肽对血清细胞因子的影响。结果发现,卡铂化疗诱导的雌鼠SCF水平升高。有研究表明,当外周血细胞数量减少时,细胞因子的水平上升[32],上述报道与本研究结果相似。脾多肽注射液干预后,SCF 水平降低并趋向于正常组水平。这提示脾多肽注射液可能通过参与调节化疗后雌鼠血清中的SCF 含量,保护血小板的生成途径不被破坏。细胞因子SCF 已被证明能够通过激活Akt,中和线粒体凋亡机制,抑制Caspase 活性,保护体外未成熟的巨核细胞免受化疗药物诱导的凋亡[33]。有研究报道,血小板生成素进入血液循环系统后,通过与血小板膜表面或者与骨髓巨核细胞膜表面的血小板生成素受体结合,以较低浓度维持巨核细胞以及血小板的正常水平[34]。因此,各组化疗后给药至第8 天,模型组由于血小板和巨核细胞生成减少,TPO 清除率降低,导致化疗模型组TPO 水平高于正常组,而阳性对照组由于血小板数量和巨核细胞数量较模型组显著升高,TPO 水平较模型组降低。同时,脾多肽注射液高剂量组较模型组巨核细胞数量显著增加,但血小板数量无显著增加,这可能是造成脾多肽注射液高剂量组TPO 水平与模型组无差异的原因之一。
综上所述,相较于其他致血小板减少的化疗药物,卡铂由于可以破坏骨髓中的造血干细胞,从而导致血小板减少的周期可能更长,且更难治疗。而脾多肽可以通过参与调节血清SCF 水平,保护巨核系免受骨髓抑制损伤,缓解卡铂所致血小板减少。这显示了脾多肽在辅助化疗时拮抗血小板减少的优势。笔者发现脾多肽注射液通过调节化疗后雌鼠血清SCF 水平,增加化疗后骨髓巨核细胞数量,缓解卡铂诱导的血小板减少,为脾多肽在临床中的应用提供数据支持。

