全身亚低温联合人脐带血间充质干细胞移植改善新生大鼠缺氧缺血性脑损伤后认知障碍和能量衰竭的机制研究*
祝巍,王立君,沈文生,王思思,李颖,李雨静,王静竹,高燕,方聪,赵寒阳,孙秀红,孙智勇
(1.吉林省妇幼保健院新生儿科,吉林长春 130012;2.吉林大学第一医院小儿呼吸科,吉林长春 130061;3.吉林大学第一医院转化医学院,吉林长春 130061;4.延边大学医学院儿科系,吉林延吉 133002)
新生儿大脑缺氧缺血是儿童死亡和神经功能障碍的常见原因,导致长期延迟的认知和行为缺陷[1-2]。使用干细胞或祖细胞来减轻脑损伤或促进再生是一种很有前途的治疗方法,已在不同的中枢神经系统疾病和缺血性疾病中进行了尝试[3-4]。大脑缺氧缺血导致原代细胞丧失,神经干细胞可能产生胶质细胞和神经元谱系细胞[5-6]。有证据表明,细胞替代可能是提高学习和记忆能力的最重要机制之一。然而,大脑缺氧缺血后,移植细胞经常被微环境诱导凋亡。治疗性亚低温通过多种机制发挥强大的神经保护作用,如降低代谢率、减少谷氨酸释放、减少活性氧的形成、防止血脑屏障破坏,以及调节炎症和凋亡因子的表达[7-8]。迄今为止,低温是最有希望的神经保护剂,其具有多方面的神经保护作用,包括减少梗塞,减少细胞内钙内流,降低细胞内酸中毒,抑制氧自由基的形成,预防血脑屏障破坏和抑制炎症细胞浸润。脐带血中检测到具有高增殖潜能的未成熟造血干/祖细胞、间充质干细胞等,多种干细胞及免疫细胞可以通过多种途径治疗缺氧缺血性脑病,为组织再生建立有利的细胞微环境,促进脑损伤后恢复。因此,本研究通过复制新生大鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)模型,探讨亚低温联合人脐带血间充质干细胞(umbilical cord blood mesenchymal stem cells, UCMSCs)移植治疗缺氧缺血性脑病的疗效及潜在机制。
1 材料与方法
1.1 材料
1.1.1 实验动物7日龄新生SD清洁级乳鼠330只,体重7~9 g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SCXK(辽)2020-0001,实验动物使用许可证号:SYXK(吉)2019-0012。将乳鼠饲养在(24±2)℃、12 h 昼/夜循环照明,相对湿度为40%~70%的环境中,随机获取水和食物。
1.1.2 动物分组及HIBD 模型的复制将7日龄新生乳鼠330 只,随机分为11 组,每组30 只。空白对照组(A 组)、HIBD 常温组(B 组)、HIBD 亚低温持续72 h 组(C 组)、HIBD 亚低温24 h 干细胞移植组(D组)、HIBD 亚低温48 h 干细胞移植组(E 组)、HIBD亚低温72 h 移植组(F 组)、HIBD 亚低温24 h 后持续3 d 移植干细胞(G 组)、HIBD 24 h 干细胞移植组(H 组)、HIBD 48 h 干细胞移植组(I 组)、HIBD 72 h干细胞移植组(J 组)、HIBD 24 h、48 h、72 h 干细胞移植组(K 组)。复制HIBD 模型[9]:乳鼠乙醚麻醉1 min 后,解剖显微镜下剪开乳鼠颈部正中皮肤,于胸锁乳突肌深部分离左侧颈总动脉,用6-0 F 丝线结扎两端并剪断血管,术后恢复2 h。将乳鼠放入37℃密闭缺氧箱,持续充入8%氧气+92%氮气的混合气体,气流量0.5~1.0 L/min,缺氧2 h。A 组:只分离左侧颈总动脉但不结扎,缝合皮肤后不做缺氧处理。B 组乳鼠维持肛温36~37℃。C~G 组在HIBD 模型复制成功后立即置于自制可控温箱内,维持肛温32~33℃,亚低温治疗期间乳鼠为人工管饲配方乳喂养,亚低温治疗72 h 后放回母鼠身边,由母鼠喂养。A、B、H~K 组乳鼠均由母乳喂养。干细胞移植为人脐血单核细胞(human cord blood mononuclear cells, hCMNCs)乳鼠鼻腔内移植,干细胞移植数量为:通过微量注射器鼻腔注入2 μL UCMSCs 细胞悬液(1×106个细胞),时间>5 min,留针5 min。第10 天、第21 天和第35 天各组乳鼠进行称重[10]。
1.1.3 主要试剂酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(武汉赛维尔生物有限公司),抗CD24(1∶100)、抗CD29(1∶100)(美国Abcam 公司),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)(美国Vector Laboratories Inc 公司)。
1.1.4 主要仪器Morris 水迷宫(吉林大学第一医院转化医学院),Epon(英国Agar Scientific 公司),透射电子显微镜(型号:JEM-1400 系列120 kV,美国JEOL 公司),脱水机(型号:JJ-12J)、包埋机(型号:JB-P5)(武汉俊杰电子有限公司),病理切片机(型号:RM2016,上海徕卡仪器有限公司),偏光显微镜(型号:BX-51,日本Olympus 公司),低温恒温器(型号:CM3050S-3,美国Leica Microsystems公司)。
1.2 方法
1.2.1 早期神经反射HIBD 模型复制成功后,分别观察各组乳鼠第12 天的悬崖调转反射、阴性趋地性、步态反射。①悬崖调转反射:将长、宽各30 cm的木板放置在水平桌面边缘,分别将乳鼠的双侧前爪置于木板边缘,松开乳鼠后开始记录乳鼠爬动并掉转头部与木板边缘呈90°时所需时间。如果>60 s乳鼠不能完成反射,则记录实验最高值为60 s。②阴性趋地性:将长度为30 cm 的木板置于桌面上,倾斜度为35°。乳鼠头朝下放置于木板上,双侧后爪置于木板中央,记录乳鼠爬动掉转身体并将头部朝上(180°)所需时间。如果>60 s 乳鼠仍不能调转身体则记录实验最高值为60 s。③步态反射:将乳鼠置于直径为13 cm 的白色圆纸中央,白色圆纸固定于桌面,记录乳鼠双侧前爪爬出圆纸边缘的时间。如果>60 s 乳鼠前爪不能爬出圆纸边缘,则记录实验最高值为60 s。每天3 种反射各进行3 次,取3 次的平均值,2 次反射评估间隔时间>5 min,以便乳鼠得到充分休息。
1.2.2 Morris 水迷宫实验各组HIBD 模型复制成功后28 d 进行Morris 水迷宫实验,以逃避潜伏期所需时间来评估乳鼠的学习和记忆能力。Morris 水迷宫由平台、圆形水池和记录装置组成,水池上空通过一个数字摄像机与计算机相连接。水池直径120 cm,高60 cm,池壁黑色,将水池分东北、东南、西南和西北4 个象限。每天开始实验时,在水池里注水30 cm 深,圆柱形平台由透明有机玻璃做成,置于任一象限中央,平面没于水面下l cm。为避免乳鼠直接看到平台,在水中加入白色悬浮聚乙烯颗粒,使水不透明,水温维持在(22±5)℃左右。水池四周用蓝色布帘包围,布帘上面挂有4 个几何图形作为空间参照物,且位置始终保持不变,每天换水。所有乳鼠均进行隐蔽平台实验5 d、探索实验1 d,以评价各组乳鼠学习和记忆能力。每次实验在隔音的房间内进行,水池、光源、鼠笼等实验室各物件的位置保持不变。隐蔽平台实验测试前,让乳鼠在不含平台的水池中自由游泳2 d,熟悉迷宫环境。实验时平台置于东北象限中央且位置固定不变。在平台对侧选取2 个与之距离相等的点作为入水点,将乳鼠面贴壁轻轻放入水中,记录乳鼠找到平台的时间(逃避潜伏期)。如果乳鼠90 s 内找不到平台,则潜伏期计为90 s,每天在2 个入水点各进行一次测试,用2 次逃避潜伏期的平均数进行统计分析。
1.2.3 透射电镜观察乳鼠脑组织神经元细胞及突触超微结构取HIBD 模型复制成功后第8 天乳鼠的脑组织,取1 mm×1 mm×1 mm 海马组织固定在4%多聚甲醛中,再固定于2%四氧化锇。用0.1 mol/L 磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤,在30%、50%和70%乙醇中梯度脱水,在95%乙醇、无水乙醇和环氧丙烷中继续脱水。将样品嵌入Epon,将80 nm 厚的超薄切片安装在铜网格上,透射电子显微镜下进行观察。
1.2.4 苏木精-伊红(hematoxylin-eosin, HE)染色观察乳鼠脑组织病理学变化取HIBD 模型复制成功后第3 天、第21 天乳鼠的脑组织,浸入4℃、4%甲醛溶液中24 h。脑组织脱水、包埋在石蜡块中,切成4 μm 厚的冠状切片。切片脱蜡、水化,行HE 染色。采用由偏光显微镜组成的计算机辅助图像分析系统,用200 和400 放大倍数拍摄。
1.2.5 ELISA检测白细胞介素6(Interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、神经上皮干细胞蛋白(Nestin)、β-微管蛋白(βtubulin, TUBB)、甘露糖结合蛋白(mannose-bindingprotein, MBP)含量收集各组HIBD 模型复制成功后第3 天、第8 天、第12 天乳鼠的脑组织。脑组织在1 mL 冰冷的PBS(pH=7.2)中通过超声处理均质化,4℃、12 000 r/min 离心20 min,收集上清液,采用ELISA 试剂盒测定蛋白含量。
1.2.6 免疫荧光染色检测乳鼠脑组织中移植的人脐带血CD24 和CD29 阳性表达率取HIBD 模型复制成功后第21 天乳鼠的脑组织,置于10%甲醛中固定过夜。脑组织在20%蔗糖溶液中浸泡2 d,转移到30%蔗糖溶液中2 d,最后将大脑嵌入OCT 化合物置于-80℃条件下冷冻。在低温恒温器内-20℃条件下将冷冻脑组织切成10 μm 厚的冠状切片。将切片的组织固定在载玻片上用于免疫荧光染色。PBS 清洗3 次,5~10 min/次,0.3% Triton X-100 室温孵育15 min。PBS 清洗3 次,5 min/次,5%驴血清室温封闭1 h,在4℃条件下与一抗CD24(1∶100)、CD29(1∶100)孵育过夜,PBS 洗涤后,室温下与二抗CD24(1∶200)、CD29(1∶200)孵育2 h。用PBS 洗涤载玻片3 次,10 min/次。最后用DAPI 覆盖,采用荧光显微镜Leica DMi8 对载玻片进行可视化,并通过Leica Application Suite 软件进行分析。为评估CD24(绿色荧光)和CD29(红色荧光)细胞的数量,对各组脑组织3 个不同切片中的每个视野进行计数,以平均数表示每平方毫米的阳性细胞占比。
1.2.7 荧光显微镜测量线粒体膜电位HIBD 模型复制成功第21 天,将乳鼠安乐死,灌注冰冷的PBS,从脑组织中分离出线粒体。将神经元与JC-1 染色溶液在37℃条件下孵育20 min,用JC-1 染色缓冲液洗涤,浸入神经元培养基中。使用荧光显微镜拍摄阳性染色细胞图像。正常线粒体产生红色荧光,去极化或失活的线粒体产生绿色荧光。线粒体膜电位为红色与绿色荧光的比率。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组乳鼠的行为学变化
实验前各组乳鼠行为能力正常,B 组乳鼠在行左侧颈总动脉剪断时先出现躁动、持续颤抖,继而出现精神萎靡,嗜睡少动,出箱后少数出现抽搐、全身僵直、角弓反张表现。所有HIBD 模型乳鼠在缺氧缺血过程中相继出现烦躁不安、气促、发绀、肌肉颤动、全身抖动、站立不稳、不能翻身,行走时右后肢拖步、夹尾右旋,复氧后1 h 表现为固定向左侧旋转运动。
2.2 各组乳鼠体重变化
A、B、C、D、E、F、G、H、I、J、K 组乳鼠生长第10 天、第21 天和第35 天体重比较,采用重复测量设计的方差分析,结果:①不同时间点乳鼠体重有差异(F=13.285,P=0.000),各组乳鼠第21 天与第35 天体重比较,差异有统计学意义(P<0.05);②各组乳鼠体重有差异(F=20.097,P=0.000),B 组乳鼠体重较A 组降低(P<0.05),C~K 组乳鼠体重较B 组升高(P<0.05),G、I 组乳鼠体重较B、C、D、E、F、H、J、K组均升高(P<0.05),且G 组与I 组乳鼠体重比较,差异无统计学意义(P>0.05);③各组乳鼠体重变化趋势有差异(F=28.712,P=0.000)。见表1。
表1 各组乳鼠不同时间点体重比较 (n=30,g,±s)
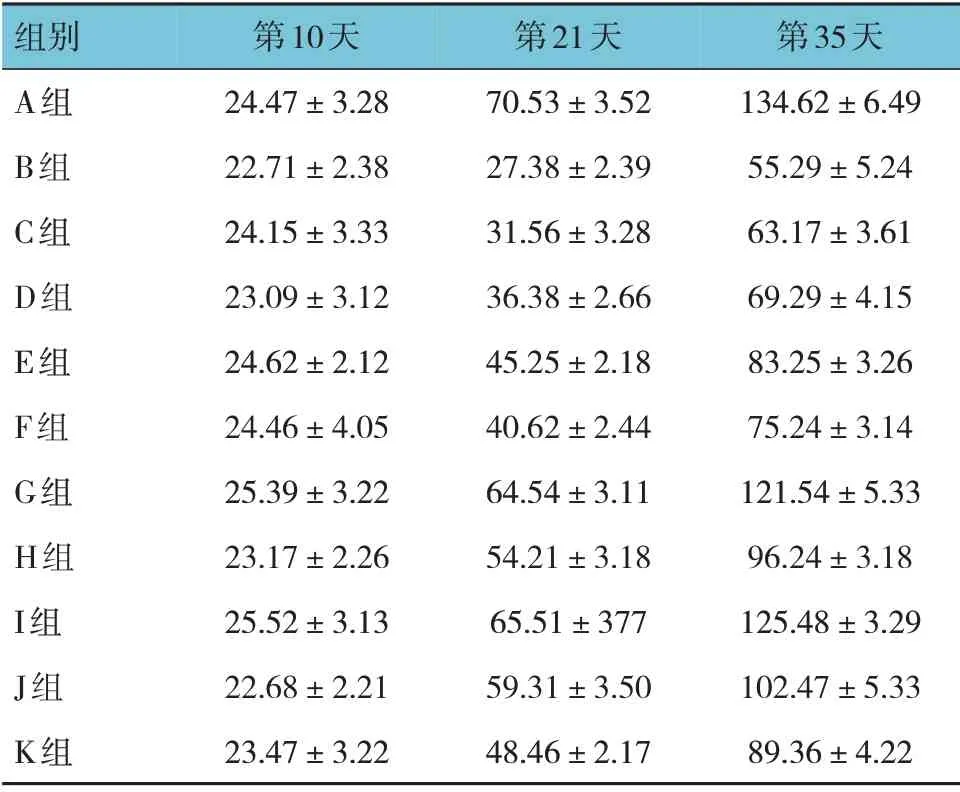
表1 各组乳鼠不同时间点体重比较 (n=30,g,±s)
组别A组B组C组D组E组F组G组H组I组J组K组第10天24.47±3.28 22.71±2.38 24.15±3.33 23.09±3.12 24.62±2.12 24.46±4.05 25.39±3.22 23.17±2.26 25.52±3.13 22.68±2.21 23.47±3.22第21天70.53±3.52 27.38±2.39 31.56±3.28 36.38±2.66 45.25±2.18 40.62±2.44 64.54±3.11 54.21±3.18 65.51±377 59.31±3.50 48.46±2.17第35天134.62±6.49 55.29±5.24 63.17±3.61 69.29±4.15 83.25±3.26 75.24±3.14 121.54±5.33 96.24±3.18 125.48±3.29 102.47±5.33 89.36±4.22
2.3 各组乳鼠早期行为反射比较
A、B、C、D、E、F、G、H、I、J、K 组HIBD 模型复制成功第12 天乳鼠的悬崖调转反射、阴性趋地性、步态反射比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:C~F 组3 种反射时间较A 组延长(P<0.05),但较B 组缩短(P<0.05);C 组3 种反射时间较A、D~J 组延长(P<0.05);G~K 组3 种反射时间与A 组比较,差异无统计学意义(P>0.05);C~F 组3 种反射时间较G~K 组延长(P<0.05)。见表2。
表2 各组乳鼠早期行为反射比较(n=30,s,±s)
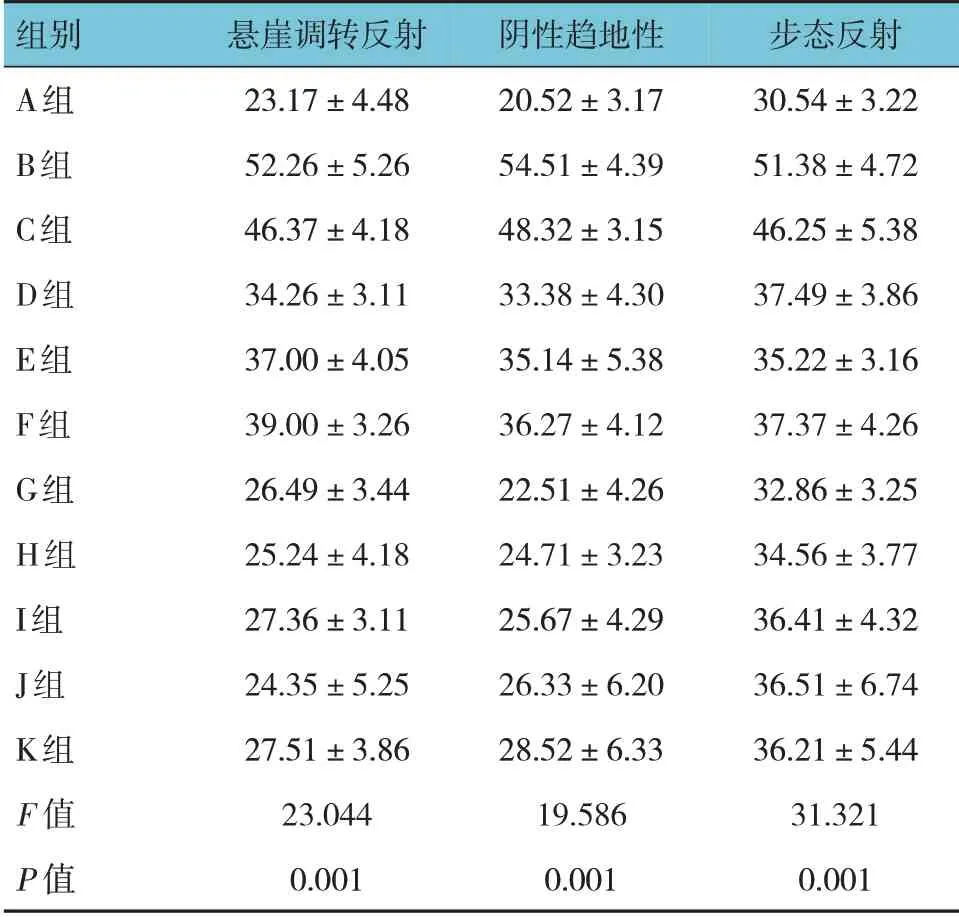
表2 各组乳鼠早期行为反射比较(n=30,s,±s)
组别A组B组C组D组E组F组G组H组I组J组K组F 值P 值悬崖调转反射23.17±4.48 52.26±5.26 46.37±4.18 34.26±3.11 37.00±4.05 39.00±3.26 26.49±3.44 25.24±4.18 27.36±3.11 24.35±5.25 27.51±3.86 23.044 0.001阴性趋地性20.52±3.17 54.51±4.39 48.32±3.15 33.38±4.30 35.14±5.38 36.27±4.12 22.51±4.26 24.71±3.23 25.67±4.29 26.33±6.20 28.52±6.33 19.586 0.001步态反射30.54±3.22 51.38±4.72 46.25±5.38 37.49±3.86 35.22±3.16 37.37±4.26 32.86±3.25 34.56±3.77 36.41±4.32 36.51±6.74 36.21±5.44 31.321 0.001
2.4 各组乳鼠脑组织病理学变化
HE 染色结果显示,与A 组比较,B~K 组乳鼠HIBD 模型复制成功后第3 天,脑间质水肿,小血管间隙增宽,左侧大脑出现大片坏死,细胞溶解、破坏、消失;皮质海马神经元排列紊乱,核固缩、崩解,细胞浓染,并见小胶质细胞。第21 天,B~K 组与A组有差异,B~K 组脑组织见不同程度的损伤,其中B 组可见大的梗塞灶及液化空洞形成,表现为组织结构模糊,炎症细胞增多,神经元坏死,神经细胞表型为空泡,细胞质淡染,细胞核固缩,染色呈蓝褐色,部分细胞发生裂解、溶解。C~K 组表现为部分炎症细胞;B 组与C~K 组比较,脑损伤程度较大。其中G、J、K 组脑损伤及炎症程度较C~F、H、I 组小。见图1。
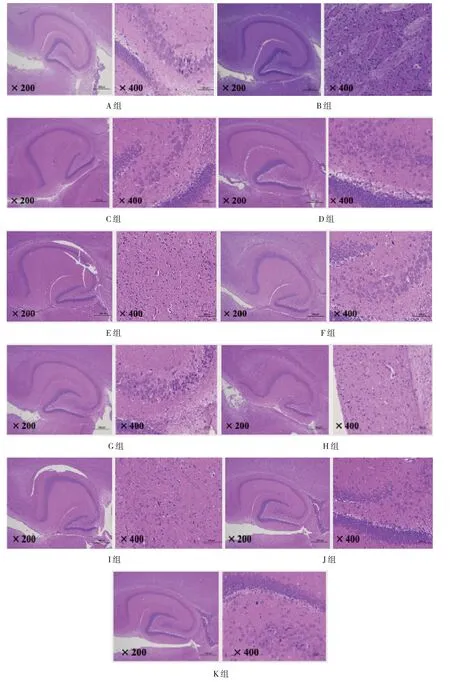
图1 各组乳鼠脑组织病理切片检查 (HE染色)
2.5 各组乳鼠逃避潜伏期比较
A、B、C、D、E、F、G、H、I、J、K 组乳鼠逃避潜伏期分别为(16.36±4.27)s、(102.56±18.44)s、(73.29±8.27)s、(68.34±6.59)s、(63.31±5.02)s、(69.44±5.68)s、(39.62±5.18)s、(74.51±6.37)s、(66.29±5.15)s、(42.55±6.43)s和(45.64±5.18)s,经单因素方差分析,差异有统计学意义(F=10.772,P=0.003)。进一步两两比较结果:B~K 组逃避潜伏期较A 组延长(P<0.05),G、J、K 组逃避潜伏期较B~F、H 组缩短(P<0.05)。
2.6 各组乳鼠脑组织神经元细胞及突触超微结构变化
超微电镜观察结果显示,A、B、C、D、E、F、G、H、I、J、K 组HIBD 模型复制成功第8 天乳鼠神经元致密区长度、致密区厚度、突触间隙宽度比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较结果:B~K 组神经元致密区长度较A 组变短(P<0.05),厚度较A 组变薄(P<0.05),而突触间隙宽度较A 组变厚(P<0.05)。C~K 组乳鼠神经元致密区长度较B 组变长(P<0.05),厚度较B 组变厚(P<0.05),突触间隙宽度较B 组变薄(P<0.05)。G~J 组乳鼠神经元致密区长度较D~F、K 组变长(P<0.05),厚度较D~F、K 组变厚(P<0.05),突触间隙宽度较D~F、K 组变薄(P<0.05)。见表3 和图2。

图2 各组乳鼠神经元细胞(透射电子显微镜)
表3 各组乳鼠神经元细胞及突触超微结构比较(n=30,nm,±s)
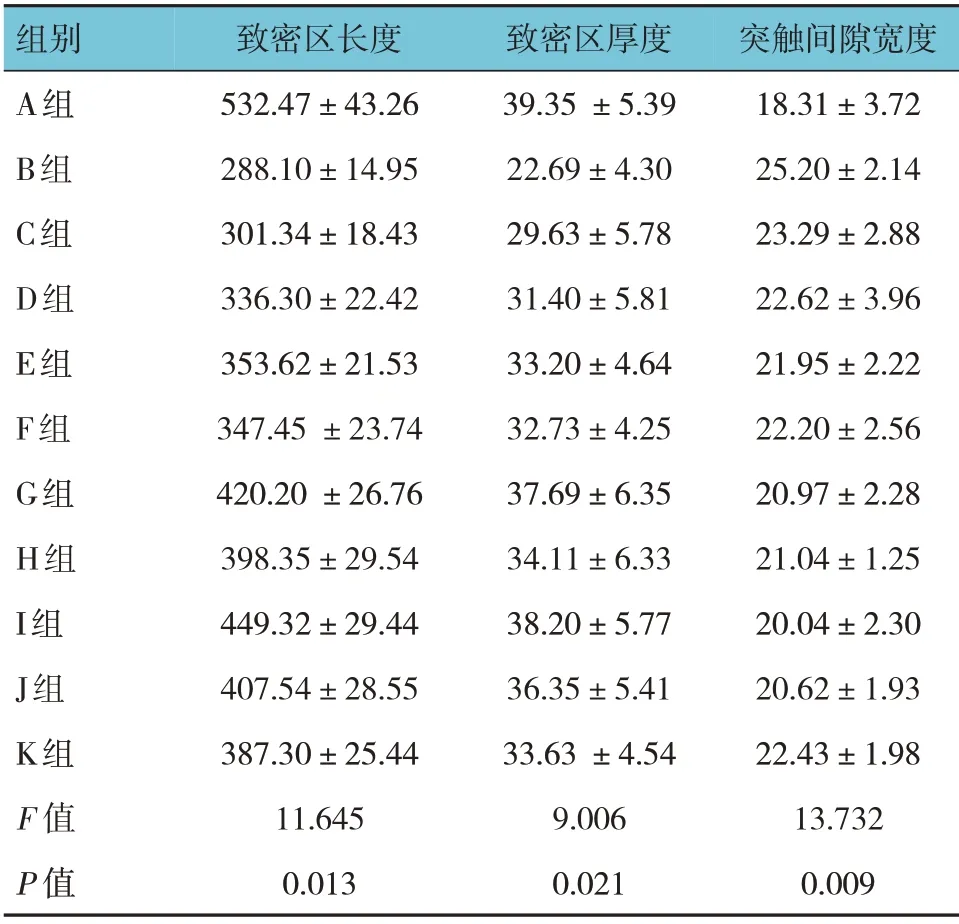
表3 各组乳鼠神经元细胞及突触超微结构比较(n=30,nm,±s)
组别A组B组C组D组E组F组G组H组I组J组K组F 值P 值致密区长度532.47±43.26 288.10±14.95 301.34±18.43 336.30±22.42 353.62±21.53 347.45±23.74 420.20±26.76 398.35±29.54 449.32±29.44 407.54±28.55 387.30±25.44 11.645 0.013致密区厚度39.35±5.39 22.69±4.30 29.63±5.78 31.40±5.81 33.20±4.64 32.73±4.25 37.69±6.35 34.11±6.33 38.20±5.77 36.35±5.41 33.63±4.54 9.006 0.021突触间隙宽度18.31±3.72 25.20±2.14 23.29±2.88 22.62±3.96 21.95±2.22 22.20±2.56 20.97±2.28 21.04±1.25 20.04±2.30 20.62±1.93 22.43±1.98 13.732 0.009
2.7 各组乳鼠脑组织炎症因子和干细胞分化标记蛋白比较
A、B、C、D、E、F、G、H、I、J、K 组HIBD 模型复制成功后第3 天、第8 天、第12 天乳鼠脑组织TNF-α、IL-6、Nestin、TUBB、MBP 比较,采用重复测量设计的方差分析,结果:①不同时间点TNF-α、IL-6、Nestin、TUBB、MBP 有差异(F=39.451、19.754、36.957、16.794和16.958,均P=0.000);②各组乳鼠TNF-α、IL-6、Nestin、TUBB、MBP 有差异(F=10.719、10.159、43.271、5.947 和11.217,P=0.000、0.000、0.000、0.012和0.000);B~K 组TNF-α、IL-6 在HIBD 模型复制成功第3 天、第8 天和第12 天较A 组升高(P<0.05),C~K 组TNF-α、IL-6 较B 组降低(P<0.05)。C~K组Nestin、TUBB 和MBP 较B 组升高(P<0.05)。③各组乳鼠TNF-α、IL-6、Nestin、TUBB、MBP 变化趋势有差异(F=22.678、25.483、6.597、20.159 和20.154,P=0.000、0.000、0.003、0.000 和0.000)。见表4。
表4 各组乳鼠不同时间点TNF-α、IL-6、Nestin、TUBB、MBP比较(n=30,pg/mL,±s)
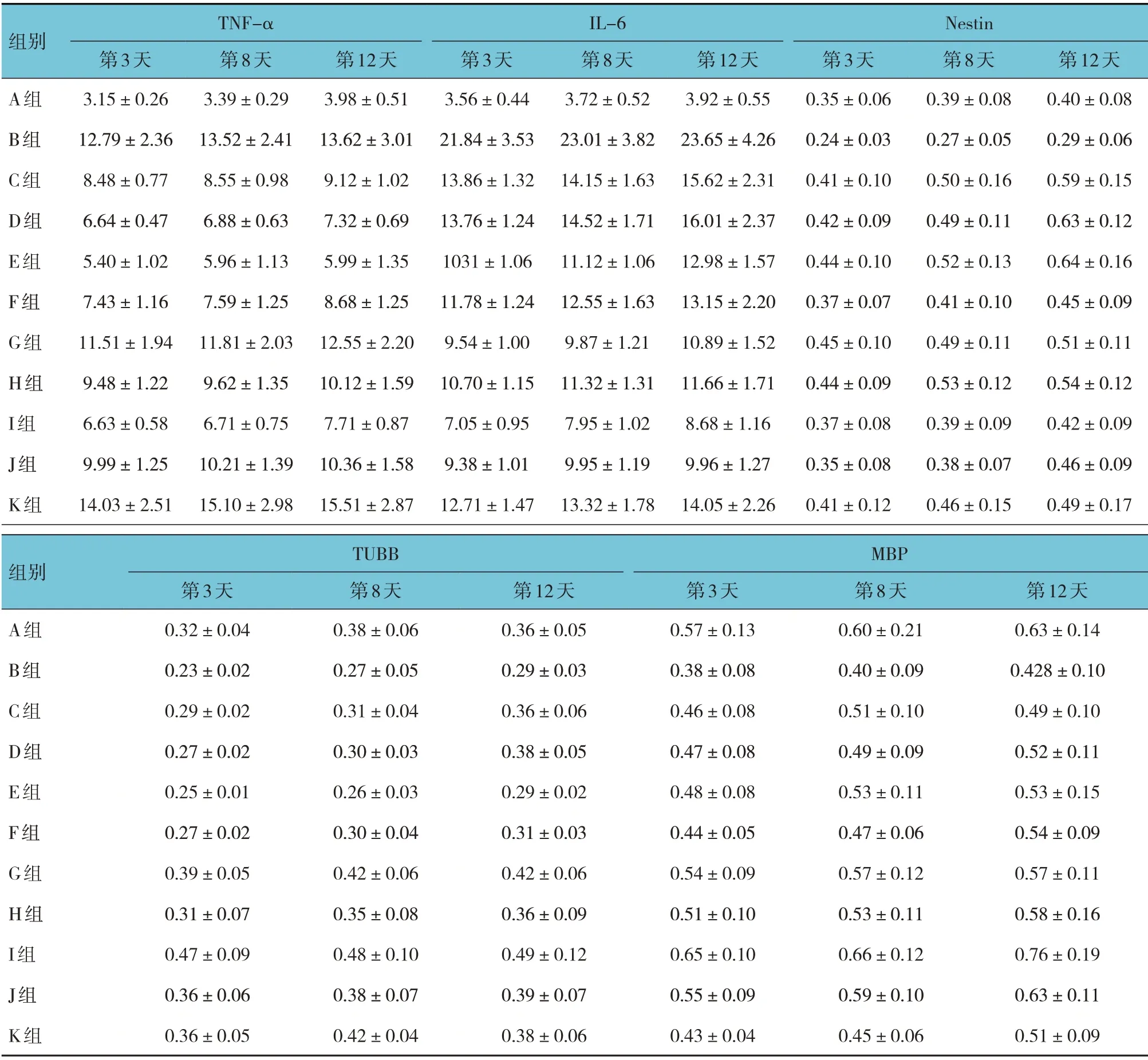
表4 各组乳鼠不同时间点TNF-α、IL-6、Nestin、TUBB、MBP比较(n=30,pg/mL,±s)
组别TNF-α IL-6 Nestin第3天0.35±0.06 0.24±0.03 0.41±0.10 0.42±0.09 0.44±0.10 0.37±0.07 0.45±0.10 0.44±0.09 0.37±0.08 0.35±0.08 0.41±0.12第3天3.15±0.26 12.79±2.36 8.48±0.77 6.64±0.47 5.40±1.02 7.43±1.16 11.51±1.94 9.48±1.22 6.63±0.58 9.99±1.25 14.03±2.51第8天3.39±0.29 13.52±2.41 8.55±0.98 6.88±0.63 5.96±1.13 7.59±1.25 11.81±2.03 9.62±1.35 6.71±0.75 10.21±1.39 15.10±2.98第12天3.98±0.51 13.62±3.01 9.12±1.02 7.32±0.69 5.99±1.35 8.68±1.25 12.55±2.20 10.12±1.59 7.71±0.87 10.36±1.58 15.51±2.87第3天3.56±0.44 21.84±3.53 13.86±1.32 13.76±1.24 1031±1.06 11.78±1.24 9.54±1.00 10.70±1.15 7.05±0.95 9.38±1.01 12.71±1.47第8天3.72±0.52 23.01±3.82 14.15±1.63 14.52±1.71 11.12±1.06 12.55±1.63 9.87±1.21 11.32±1.31 7.95±1.02 9.95±1.19 13.32±1.78第12天3.92±0.55 23.65±4.26 15.62±2.31 16.01±2.37 12.98±1.57 13.15±2.20 10.89±1.52 11.66±1.71 8.68±1.16 9.96±1.27 14.05±2.26 A组B组C组D组E组F组G组H组I组J组K组第8天0.39±0.08 0.27±0.05 0.50±0.16 0.49±0.11 0.52±0.13 0.41±0.10 0.49±0.11 0.53±0.12 0.39±0.09 0.38±0.07 0.46±0.15第12天0.40±0.08 0.29±0.06 0.59±0.15 0.63±0.12 0.64±0.16 0.45±0.09 0.51±0.11 0.54±0.12 0.42±0.09 0.46±0.09 0.49±0.17组别TUBB MBP A组B组C组D组E组F组G组H组I组J组K组第3天0.32±0.04 0.23±0.02 0.29±0.02 0.27±0.02 0.25±0.01 0.27±0.02 0.39±0.05 0.31±0.07 0.47±0.09 0.36±0.06 0.36±0.05第8天0.38±0.06 0.27±0.05 0.31±0.04 0.30±0.03 0.26±0.03 0.30±0.04 0.42±0.06 0.35±0.08 0.48±0.10 0.38±0.07 0.42±0.04第12天0.36±0.05 0.29±0.03 0.36±0.06 0.38±0.05 0.29±0.02 0.31±0.03 0.42±0.06 0.36±0.09 0.49±0.12 0.39±0.07 0.38±0.06第3天0.57±0.13 0.38±0.08 0.46±0.08 0.47±0.08 0.48±0.08 0.44±0.05 0.54±0.09 0.51±0.10 0.65±0.10 0.55±0.09 0.43±0.04第8天0.60±0.21 0.40±0.09 0.51±0.10 0.49±0.09 0.53±0.11 0.47±0.06 0.57±0.12 0.53±0.11 0.66±0.12 0.59±0.10 0.45±0.06第12天0.63±0.14 0.428±0.10 0.49±0.10 0.52±0.11 0.53±0.15 0.54±0.09 0.57±0.11 0.58±0.16 0.76±0.19 0.63±0.11 0.51±0.09
2.8 各组乳鼠脑组织CD24 和CD29 阳性表达率比较
A、B、C、D、E、F、G、H、I、J、K 组乳鼠脑组织CD24 和CD29 阳性表达率比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:A~C 组CD24 和CD29 阳性表达率较E~K 组降低(P<0.05),G、I 组较H、J、K 组CD24 和CD29 阳性表达率升高(P<0.05)。见表5 和图3。

图3 各组乳鼠脑组织CD24和CD29的阳性表达(免疫荧光染色×100)
表5 各组乳鼠脑组织CD24和CD29阳性表达率比较(n=30,%,±s)
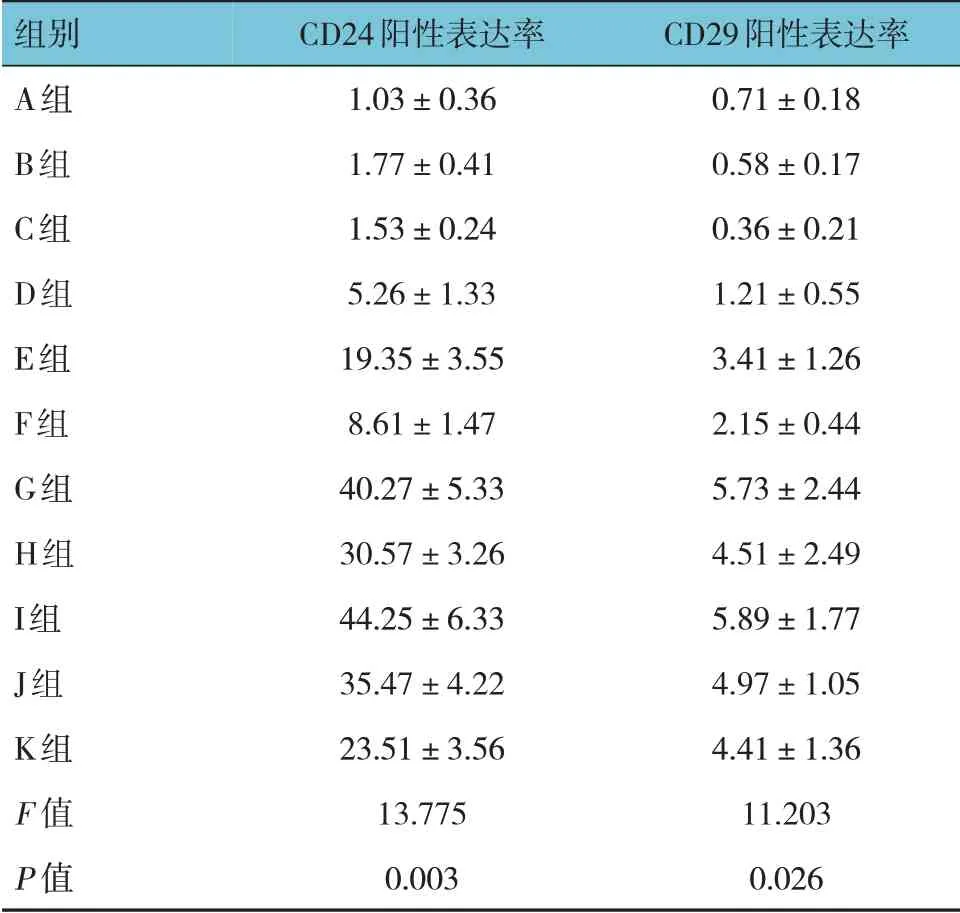
表5 各组乳鼠脑组织CD24和CD29阳性表达率比较(n=30,%,±s)
组别A组B组C组D组E组F组G组H组I组J组K组F 值P 值CD24阳性表达率1.03±0.36 1.77±0.41 1.53±0.24 5.26±1.33 19.35±3.55 8.61±1.47 40.27±5.33 30.57±3.26 44.25±6.33 35.47±4.22 23.51±3.56 13.775 0.003 CD29阳性表达率0.71±0.18 0.58±0.17 0.36±0.21 1.21±0.55 3.41±1.26 2.15±0.44 5.73±2.44 4.51±2.49 5.89±1.77 4.97±1.05 4.41±1.36 11.203 0.026
2.9 各组乳鼠脑组织线粒体膜电位比较
A、B、C、D、E、F、G、H、I、J、K 组乳鼠脑组织线粒体膜电位分别为(1.96±0.28)AU、(0.75±0.04)AU、(0.85±0.03)AU、(1.10±0.11)AU、(1.27±0.13)AU、(1.31±0.15)AU、(1.64±0.23)AU、(1.52±0.18)AU、(1.71±0.20)AU、(1.43±0.16)AU 和(1.48±0.18)AU,经单因素方差分析,差异有统计学意义(F=13.527,P=0.0014)。进一步两两比较结果:B~K 组线粒体膜电位较A 组降低(P<0.05),C~K 组线粒体膜电位较B 组升高(P<0.05),G~J 组线粒体膜电位较C~F 组升高(P <0.05)。
3 讨论
新生儿脑缺氧缺血可在12~24 h 内导致死亡或神经功能缺损(包括癫痫发作、反射改变、意识水平扭曲、发育迟缓、癫痫、智力低下和脑瘫)[11-12]。目前,人们越来越关注将干细胞移植作为以神经细胞死亡为特征的神经退行性疾病的恢复性方法。干细胞具有分裂和分化为成熟神经元和神经胶质细胞的能力,但在发育和成熟的中枢神经系统中不存在[13-14]。干细胞优先迁移到损伤区域,并在移植到缺氧缺血性脑后第14~21 天表达神经元标志物,证明大脑影响这些细胞以诱导神经元分化。UCMSCs是一种源于新生儿脐带组织中的多功能的成体干细胞(已经分化组织中的未分化细胞),具有干细胞特有的多向分化潜能。有研究证实,UCMSCs 在特定条件下可分化为脂肪、骨、软骨、神经、心肌、内皮等多种组织细胞,并且具有免疫调节特性,可用于多种病变引起的组织器官损伤修复和再生[15-16]。然而,在后期形成的神经元数量较少,可能只有5%移植细胞分化成神经元。此外,移植后细胞能力差是临床应用的严重问题。尽管>90%细胞在移植时是存活的,但只有5%~10%细胞在移植后存活。另一项研究发现,移植后2 周内,<50%移植神经干细胞继续在小鼠脑组织中存活。提高移植物存活率是提高细胞疗法临床价值的基本策略。在植入过程中,细胞受到缺氧缺血性损伤。调整缺氧缺血性大脑的微环境可以促进移植干细胞的分化和提高存活率,从而改善缺氧缺血性损伤小鼠的神经功能。亚低温可以减少缺氧缺血后损伤和缩小短暂局灶性缺血中的梗塞体积。低温为有意控制地将正常体温降至30~35℃(轻度)、28~32℃(中度)和20~28℃(深度)范围内的温度。轻度低温又称亚低温,是最有前途的神经保护剂,具有多方面的神经保护作用,并且中至深度低温同样具有保护作用。已知亚低温通过多种机制发挥强大的神经保护作用,包括降低代谢率、减少谷氨酸释放、减少活性氧的形成、防止血脑屏障破坏,以及调节炎症和凋亡因子的表达[17-20]。迄今为止,有多种冷却方法,包括冷却毯和侵入性血管内冷却装置,在临床上广泛应用。实验中,通常在动物周围放置冰袋、冰毯或施用药物来诱导亚低温。亚低温可显著降低重度颅脑创伤后患者的病死率并改善预后。有研究表明,亚低温可减少内在和外在的凋亡途径,并防止脑组织在缺血缺氧后发生继发性损伤[21-23]。本研究结果表明,亚低温联合UCMSCs 移植治疗比单一治疗更有效。HIBD 模型乳鼠表现为行为迟钝、少动,体重增长缓慢。经过低温、干细胞移植后,HIBD 模型乳鼠的神经反射行为得到明显改善,体重增加。HIBD 模型乳鼠脑组织均见不同程度的损伤,经过单一低温或干细胞移植治疗后海马神经元损伤降低,并改善神经元细胞及突触超微结构。神经炎症反应是未成熟大脑发育的关键病理生理因素。缺氧缺血性损伤的初始炎症反应导致继发性神经元损伤。缺氧缺血会激活小胶质细胞,即大脑中的常驻免疫细胞,破坏血脑屏障,导致外周白细胞浸润,从而进一步加剧炎症和脑损伤[24-26]。本研究中,亚低温、干细胞移植或联合治疗都显著降低了HIBD 模型乳鼠脑组织炎症因子TNF-α 和IL-6 水平,并发现低温下更能促进干细胞分化。HIBD 后大量活性氧的产生会导致氧化应激,线粒体是主要靶点之一[27-28]。线粒体损伤最初的特征是膜电位降低。将JC-1 荧光探针用于指示膜电位的变化,当线粒体膜电位正常时,JC-1 会在线粒体基质中积累并发出红色荧光,而当线粒体膜电位降低或塌陷时,JC-1 不能积累并发出绿色荧光。本研究中,A 组乳鼠神经元发出红色荧光,很少观察到绿色荧光;然而HIBD 乳鼠脑神经元红色荧光强度大大降低,绿色荧光明显增强。HIBD 乳鼠在经过亚低温或者干细胞治疗后线粒体膜电位损失恢复,这说明亚低温和干细胞治疗逆转了HIBD 乳鼠的能量衰竭。尽管亚低温联合干细胞移植对HIBD 发挥了保护作用,但亚低温24 h 后持续3 d 干细胞移植效果最好,因为研究中发现亚低温降低炎症反应,同时降低干细胞活性,但因持续补充干细胞,数量增多,故效果显著。本研究中,亚低温48 h 移植干细胞效果和单纯48 h 移植干细胞效果次之。其原因是24 h 炎症爆发期,炎症消耗干细胞;48 h 炎症稳定期,刺激干细胞分泌抗炎外泌体,定向分化;72 h 脑损伤期,脑神经元损伤重,干细胞大量消耗[29]。无论亚低温加干细胞移植还是单纯干细胞移植效果均优于单纯亚低温治疗。
综上所述,脐带血干细胞具有来源丰富,采集方便,对供者无伤害,干细胞增殖分化能力更强,免疫原性更低等诸多优点。亚低温联合UCMSCs 能改善HIBD 乳鼠认知障碍和能量衰竭,对脑神经有保护作用。此外,接受持续亚低温干细胞移植治疗的乳鼠在长期行为测试和组织病理变化中表现更好。

