MCT2激活Nrf2通路调控H/R视网膜神经节细胞凋亡与焦亡
张小敏, 刘 文, 蔡傲竹
(武汉大学中南医院眼科, 湖北 武汉 430070)
视网膜神经节细胞是影响视神经病变的重要细胞类型之一,例如青光眼、糖尿病视网膜病变以及视网膜缺血再灌注损伤等[1]。其中,视网膜缺血再灌注损伤是许多视网膜疾病发生的基础,也是导致视力障碍或失明的主要原因,该过程可导致视网膜神经节细胞发生一系列损伤反应,从而破坏细胞正常生理功能,加重视网膜组织损伤。单羧酸转运蛋白(monocarboxylate transporters,MCT)是溶质载体16转运蛋白家族的成员,可介导细胞乳酸、丙酮酸及其它单羧酸的跨膜转运[2]。研究表明,MCT2在整个视网膜内层大量表达,其表达受抑制将导致视网膜功能降低,同时降低光转导敏感性和谷氨酸能神经元的水平[3],这提示MCT2可能是治疗视网膜疾病和保护视力的潜在靶点。鉴于此,本研究以缺氧/复氧(hypoxia/reoxygenation,H/R)处理人视网膜神经节细胞RGC-5模拟视网膜缺血再灌注损伤模型,研究MCT2对RGC-5细胞的保护作用,并初步探究其可能的作用机制。
1 材料与方法
1.1材料:人视网膜神经节细胞RGC-5购于广州博辉生物科技公司,Nrf2抑制剂ML385(纯度99.59%,北京百奥莱博科技公司),胎牛血清、青-链霉素双抗溶液和DMEM培养基(美国HyClone公司),Lipofectamine 2000脂质体试剂盒和Trizol试剂盒(美国Invitrogen公司),M-MLV反转录试剂盒(上海生工生物工程公司),AceQ qPCR Probe Master Mix(南京诺唯赞生物公司),CCK-8试剂盒和Annexin V-FITC/PI细胞凋亡检测试剂盒(上海弗元生物公司),免疫荧光染色试剂盒(江苏凯基生物公司),Hoechst33342/PI双染试剂盒、RIPA裂解液、Bradford蛋白测定试剂盒及ECL超敏发光液(上海碧云天生物研究所),特异性抗体MCT2、Nrf2、Caspase-1、Bax、Caspase-3、Bcl-2、GSDMD、Caspase-1、NLRP3、IL-1β、GAPDH以及Alexa Fluor®647荧光二抗(英国Abcam公司),辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物公司)。pcDNA3.1-MCT2重组质粒及阴性对照pcDNA3.1-NC重组质粒交由上海吉凯基因公司设计构建。
1.2方 法
1.2.1细胞培养与转染:RGC-5细胞采用含10%胎牛血清、1%青-链霉素双抗的DMEM高糖培养基,并置于37℃、5%CO2培养箱中常规培养。取对数生长期的RGC-5细胞,接种于6孔培养板,在培养箱内过夜培养,确保细胞贴壁后密度80~90%,采用脂质体Lipofectamine 2000试剂盒将pcDNA3.1-MCT2质粒转染至RGC-5细胞中,记为MCT2组,NC组将pcDNA3.1-NC质粒转染至RGC-5细胞中,并以正常培养未经转染的RGC-5细胞作为对照组,转染具体按照试剂盒说明书进行,4h后更换培养基。转染48h后,通过实时荧光定量PCR和Western blot测定转染效果,收集各组细胞进行后续实验研究。
1.2.2实时荧光定量PCR:Trizol法提取细胞总RNA,微量核酸测定仪检测总RNA纯度与浓度,OD260/OD280值在1.8~2.0即为合格。取提取的总RNA,按照M-MLV试剂盒说明书进行逆转录合成cDNA,以获得cDNA作为模板,通过实时荧光定量PCR实验进行扩增以测定目的基因mRNA的表达水平,在CFX96荧光定量PCR仪上进行检测,GAPDH作为内参基因。程序设置为:预变性,95℃ 5min;循环反应,95℃ 10s、60℃ 30s,循环35次,实验重复3次。扩增结束后,采用χ2-ΔΔCt法计算mRNA相对表达量。具体引物序列如下:MCT2,上游引物5’-CGTTGACAGCGAGGCGAATC-3’,下游引物5’-GTGGCATTTCTGCTCCTAGAGT-3’;GAPDH,上游引物5’-AACGGATTTGGTCGTATTG-3’,下游引物5’-GGAAGATGGTGATGGGATT-3’。
1.2.3Western blot法:在细胞中加入预冷RIPA缓冲液置于冰上裂解,提取总蛋白,Bradford法检测蛋白浓度。制备10% SDS-PAGE凝胶,将蛋白样品与上样缓冲液混合,沸水浴煮沸10min,上样至凝胶加样孔内,经恒压电泳分离蛋白,通过湿转仪转至PVDF膜,以5%脱脂奶粉封闭2h,TBST洗膜,加入稀释后的一抗工作液,4℃孵育过夜。次日,弃去一抗,TBST洗膜后,加入对应稀释后的二抗工作液,室温放置1h,TBST再次洗膜,利用ECL显色,经过凝胶成像系统扫膜后拍摄图像,Image J软件分析蛋白条带灰度值,以目的蛋白与GAPDH的灰度值之比作为目的蛋白相对表达量。
1.2.4细胞H/R处理:取对数生长期的RGC-5细胞,0.25%胰酶消化,加入新鲜培养基制备细胞悬液,接种于24孔培养板,将其置于含有94%N2、5%CO2以及1%O2的培养箱,造成细胞缺氧,持续4h后,除去原培养液,更换新鲜培养液,并将细胞移至37℃、5%CO2以及21% O2的培养箱中继续培养6h,使细胞复氧。
1.2.5实验分组与处理:实验分为4组进行,具体分组与处理如下:①对照组,RGC-5细胞正常培养,不进行任何处理;②H/R组,RGC-5细胞进行H/R处理;③MCT2组,转染pcDNA3.1-MCT2质粒至RGC-5细胞,并进行H/R处理;④MCT2+ML385组,转染pcDNA3.1-MCT2质粒至RGC-5细胞,进行H/R处理后使用Nrf2抑制剂2μmoL/L的ML385处理细胞24h。各组细胞进行相应处理后,收集细胞。
1.2.6CCK-8法:将处理后的各组RGC-5细胞接种于96孔板,放置于37℃、5%CO2的培养箱内培养,分别在24、48、72h检测细胞的增殖活性,每分组设置6复孔,在各孔内加入CCK-8检测液,混合均匀,放于培养箱反应2h后,酶联免疫检测仪测定450nm处各孔细胞的光密度值(OD值)。
1.2.7流式细胞术:将收集的各组RGC-5细胞以1500rpm离心5min,弃上清,PBS洗涤沉淀,加入适量Annexin V-FITC结合缓冲液重悬细胞,调整密度为5×105个/mL,取100μL悬液移入干净离心管,依次添加5μL Annexin V-FITC和10μL PI,混匀,进行双染操作,室温避光孵育30min后,通过流式细胞仪测定各组细胞凋亡情况。
1.2.8Hoechst/PI染色法:将RGC-5细胞按分组处理完毕后,接种于含细胞爬片的24孔板中培养24h,更换为1mL含有染色液(5μL Hoechst 33342和5μL PI)的培养液进行处理,放置于37℃培养箱孵育30min,吸弃染色液,PBS清洗细胞,抗荧光淬灭剂封片,通过荧光显微镜下观察细胞染色情况,PI为红色荧光,Hoechst为蓝色荧光,随机选择6个视野,计数红染细胞与蓝染细胞,以两者比值作为PI凋亡指数。
1.2.9免疫荧光染色:收集各组RGC-5细胞接种于含细胞爬片的24孔板中,加入预冷的丙酮固定细胞,采用0.25%Triton-X穿透液室温作用10min,再用10%山羊血清在37℃下封闭2h,滴加特异性一抗Nrf2(1∶200)或Caspase-1(1∶200),湿盒内4℃孵育过夜。次日,弃一抗,并用PBS清洗干净,滴加荧光标记二抗(1∶500),室温继续孵育1h,PBS清洗后,采用DAPI常温避光孵育30min进行染核,PBS再次清洗后,通过激光共聚焦显微镜观察染色情况,并采集图片,Image Pro Plus 6.0系统计算蛋白染色的荧光强度。

2 结 果
2.1各组细胞内MCT2 mRNA与蛋白表达水平比较:转染后测定细胞内MCT2在mRNA与蛋白上的表达变化,与对照组比较,MCT2组细胞中MCT2 mRNA与蛋白的相对表达量均显著上调(P<0.05);此外,相较于NC组,MCT2组细胞中MCT2 mRNA与蛋白的相对表达量也均显著上调(P<0.05),见图1。

图1 各组细胞MCT2 mRNA与蛋白表达水平测定结果
2.2各组细胞增殖活性比较:CCK-8检测各组细胞增殖活性变化,检测结果显示,在24h、48h及72h,H/R组细胞增殖活性较对照组显著下降(P<0.05);MCT2组细胞增殖活性则显著高于H/R组细胞增殖活性(P<0.05);而相较于MCT2组,MCT2+ML385组细胞增殖活性显著下降(P<0.05),见图2。

图2 CCK-8检测各组细胞增殖活性
2.3各组细胞凋亡与焦亡水平比较:流式细胞术检测结果显示,与对照组比较,H/R组细胞凋亡率显著增加(P<0.05);MCT2组细胞凋亡率较H/R组则显著减少(P<0.05);此外,MCT2+ML385组细胞凋亡率较MCT2组显著增加(P<0.05),见图3。

图3 流式细胞术检测各组细胞凋亡率
由Hoechst/PI染色法检测结果可见,各组细胞内均出现PI红色荧光,说明细胞出现不同程度的凋亡,与对照组比较,H/R组细胞PI凋亡指数显著升高(P<0.05);与H/R组比较,MCT2组细胞PI凋亡指数显著下降(P<0.05);与MCT2组比较,MCT2+ML385组细胞PI凋亡指数则显著升高(P<0.05),见图4。
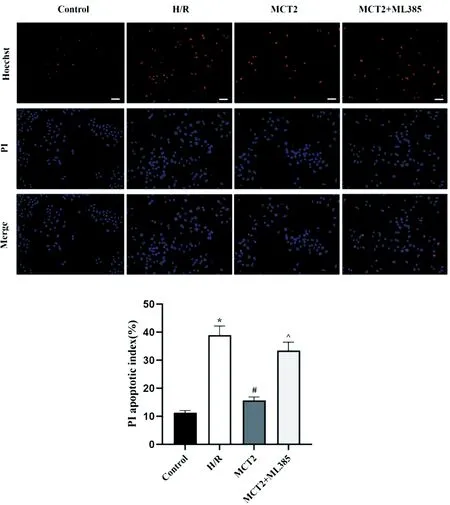
图4 Hoechst/PI染色观察各组细胞凋亡情况(比例尺=100μm)
2.4各组细胞内凋亡与焦亡蛋白表达水平比较:Western blot检测细胞内凋亡相关蛋白表达水平,与对照组比较,H/R组细胞中Bax和Caspase-3蛋白相对表达量均显著上调,Bcl-2蛋白相对表达量显著下调(P<0.05);与H/R组比较,MCT2组中Bax和Caspase-3蛋白相对表达量均显著下调,Bcl-2蛋白相对表达量显著上调(P<0.05);与MCT2组比较,MCT2+ML385组Bax和Caspase-3蛋白相对表达量均显著上调,同时,Bcl-2蛋白相对表达量显著下调(P<0.05),见图5。
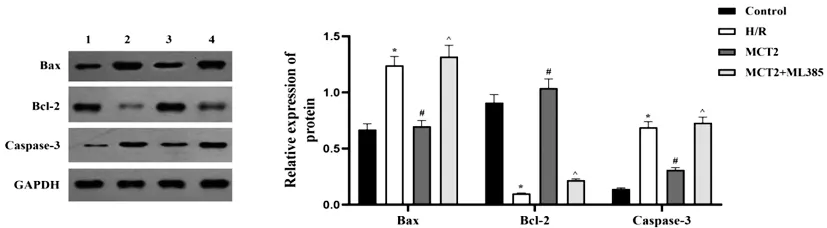
图5 Western blot检测各组细胞凋亡相关蛋白表达
Western blot检测细胞内焦亡相关蛋白表达水平,H/R组细胞内GSDMD、Caspase-1、NLRP3及IL-1β蛋白相对表达量较对照组均显著上调(P<0.05);与H/R组比较,MCT2组内GSDMD、Caspase-1、NLRP3及IL-1β蛋白相对表达量均显著下调(P<0.05);而相较于MCT2组,MCT2+ML385组GSDMD、Caspase-1、NLRP3及IL-1β蛋白相对表达量均显著上调(P<0.05),见图6。

图6 Western blot检测各组细胞焦亡相关蛋白表达
2.5各组细胞内Nrf2与Caspase-1蛋白免疫荧光染色结果:免疫荧光染色观察各组细胞内Nrf2与Caspase-1表达,染色结果显示,与对照组比较,H/R组细胞内Nrf2荧光强度显著减弱,Caspase-1荧光强度显著增强(P<0.05);与H/R组比较,MCT2组细胞内Nrf2荧光强度显著增强,Caspase-1荧光强度显著减弱(P<0.05);而相较于MCT2组,MCT2+ML385组细胞内Nrf2荧光强度显著减弱,Caspase-1荧光强度显著增强(P<0.05),见图7。
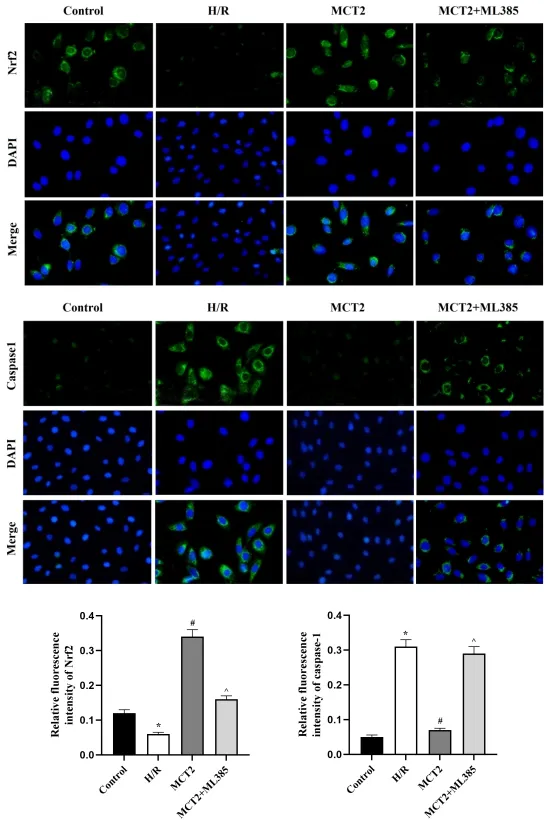
图7 免疫荧光染色检测各组细胞Nrf2与Caspase-1表达(比例尺=50μm)
3 讨 论
目前,视网膜缺血再灌注已被公认为各种视网膜疾病的关键病理因素,包括视网膜血管阻塞、急性青光眼、早产儿视网膜病变、年龄相关性黄斑变性和糖尿病性视网膜病变。急性青光眼作为最常见且最危险的眼部疾病,主要是由眼内压的快速升高和降低引起的,可导致视网膜神经节细胞凋亡、轴突损伤和后续的视力丧失。尽管滤过手术和降压药等降低眼压的策略在临床实践中得到广泛应用,但一些开角型青光眼患者无法通过降低眼压获得有效治疗,此外,降低眼压的药物如前列腺素类似物和缩瞳剂等,会产生各种局部或全身性副作用,从而限制了这类药物的临床应用[4]。因此,探索视网膜缺血再灌注损伤中相关的分子机制以开发安全有效的治疗靶点,并对促进视网膜缺血再灌注介导的其他视网膜疾病的预防与治疗均具有重大意义。
SLC16由MCT家族的14个成员组成,这些成员在细胞营养物质运输以及细胞代谢和pH调节中均发挥着重要作用,与激素、脂质和葡萄糖稳态有关。近年来,MCT1~4被研究者们进行了大量且广泛的研究,已揭示其参与了L-乳酸、丙酮酸、短链脂肪酸和单羧酸在各种组织中质子依赖型的转运[5]。此外,MCT1、MCT 2和MCT 4在多种癌症中过度表达,并与癌症的预后恶化有关,抑制其表达可作为癌症的一种新治疗策略。MCT2在肝脏、肾、脑、心脏、脾脏等多种组织中表达,与一些疾病的发生发展有关,例如Harun-Or-Rashid等[6]通过将携带MCT2的AAV2腺相关病毒注射入青光眼模型中以提高MCT2表达后发现,MCT2促进了高眼压期间单羧酸盐在视网膜中的转运,增加了视网膜神经节细胞数量,改善能量稳态并维持视网膜和视神经中的线粒体功能,这一结果提示MCT2可能在改善视网膜神经细胞损伤方面也发挥积极作用。
视网膜神经节细胞凋亡是包括青光眼在内的视网膜缺血再灌注损伤引发的疾病中的主要变化,此外,急性青光眼的眼压升高与视网膜神经元细胞的凋亡呈正相关[7]。细胞焦亡即炎症性程序性细胞死亡,对于防御病原微生物和机体危险信号至关重要。当遭受缺血性损伤时,受损组织会释放危险信号,激活NOD样受体蛋白3(NLRP3)炎症小体,活化的NLRP3炎症小体随后裂解gasdermin D(GSDMD)蛋白,同时激活下游Caspase-1而催化炎症因子IL-1β等的成熟和释放,导致细胞焦亡发生。然而,过度的细胞焦亡会导致细胞不断肿胀和裂解,从而致使细胞内容物大量释放,从而引发强烈的促炎反应[8]。在机体内,细胞凋亡与焦亡的分子机制有所不同但又存在着一定联系,肿瘤细胞焦亡机制在一定刺激下会被启动,且在细胞焦亡现象中有检测到Caspase-1通路的激活,而Caspase-1能够进一步激活caspase-3/7诱导细胞凋亡[9]。而在H/R诱导的各种组织细胞损伤中抑制细胞凋亡途径的激活及焦亡相关因子的表达,可降低炎症与组织损伤,减缓疾病病程的发展[10]。本研究结果显示,在H/R诱导的视网膜神经节细胞中过表达MCT2后,细胞增殖活性得到提高,细胞凋亡率减少,促凋亡相关蛋白Bax和Caspase-3表达下调而抗凋亡蛋白Bcl-2表达上调,同时,细胞焦亡相关蛋白GSDMD、Caspase-1、NLRP3及IL-1β表达均下调,由此说明,MCT2抑制了H/R处理下视网膜神经节细胞凋亡与焦亡。
本研究经检测发现,H/R处理下视网膜神经节细胞中Nrf2荧光强度减弱而Caspase-1荧光强度升高,而在H/R诱导的视网膜神经节细胞中过表达MCT2后,细胞中Nrf2荧光强度增加,Caspase-1荧光强度减弱。Nrf2是全身抗氧化防御系统的关键核转录因子,在正常情况下,Nrf2与具有CNC同源性(ECH)相关蛋白1(Keap1)的Kelch样红细胞衍生蛋白结合作为复合物,并被限制在细胞质中进行泛素化和蛋白酶体降解;而在压力条件下,Nrf2与Keap1分离并转移到细胞核中,与DNA启动子区域的抗氧化反应元件(ARE)结合,启动ARE控制的抗氧化酶转录[11]。大量研究表明,激活Nrf2在眼神经退行性疾病中发挥保护视网膜神经节细胞的作用,例如,富马酸单甲酯在缺血再灌注损伤后通过激活Nrf2信号通路发挥视网膜神经元保护作用,明显改善了Nrf2调节的抗氧化基因的表达,降低了炎症基因的表达,减少了神经节细胞层中神经元细胞损伤,并改善了小鼠视网膜缺血再灌注损伤后视网膜功能;MicroRNA-141作为Keap1的靶向抑制剂,可在紫外线诱导后的视网膜神经节细胞中引发Nrf2激活和细胞核易位,使ARE控制的抗氧化基因转录水平增强,从而减弱紫外线诱导的氧化应激和细胞死亡[12]。因此推测,在本研究中MCT2可能是通过激活Nrf2发挥了对H/R处理下视网膜神经节细胞的保护作用,为了进一步验证该作用,通过以Nrf2抑制剂ML385抑制Nrf2激活后,MCT2对H/R处理下视网膜神经节细胞的保护作用消失或减弱。
综上所述,H/R处理可诱导视网膜神经节细胞凋亡及焦亡,使细胞增殖活性下降,而MCT2能够减轻H/R处理下细胞凋亡与焦亡,从而达到保护视网膜的作用,该作用可能是通过介导Nrf2激活实现的。本研究为视网膜缺血再灌注损伤以及其他视网膜相关疾病的治疗研究提供了分子机制及理论依据,但关于MCT2在该体内试验中是否同样发挥作用需要进一步验证。

