多模态超声在脑死亡器官捐献移植肝术后监测中的应用
沈 燕,李永峰,肖春华,李 鸿,杨 薇,张升宁,吕燕琼,杨皖东,丁世兰
(昆明市第一人民医院超声科,云南 昆明 650224)
随着肝移植手术技术日渐成熟,肝移植手术目前已成为治疗各种终末期肝脏疾病的最佳手段,不仅可以延长患者的生存率,还可以明显提高患者的生活质量[1]。肝脏作为DBD 的重要捐献器官,在临床救治中发挥了重要作用,虽然现代肝移植技术已取得较大进步,但努力提高肝移植术后的存活率仍然是影响肝移植深入发展的世界性难题,同时也严重制约了我国器官移植事业的发展[2]。肝移植术后并发症是导致术后移植肝失功和受体死亡的主要原因,是影响肝移植存活的重大难题,特别是血管并发症,其发生率高达25%,致死率约为37%,这会对患者身心健康及生命安全产生严重影响[3]。多模态超声采用综合技术作为移植肝术后监测的一种新方式,结合二维灰阶超声、CDFI、PW 和CEUS 对肝移植术后实现灰阶、血流、微灌注等检查,反映移植肝的形态结构、血流动力学及微灌注等信息,无创、便捷、实时、快速地综合分析,本研究将多模态超声对 DBD 肝移植术后并发症的检查结果与病理、其他影像学检查、实验室检查或临床手术治疗进行对照,分析多模态超声的诊断准确性,探讨多模态超声在DBD 肝移植术后监测中的应用价值。
1 资料与方法
1.1 临床资料
选取2018 年1 月至 2021 年12 月在昆明市第一人民医院进行DBD 肝移植术的移植肝患者57例,其中原位肝移植53例,肝肾联合移植1例,原位肝移植合并肝左叶切除术(减体积)3例。男性44例,女性13例,年龄4~72 岁,平均46 岁。受体肝脏术前原发疾病为:肝恶性肿瘤18例,慢性乙型肝炎肝硬化16例,丙型肝炎肝硬化5例,酒精性肝硬化5例,胆汁性肝硬化2例,急性肝功能衰竭2例,自身免疫性肝病肝硬化2例,门静脉海绵窦样变性1例,慢性肝衰竭1例,肝豆状核变性3例,药物性肝硬化1例,进行性家族性肝内胆汁淤积症1例。
1.2 仪器与方法
1.2.1 仪器采用Philips EPIQ5、东芝 Aplio500、日立Noblus 等超声诊断仪,腹部凸阵探头频率为2-5 MHz。
1.2.2 研究方法将二维超声、CDFI、频谱多普勒定义为常规超声。应用常规超声监测移植肝,术后1 d 内进行首次超声检查,术后1 周内每天1 次,1 周后隔天1 次,2 周后每周1~2 次直至3 个月,遇异常情况可以适当增减检查频率。移植术后常规检查内容包括:(1)二维超声观察移植肝形态大小、实质回声及血管情况,肝内外胆管有无狭窄及扩张,移植肝周围、胸腔及腹腔有无异常回;(2)CDFI 及PW 观察血流通畅情况和频谱形态,并测量血流参数。对常规超声检查怀疑有移植肝血管并发症者(如血管显示困难、血流充盈差、可疑狭窄或血栓)、移植肝内或肝周出现不能确定的异常病变进一步行CEUS 检查。CEUS 采用东芝 Aplio500、Philips EPIQ5 超声诊断仪,频率为2~5 MHz,造影剂为声诺维(Sono Vue)微泡,经左肘正中静脉团注,每次注射2.4 mL,应用二维超声检查定位疑似异常区域,探头保持不动,注入造影剂后即刻启动计时功能,计时1 min,必要时重复注射1 次,并将全过程用实时动态存储录像,观察移植肝异常血管及病变的增强模式、增强水平、增强形态、增强均匀性、增强后边界及退出模式,直至造影剂完全排出。所有超声检查均由1 位具备5 a 以上工作经验的超声科医师完成。多模态超声提示并发症后均进行了进一步影像学检查如CT、MR、DSA(血管造影)或肝穿活检以明确诊断。
2 结果
2.1 肝移植术后并发症
本研究对57例DBD 移植肝术后行超声监测,经超声诊断各种术后并发症的发生率见表1。本研究对15例患者行CEUS 检查,其原因及造影特征见表2,其中6例常规超声诊断可疑移植肝血管并发症,经超声造影最后确诊,9例移植肝血管显示困难,经超声造影显示清楚。本研究超声漏诊肝动脉假性动脉瘤1例。

表1 超声监测肝移植术后各种并发症的发生率(%)Tab.1 The incidence of complications after liver transplantation was monitored by ultrasound(%)

表2 超声造影病例的原因和造影特征Tab.2 Causes and features of cases with contrast-enhanced ultrasound
2.2 门静脉及腔静脉系统并发症
2.2.1 肝动脉并发症肝动脉狭窄2例,1例常规超声检查肝门区未见肝动脉显示,行CEUS 检查肝门区肝动脉显影,内径纤细、间断显示,呈“串珠样”,肝实质呈不均匀低增强,提示肝动脉狭窄,经DSA 证实。另1例常规超声显示移植肝动脉局部狭窄,狭窄处呈湍流,狭窄处血流峰值流速、RI(阻力指数)增高;CEUS:移植肝动脉吻合口狭窄,经腹部血管三维重建证实(图1a~d)。

图1 肝动脉狭窄Fig.1 Hepatic artery stenosis
2.2.2 门静脉及腔静脉系统并发症(1)门静脉血栓2例:常规超声表现为管腔内附壁低回声或稍低回声,血流绕行,怀疑附壁血栓形成,CEUS显示血栓处造影剂充盈缺损,进一步证实附壁血栓形成;(2)下腔静脉血栓1例:术后常规超声发现下腔静脉内实性附壁稍低回声,考虑附壁血栓形成,CDFI 表现管腔内局部血流信号充盈缺损;CEUS 显示移植肝后段下腔静脉管腔内见造影剂灌注缺损区,提示附壁血栓形成;CT 三维重建显示:下腔静脉管腔内见局部充盈缺损,考虑附壁血栓形成(图2a~d);(3)下腔静脉狭窄2例:二维超声均表现移植肝后段下腔静脉见局部狭窄,CDFI 表现狭窄处血流信号变细;CEUS 提示下腔静脉吻合口处狭窄,经CT 扫描三维重建证实(图3a~d)。
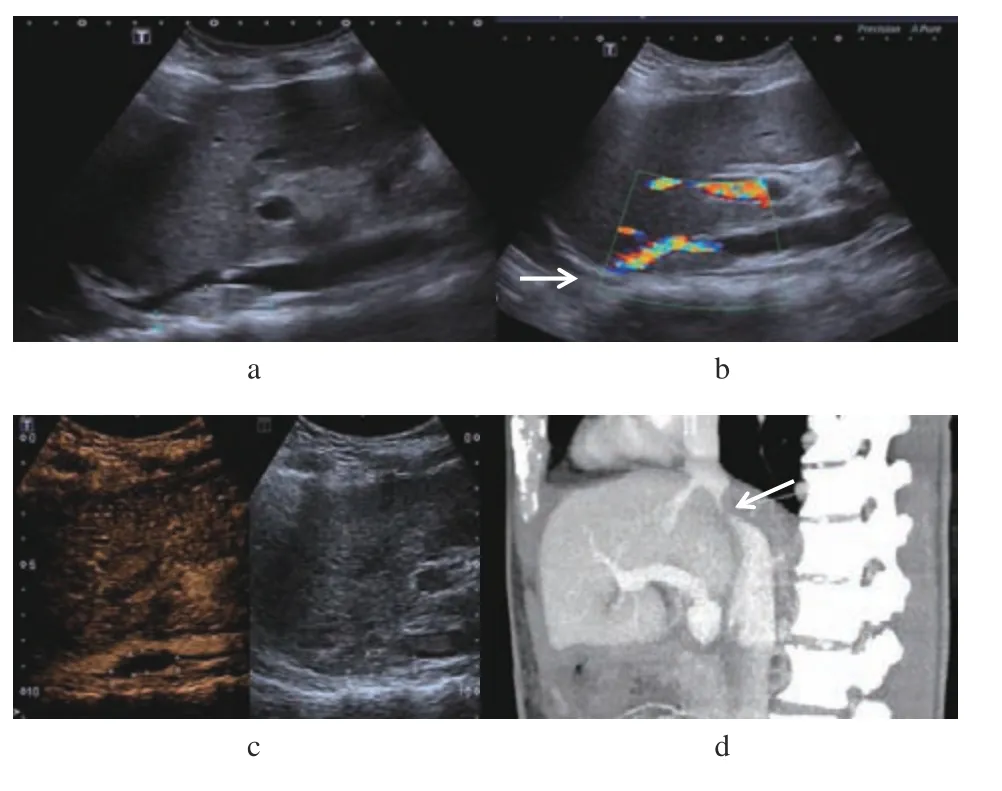
图2 下腔静脉血栓Fig.2 Inferior vena cava thrombosis
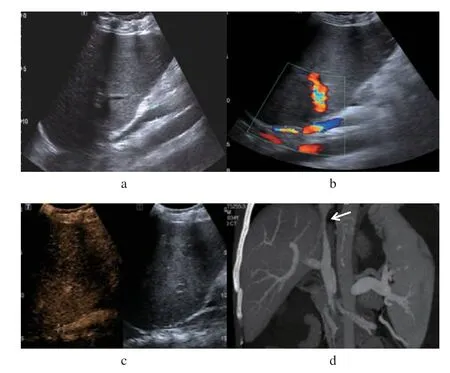
图3 下腔静脉狭窄Fig.3 Inferior vena cava stenosis
2.2.3 胆道并发症(1)胆道狭窄3例:1例术后3a 超声提示:胆总管吻合口狭窄并肝内外胆管扩张(图4a~d),患者谷氨酰氨转移酶明显高于正常,MRCP(磁共振胰胆管造影):胆总管吻合口狭窄,汇管区胆管扩张,肝内胆管扩张。1例术后第20 日超声提示:肝内胆管轻度扩张,肝门区胆总管显示欠清,壁明显增厚,内径变窄。患者胆红素继续升高,行“ERCP+胆道支架置入”术,造影显示:胆道吻合口狭窄,给放入胆道支架。另1例术后两月常规超声示:肝门部胆总管呈梭状扩张,下段狭窄,肝内胆管轻度扩张;患者经胆道成形、T 管引流术手术治疗,术后T 管造影示:胆总管中段狭窄;(2)胆汁瘤1例:术后3 月余常规超声示肝右叶散在分布的不规则片状无回声区,大小不一,边界欠清,其内透声稍差,较大位于右前叶近包膜下,CDFI:无回声区内无血流信号。CEUS 表现为无回声区内三期均无增强,考虑胆汁瘤,行超声引导下肝右前叶液性包块穿刺引流术,证实为胆汁瘤。

图4 胆总管吻合口狭窄Fig.4 Common bile duct anastomotic stenosis
2.2.4 肝脓肿形成1例术后3 月,患者发热,有菌血症,多模态超声表现:常规超声提示肝内多发不均质稍低回声结构,边界尚清,内部回声不均,CDFI:病灶周边及内部无明显血流信号,考虑肝脓肿,超声引导下肝右前叶液性包块穿刺引流术,抽出脓液,术后超声检查治疗有效(图5)。

图5 肝脓肿Fig.5 Liver abscess
2.2.5 一般常见并发症本组病例中57例术后均出现胸腹腔积液,31例有血肿形成,其中肝内血肿2例,肝周血肿29例。
2.2.6 罕见并发症超声漏诊肝动脉假性动脉瘤1例:术后常规超声监测未检出肝动脉假性动脉瘤,术后第38 天患者突然出现血压下降、腹痛、心悸、气难喘,急诊床旁B 超示:腹腔大量积血,立即行剖腹探查+肝动脉瘤破裂修补术,术中诊断为肝动脉瘤破裂出血。
3 讨论
超声检查是DBD 肝移植术后的常规检查及监测方法,多模态超声可观察移植肝的形态大小、内部回声、胆管吻合情况、肝内及肝周有无异常,胸腔及腹腔有无积液,观察血管吻合情况及管腔内有无异常回声,观察血流充盈情况和频谱形态并测量血流参数,联合应用多模态超声,可大大提高诊断肝移植术后并发症特别是血管并发症的准确性[4]。
肝移植术后血管并发症中有4%~5%为肝动脉狭窄,基本发生在吻合口[5],本研究认为当常规超声检查肝动脉显示困难或可疑狭窄时,可经超声造影进一步检查,超声造影可较准确的评价血管的通畅性,判断血管的狭窄部位,同时还能观察肝实质的灌注情况。超声造影可直接显示门静脉或下腔静脉狭窄处管腔变细,有研究报道在少数情况下,有如门静脉或下腔静脉吻合口显示不清时,而CDFI 显示有高速湍流或涡流怀疑狭窄时,即可行超声造影协助诊断[6]。超声造影可避免彩色多普勒超声的不足,有利于准确判断门静脉及下腔静脉栓塞及其程度,鉴别癌栓和血栓,超声造影还可判断血管是否完全栓塞,建议彩色多普勒超声诊断不明确时,应尽可能采用超声造影进行诊断。虽然胆道狭窄最终需经皮肝穿胆道造影或逆行胰胆管造影明确诊断,本研究认为通过超声监测移植肝的胆道,能较早且较容易发现胆管的局部狭窄及扩张,超声检查可作为胆管狭窄的初筛方法,还能较容易发现胆管结石或胆泥形成。有相关文献报道,超声造影可观察胆管壁动脉期的灌注情况,从而了解胆管壁的血供情况[7]。当胆汁从肝胆管腔渗出到肝实质内形成包裹性胆汁淤积时,在肝脏的超声、CT 等影像上表现为囊性肿瘤样结构,可称之为胆汁瘤(Biloma),手术后创面渗胆是手术后胆汁瘤的基本成因[8]。超声上有时可见无回声区与扩张的末梢胆管相连通,合并感染时,无回声内可见点状或絮状弱回声[9],本研究结果与其一至。另外,相关报道还认为胆汁瘤需要与肝脓肿、肿瘤复发灶、梗死灶等鉴别,一般胆汁瘤无“经时变化”的特点,即连续观察其大小及内部回声无明显变化[10],必要时需超声引导穿刺确诊并抽吸治疗。有关研究报道感染是DBD 肝移植术后常见的并发症和致死的主要原因之一,常继发于胆道并发症后,多数由细菌引起,少数是真菌性的,腹腔的任何部位均可发生[11],当感染出现肝内外脓肿时,超声对其诊断及治疗均有帮助,超声造影可提高诊断准确性,表现为动脉期脓肿周边高增强,内部为无增强或低增强,门脉期及延迟期或增强晚期脓肿周边增强消退,内部为无增强。
一般常见并发症:胸腹腔积液,多发生在术后1 周内,超声可动态监测术后胸腔积液的量,量多时可在超声定位下行胸腔穿刺引流术;超声还可根据积液的透声判断有无合并感染,如伴有感染时,液性暗区内透声差,可见絮点状回声,当出现大量腹水时,应警惕肝静脉流出道梗阻,急性腹腔内出血等情况。在血管、胆管周围的血肿,可对管道造成压迫,如其压迫导致血管腔严重狭窄,可经手术清除血肿来解除其对血管的压迫。
本研究超声检查漏诊肝动脉假性动脉瘤1例,有研究报道肝移植术后,肝动脉假性动脉瘤十分罕见,未破裂的假性动脉瘤常无临床表现,不易发现,目前确诊的方法为动脉造影[12],常规超声在术后常规检查中则可作为筛选方法,但较小较深的动脉瘤容易漏诊,所以DBD 肝移植术后当患者突然出现血压下降,腹腔内积液量短期内增多时,应考虑到有肝动脉假性动脉瘤破裂出血的可能。
常规超声在监测移植肝时,其基础作用有着不可忽略的临床价值,CEUS 应用到血管的灌注,能够从不同侧面提供更多的诊断信息,提高常规超声诊断的准确性,辅以CEUS 可显著提高移植肝术后血供异常的诊断效率,但其图像质量也受限于患者自身条件的干扰,如肥胖、肠气、腹水等,复杂的侧枝小血管重叠、畸形等空间位置关系难以准确判断,金属支架会产生严重的反射回声干扰,均会使CEUS 确诊存在局限性。联合应用多模态超声检查可实时、动态全程监测脑死亡器官捐献移植肝患者,具有价格低廉、方便快捷、无创无放射、可重复等优点,清晰、直观的显示异常部位、性质及程度,联合诊断、综合分析,大大增强诊断信心,为移植肝术后异常的诊断和鉴别诊断提供线索,为临床做到早诊断、早预防、早治疗提供重要的依据,多模态超声可作为脑死亡器官捐献移植肝术后连续监测的一种更敏感、更有效的影像学检查方法,能显著提高并发症的诊断率,延长患者术后生存时间,具有广阔的应用前景和临床价值。

