HCT-ALB 在脓毒症相关性脑病早期诊断中的运用价值
李从信 ,张大鹏 ,沐领捷 ,杨吉林 ,董丽宏 ,王怡洁
(1)昆明医科大学第一附属医院ICU,云南 昆明 650032;2)昆明美兆健康体检中心,云南 昆明 650032)
脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)是脓毒症引起的常见的神经并发症,其临床表现为精神混乱、注意力下降、定向力障碍、精认知障碍,甚至引起昏迷[1]。SAE 在临床上发生率很高,与脓毒症患者死亡率增加有关,严重影响着患者的近期预后。来自我国的最新研究表明43.6%的严重脓毒症患者会发生SAE,其中有接近42.5%的SAE 患者死亡[2]。同时,另一研究显示则表明有多达70%的脓毒症幸存者可能表现出持续的神经损害,包括情绪、认知和运动功能的改变,而致使患者远期生活质量明显下降[3]。然而,由于目前临床没有准确而有效的脑功能检测方法,使得SAE 的早期诊断困难。本研究从临床指标入手,旨在寻找临床上简便可行的方法对SAE 做出早期准确的诊断。
1 对象与方法
1.1 研究对象
收集2020 年4 月至2022 年4 月入住昆明医科大学第一附属医院ICU 脓毒症患者72例,其中脓毒症脑病组(SAE)31例,无脓毒症脑病组(Ne-SAE)41例。
入组标准:(1)脓毒症诊断参照《关于脓毒症和脓毒症休克定义的第三个国际共识(脓毒症3.0)》[4];(2)脓毒症相关性脑病被定义为在脓毒症存在和没有任何排除标准的情况下的脑功能障碍[1]。采用ICU 意识水平分值的困惑评定法(CAMICU)、GCS 和镇静量表(RASS)对患者评估,CAMICU 阳性者为SAE组,阴性者为Ne-SAE组;(3)年龄 > 18 岁。
排除标准:(1)任何既存或当前的中枢神经系统疾病,包括头部创伤、脑卒中、癫痫、颅内感染和阿尔茨海默症、肝性脑病、肺性脑病和严重电解质失衡、并发血液病、恶性肿瘤、心脏骤停等;(2)入院后48 h 内死亡。
本研究通过医院伦理委员会批准(2020-L-30),所有患者家属签署知情同意书。
1.2 研究方法
1.2.1 临床资料由2 名主治及以上医师对脓毒症、SAE 进行诊断,急性生理功能和慢性健康状况评分系统Ⅱ(APACHEⅡ)、器官功能衰竭(SOFA)评分取入院24 h 内最差值记录,收集患者性别、年龄、感染部位、血常规、血生化、病原学相关数据。根据毛细血管渗漏指数(CLI)定义C 反应蛋白CRP(mg/dl)与血清白蛋白ALB(g/L)的比值×100[5],红细胞压积与血清白蛋白差值为HCT(%)-ALB(g/L)[6],计算CLI 及HCT-ALB。
1.2.2 血液指标检测入院24 h 内采集外周静脉血3 mL 分离出血浆,保存于本院生物样本库-80 ℃冰箱。采用ELISA 试剂盒(BioSourceHtauAG,Camarillo,CA)测定血浆NT-proCNP、S100A 8、Tau 蛋白、C5a。
1.3 统计学处理
所有数据使用SPSS 21.0 软件进行统计。计量资料数据用均数±标准差(SD)()表示,满足正态分布的用Student’st检验。计数资料以例(%)表示,采用χ2检验。绘制受试者特征曲线(receiveroperatorchar-acteristics,ROC ),计算ROC 曲线下面积(areaun-dercurve,AUC)、灵敏度、特异度和截断值。P< 0.05 表示差异有统计学意义。
2 结果
2.1 一般资料比较
根据脓毒症及脓毒症脑病的诊断标准,将患者分为2组,结果发现SAE组患者APACHEⅡ评分、SOFA 评分明显较Ne-SAE组患者升高(P<0.000 1),患者性别、年龄、感染部位、病原菌检出在两组间差异无统计学意义,见表1。
表1 SAE组与Ne-SAE组患者一般资料比较()Tab.1 The comparison of general data between SAE group and Ne-SAE group()

表1 SAE组与Ne-SAE组患者一般资料比较()Tab.1 The comparison of general data between SAE group and Ne-SAE group()
*P < 0.05,**P < 0.01,***P < 0.001。
2.2 血液指标比较
SAE 患者外周血中存在的一些标志物,可以提示脑功能或脑结构受损。检测结果明确在SAE组患者血浆中NT-proCNP 和S100A 8 较Ne-SAE组明显升高(P< 0.05);而Tau 蛋白和C5a 水平在2组间差异无统计学意义(P> 0.05),见表2。表明某些标志物可能可以用来诊断和监测SAE 在脓毒症患者中的发生。
表2 SAE组与Ne-SAE组患者血浆NT-proCNP、S100A 8、C5a 和Tau 蛋白比较[(),pg/mL]Tab.2 The comparison of the levels of NT-proCNP,S100A 8,C5a,and Tau proteins between SAE group and Ne-SAE group[(),pg/mL]
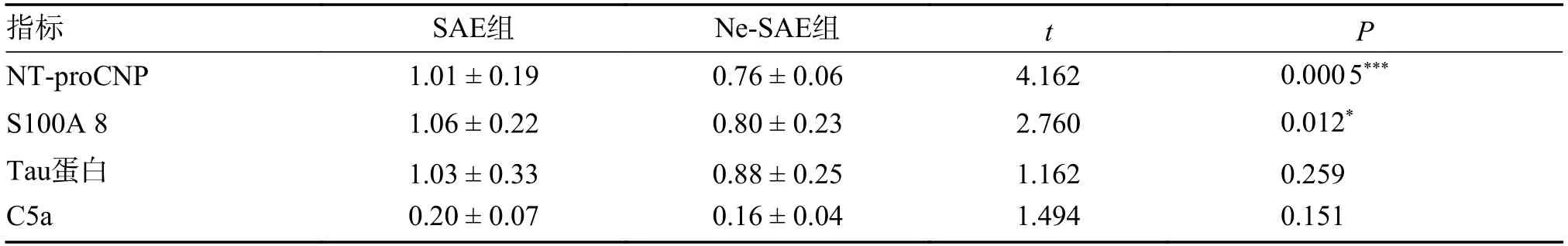
表2 SAE组与Ne-SAE组患者血浆NT-proCNP、S100A 8、C5a 和Tau 蛋白比较[(),pg/mL]Tab.2 The comparison of the levels of NT-proCNP,S100A 8,C5a,and Tau proteins between SAE group and Ne-SAE group[(),pg/mL]
*P < 0.05,***P < 0.001。
2.3 CLI 和HCT-ALB 比较
CLI 和HCT-ALB 这两个指标在临床上可以用来评估脓毒症患者的严重程度比较。在SAE 患者中的检测后发现SAE组患者CLI 与Ne-SAE组患者差异无统计学意义(P=0.823),而2组间HCT-ALB 存在差异并具有统计学意义(P=0.035),见表3。进行ROC 曲线分析结果,见表4,图1。
表3 SAE组与Ne-SAE组患者CLI 和HCT-ALB 比较()Tab.3 The comparison of the levels of CLI and HCT-ALB between SAE group and Ne-SAE group()

表3 SAE组与Ne-SAE组患者CLI 和HCT-ALB 比较()Tab.3 The comparison of the levels of CLI and HCT-ALB between SAE group and Ne-SAE group()
*P < 0.05。

表4 CLI 和HCT-ALB 对SAE 诊断ROC 分析结果Tab.4 The results of ROC analysis about SAE diagnostic by CLI and HCT-ALB
3 讨论

Fig.1 A ROC curve graph about SAE diagnostic by CLI and HCT-ALB
SAE 的发病机制仍不清楚,3 种机制可能导致SAE 及相关的短期和长期认知功能障碍:(1)神经炎症的激活;(2)微循环功能障碍;(3)神经元兴奋性增加[7],而血脑屏障(Blood brain barrier,BBB)与这些机制密切相关。有学者提出SAE 与细胞因子风暴相关性脑病的病理机制存在重叠[8],脓毒症是内毒素血症和促炎细胞因子导致小胶质细胞和脑内皮细胞激活、紧密连接下调致使内皮屏障功能受损和白细胞招募增加、BBB通透性增加,由此产生的神经炎症和BBB 功能障碍,加重了脓毒症诱导的脑功能障碍,这类患者脑脊液检查多呈现为蛋白含量的增高[9],表明BBB 通透性增高,这与脓毒症在外周的表现是一致的。因此本研究从脓毒症患者易获得的临床指标和标本入手展开研究寻找简便且可靠的临床指标对SAE 进行早期诊断。
SAE 在临床上是一个排他诊断,众多研究寄希望于在生物标志物方面的突破能为临床诊治开启新篇章。炎症介质触发C 型利钠肽氨基末端前肽(NT-proCNP)释放,在内皮糖萼中发挥不同的功能作用,暗示其可能调节血管通透性。Ehler J等[10]发现脓毒症早期血浆NT-proCNP 的峰值浓度可达17.7 pmol/L 有助于预测SAE 的发生,可提示SAE 患者的神经功能障碍,这可能与神经解剖学研究证实的海马和额叶皮质区特异性损伤有关[11]。而钙结合蛋白a8((S100A8)通过与toll 样受体4 结合在细胞内信号通路上发挥作用,可能通过活化的小胶质细胞或血管内皮细胞介导SAE[12]。Tau 蛋白是神经元功能的重要支撑,在脑损伤时被释放并裂解进入脑脊液及血液。SAE患者BBB 破坏,通透性增加可能是Tau 蛋白进入血液的机制之一[13]。C5a 已被证明在脓毒症的动物模型中发挥了神经保护和抗炎作用,较高的C5a 水平与更好的脓毒症患者短期和长期神经系统预后评分相关,对脓毒症患者的神经元具有保护作用[14]。本研究纳入72例患者,运用脓毒症相关性脑病定义和ICU 意识水平(分值的困惑评定法CAM-ICU)确定SAE组患者31例,Ne-SAE组患者41例。为证实该分组的准确性,笔者对其中22例患者(每组11例)留取血浆标本进行SAE相关生物标志物的检测,结果发现SAE组患者血浆中NT-proCNP 和S100A 8 水平较Ne-SAE组明显升高;而Tau 蛋白和C5a 水平在2组间无明显差异。前两项指标与以往研究一致SAE 诊断的吻合度很好。而另外2 个指标可能由于样本量较小或病情严重程度不同,没有取得与其他研究相一致的结果。
毛细血管渗漏是脓毒症的病理核心,临床中常使用毛细血管渗漏指数(capillary leakage index,CLI)来评价毛细血管通透性,它与炎性递质异常释放所致毛细血管渗漏密切相关,其由两个部分组成,CRP 是体现机体炎症反应的敏感指标,ALB 是维持血管内胶体渗透压的主要成分,具有抗休克、协调维持血管内皮完整性的作用,在脓毒症时ALB 通过损伤的毛细血管渗漏到组织间隙,导致血管内ALB 降低,组织水肿。有研究表明CLI 是脓毒症病情严重程度分层及预后的较好指标[15],同时也可作为脓毒症发生ARDS 的早期诊断,并能够预测患者预后[16]。本团队近年来致力于脓毒症的临床研究,力求寻找简单化、床旁化的指标指导临床救治。前期研究中笔者发现HCTALB 同样是一个反应毛细血管渗漏的可靠指标,数值越高病情越严重,预后越差,尤其在严重腹腔感染的患者中更为突出。在子痫前期和子痫患者中毛细血管渗漏是导致水肿,低蛋白血症的原因,而HCT-ALB 在这类患者中存在明显差异,可用来对其进行鉴别诊断[17]。另一项纳入7 117人的回顾性研究表明HCT-ALB 对感染性疾病的诊断的特异性达到99%,敏感性为37.5%,推荐10.25 作为诊断严重感染的标准[6]。同时HCTALB 在ARDS 患者严重程度评估中同样具有价值。CLI 和HCT-ALB 可从临床常规检验指标中采集,尤其是HCT-ALB 相比之下更易获得,尤其是用于医疗条件受限的基层医院。本研究发现SAE组患者APACHEⅡ评分、SOFA 评分明显较Ne-SAE组患者升高,这与以往的研究一致,表明脓毒症患者病情越重,毛细血管渗漏越严重,发生SAE 的风险就越高。笔者发现CLI 在SAE组和Ne-SAE组患者间无差异,而2组间HCT-ALB 却存在明显差异;紧接着笔者对HCT-ALB 进行了ROC 曲线分析结果显示其界值在14.85 时,对诊断SAE 的敏感度达68.27%,特异度达67.74%,以上结果表明在本研究中HCT-ALB 对脓毒症患者发生SAE 具有早期诊断价值。而CLI 在本研究中没有得到预期的结果,究其原因可能是在脓毒症复杂的病理生理机制下存在多种因素影响CRP的水平。CRP 作为急性期反应的组成部分,在感染或非感染过程中都可能升高,其在肝脏中合成,发病后6~8 h 开始升高。而36~50 h 达到峰值浓度。早在1999 年Clyne B 等[18]就提出在急诊科患者中CRP 升高原因众多,但对于考虑存在感染的患者,不应该因为CRP 正常而延迟抗感染治疗。由此可见单一用CRP 来评估脓毒症的严重程度是不全面的,因此近期的一项研究建议联合多种生物标志物,如:CD64、肝素结合蛋白、钙卫蛋白等开发一种更严格、标准化的方法来评估脓毒症生物标志物,以期对脓毒症进行诊断和预后评估[19]。相较CLI 而言,HCT-ALB 的影响因素较少。由于红细胞的大小和ALB(69 kDa)相差很大,即使在脓毒症时毛细血管内皮间隙增大的情况下,红细胞也无法外溢到组织间隙,除非血管破裂等极端情况发生,所以在脓毒症患者中HCT 相对来说只会受到血管内有效血容量的影响,可能能够更加客观地反应毛细血管渗漏的严重程度。在这项研究中,小量的样本得出令人振奋结论,值得笔者在临床工作中继续扩大样本量,细化疾病严重程度分层,全面疾病种类收集,进一步证实HCT-ALB 在SAE 早期诊断中的作用。

