噁霉灵微球剂高效液相色谱分析方法研究
堵 宇,陈福良,张奇珍,余曼丽,尹明明
(中国农业科学院 植物保护研究所 农业部作物有害生物综合治理重点实验室,北京100193)
噁霉灵(hymexazol),CAS登录号为10004-44-1,EINECS登录号为233-000-6,中文别称:土菌消,恶霉灵,绿亨一号等,化学名称3-羟基-5-甲基异噁唑,化学式:C4H5NO2[1],结构式见图1。
微球剂过去归属于微囊剂,随着科技的进步及电镜扫描技术的发展,发现微球剂与微囊剂之间存在明显区别。国际纯粹与应用化学联合会(IUPAC)及《中国药典》(2010年版)已将微球剂与微囊剂区别开,并单独划分为一类新剂型[2]。微囊剂是以小分子单体经过原位聚合或界面聚合在农药有效成分(囊芯)表面沉积形成一层包膜(俗称壁材,亦称囊壁、囊皮),有效成分以液态、固态或气态形式被包封在球体中的微小胶囊,形成一种微细的囊状结构的球状颗粒,微囊中的囊皮如果不易破裂,则囊芯有效成分不能完全释放出来,造成有效成分的浪费;而微球剂则是以可生物降解的天然高分子聚合物通过乳化-溶剂挥发法、乳化-交联法、相分离法、喷雾干燥法等方法制备的有效成分均匀分散或包埋在载体中而形成均匀微细的球状实体(实心球)或中空球体(有效成分与载体混合形成的球壁,把空气包覆在球体中),微球剂随着载体的生物降解,有效成分可以完全释放出来[3]。微球剂目前在医药领域研究较为深入,在农药领域虽然首例于1985年在美国报道[4],但目前还处于探索阶段,暂未在国内外登记。噁霉灵微球剂是由中国农业科学院植物保护研究所创制开发的农药缓释新剂型,以海藻酸钠和羧甲基纤维素钠为载体材料将有效成分噁霉灵进行包载,具有一定的缓释作用。有效成分主要用于防治丝核菌、镰刀菌、腐霉菌等引起的多种土传病害,是一种高效低毒无公害的内吸性土壤消毒剂和杀菌剂,同时也具有茁壮根系、健苗、壮苗的作用[5,6]。
目前已有文献报道噁霉灵的高效液相色谱、气相色谱和液质联用技术对单一或复配制剂及残留的检测分析方法。高效液相色谱以其简单、快速、重复性好仍为主流的检测手段,气相色谱由于配备的检测器不同,可能还需要进行衍生化处理,消耗更多的有机试剂,但其和液质联用方法的检出限一般都明显低于高效液相色谱法,因此多用于噁霉灵的残留检测[7,8,9],而目前噁霉灵微球剂的定量分析方法尚无公开报道。因此,本文建立了一种测定噁霉灵微球剂的高效液相色谱分析方法,省时、经济,精密度和准确度满足定量分析的要求。
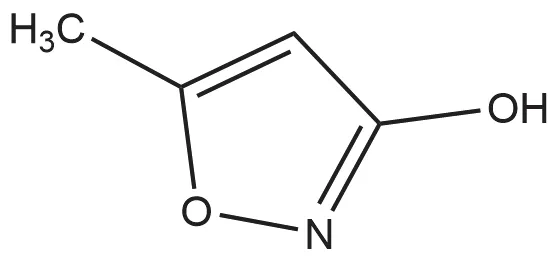
图1 噁霉灵结构式
1 材料与方法
1.1 供试药剂和试剂
噁霉灵标准品,纯度99.0%[沈阳化工研究院农药检验实验室国家农药产品质量监督检验中心(沈阳)];甲醇,色谱纯(美国FISHER公司);超纯水(杭州娃哈哈集团有限公司);噁霉灵微球剂(中国农科院植保所研制)。
1.2 仪器
Agilent 1260型高效液相色谱仪(美国安捷伦科技有限公司);BSA224S-CW电子天平[赛多利斯科学仪器(北京)有限公司];过滤器:滤膜孔径0.45 μm (天津市科亿隆实验设备有限公司);UV-1800紫外分光光度仪(日本岛津有限公司);PM4-1300TL超声波清洗机(英国Prima公司)。
1.3 高效液相色谱操作条件
采用Agilent Eclipse XDB-C18反相色谱柱(4.6 mm ×250 mm,5 µm);流动相为甲醇+纯水(60∶40),流速1 mL/min;进样量3.0 μL;柱温30 ℃;检测器波长210 nm;以外标法定量。在本色谱条件下,噁霉灵保留时间约为2.4 min。还可根据不同仪器特点适当改进色谱条件,以获得更佳效果。噁霉灵标样及试样的高效液相色谱图见图2。
1.4 测定步骤
1.4.1 标样溶液的配制
准确称取噁霉灵标准品0.05 g (精确至0.000 2 g),置于50 mL的棕色容量瓶中,先加少量甲醇冲润容量瓶壁并使标准品完全溶解,再用甲醇定容至50 mL,准确移取上述溶液3.0 mL于10 mL容量瓶中,甲醇定容。将上述标准溶液分别系列稀释至0.003 1、0.062 5、0.125 0、0.187 5、0.250 0、0.312 4 g/L于10 mL棕色容量瓶中,混匀,过0.45 μm滤膜后备用。
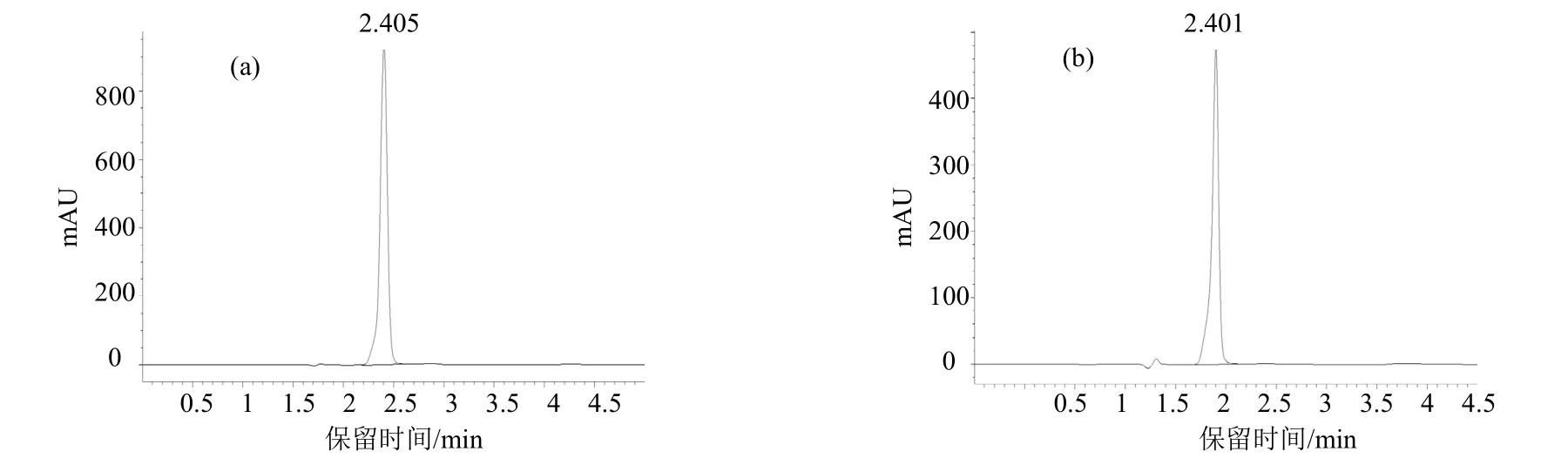
图2 噁霉灵标样(a)及试样(b)溶液高效液相色谱图
1.4.2 试样溶液的配制
称取噁霉灵微球剂0.04 g左右(精确至0.000 2 g)于25 mL的棕色容量瓶中,加入适量甲醇超声处理,最后用甲醇定容至刻度,过0.45 μm滤膜待测。
1.5 测定
按1.3节仪器参数及条件运行液相色谱,待仪器稳定后,取用标准溶液进样分析,至前后2针检测的信号值变化小于1.5%后,以标样溶液、试样溶液、试样溶液、标样溶液的顺序进行测定。
1.6 结果计算
将测得的2针相邻试样溶液及前后2针标样溶液中的噁霉灵峰面积分别进行平均,按下列算式计算试样中的噁霉灵质量分数ω(%)。
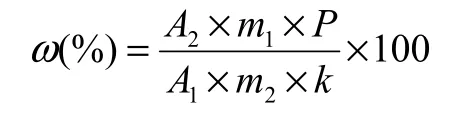
式中:A1为标样溶液中噁霉灵峰面积的平均值,A2为试样溶液中噁霉灵峰面积的平均值;m1、m2分别为称取的噁霉灵标样和试样的质量(g);P为噁霉灵标准品的纯度(%);k为噁霉灵试样和标样的稀释倍数比值。
2 结果与讨论
2.1 检测器波长的筛选
用紫外分光光度计在190~400 nm吸收波长范围对噁霉灵进行扫描,发现噁霉灵在207 nm波长处有最大吸收(图3),因此选择210 nm作为噁霉灵的检测波长。在该波长下,噁霉灵仪器响应较好,无其他杂质峰干扰。
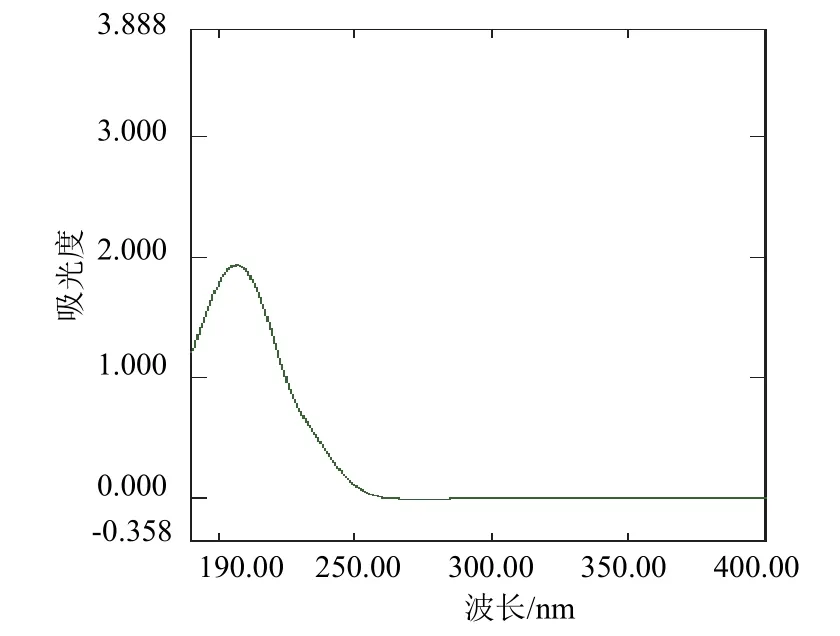
图3 噁霉灵的紫外吸收谱图
2.2 提取溶剂、超声时间的筛选
用超声波清洗机对试样进行不同介质(甲醇、乙腈、纯水)和不同时间(5, 10, 20, 30, 40, 50 min)的超声处理。结果表明噁霉灵微球剂在甲醇和乙腈中能分散良好,但在纯水中会凝结成块,导致无法将有效成分充分提取。用甲醇超声30 min的有效成分质量分数多于超声5、10、20 min,但相较于超声40、50 min几乎没有差异,并且具有更小的标准偏差。用乙腈作为提取介质很明显在50 min内有效成分提取不充分,且载药量呈现随超声时间显著上升的趋势。微球剂的制备过程中,需要利用载体材料对有 效成分进行包载。但不同类型(黏度、水溶性等)材料对有效成分的包载能力不同,为了保证超声能将有效成分完全从微球中溶解出来,我们选择甲醇为提取介质,超声时间为30 min (图4)。
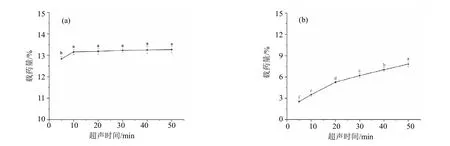
图4 噁霉灵在甲醇(a)和乙腈(b)介质中不同超声时间与载药量的关系
2.3 流动相的筛选
流动相由有机相和水相按一定比例混合组成,其中水相部分为纯水,有机相部分在甲醇、乙腈中进行筛选。在2种不同的有机相下分别对噁霉灵标样进行预分析试验,结果发现它们的分离效果无明显差异,但考虑到乙腈毒性更大且价格较高,因此选择甲醇和纯水做流动相。当甲醇和纯水体积比为60∶40,流速为1 mL/min时,噁霉灵的分离效果良好。
2.4 分析方法的线性相关性
参照1.4.1节,以噁霉灵的质量浓度为横坐标,峰面积为纵坐标作标准曲线,进行线性回归分析(图5)。在试验质量浓度范围内,噁霉灵的质量浓度与峰面积线性关系良好,线性方程为y=11 281.566 4x+ 19.141 2,相关系数R2为0.999 9。
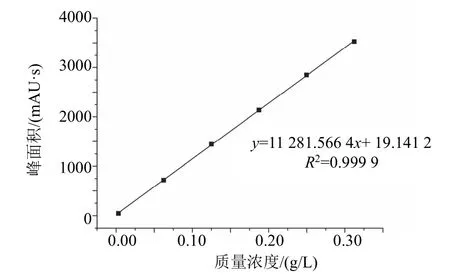
图5 噁霉灵峰面积与质量浓度关系图
2.5 分析方法精密度
准确称取噁霉灵微球剂各5个平行试样进行色谱分析,计算其中噁霉灵的质量分数,试验结果见表1。表明该方法精密度良好。

表1 噁霉灵微球剂的精密度测定结果
2.6 方法准确度
称取同一批次已知含量的噁霉灵微球剂试样各5份于25 mL棕色容量瓶中,分别加入一定量的噁霉灵标样溶液,定容,在1.3节的色谱条件下测定。结果见表2。噁霉灵微球剂中噁霉灵的加标回收率为98.8%~100.9%,平均加标回收率分别为100.0%,说明该方法回收率好,准确度高。
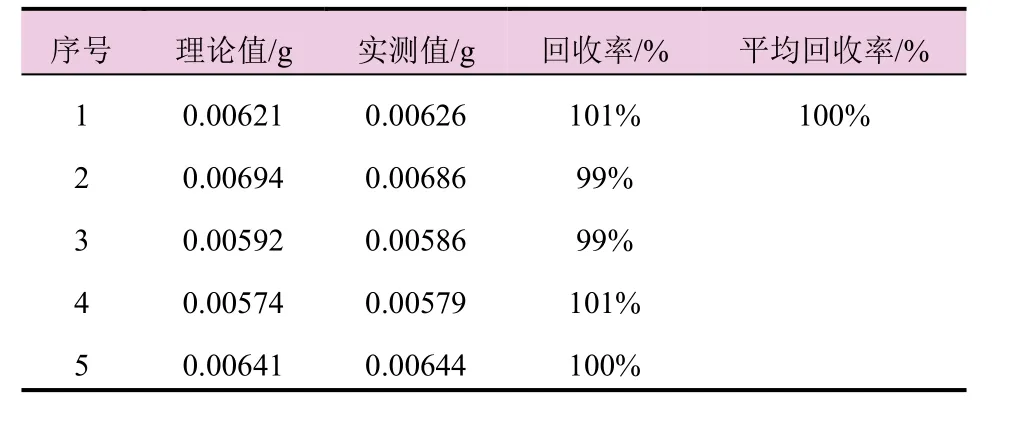
表2 噁霉灵微球剂的加标回收试验结果
3 结 论
本文建立了检测噁霉灵微球剂中有效成分的高效液相色谱分析方法。该方法线性关系良好,线性方程为y=11 281.566 4x+19.141 2,线性相关系数为0.999 9。噁霉灵微球剂的标准偏差为0.031,变异系数为0.24%,回收率为99%~101%,平均回收率为100%。该测试方法各项指标均满足NY/T 2887—2016中的要求,具有线性好、精密度好、准确度高、操作简便等特点,可用于对噁霉灵微球剂产品的质量检测或提供技术参考。

