2020-2021年ISO新公布的农药品种
谭海军
(苏州艾科尔化工科技有限公司,江苏昆山 215300)
农药在控制有害生物、保障农作物稳产增产和农民增收等方面发挥着重要作用。但随着公众对生态环境和安全健康的日益重视,有些农药因毒性和残留等高风险被禁用或限用。气候和环境等因素变化也导致越来越多有害生物对常规农药产生了抗药性。不断研究开发高效低风险新型农药并推广应用,对现有品种更新换代和补充拓展,推进农药减量增效和保护生物多样性,实现农业和社会可持续发展具有重要意义。
每年公开报道的农药新化合物成百上千,但进入商业化开发和应用的少之又少。国际标准化组织(ISO)农用化学品通用名技术委员会批准公布英文通用名的农药品种通常是商业化开发重点,引领着新农药研发方向。
1 2020-2021年公布的新品种
2020-2021年,ISO农用化学品通用名技术委员会临时批准并公布了27种农药新品种的英文通用名(表1),涉及9种除草剂、7种杀菌剂、6种杀虫剂、2种杀螨剂、1种杀线虫杀菌剂、1种杀线虫杀螨剂和1种植物生长调节剂。乙唑螨腈(cyetpyrafen)、氟苯醚酰胺(flubeneteram)、喹草酮(benquitrione)、双唑草酮(bipyrazone)、环吡氟草酮(cypyrafluone)、苯唑氟草酮(fenpyrazone)、三唑磺草酮(tripyrasulfone)、氯吲哚酰肼(chloroinconazide)、环丙氟虫胺(cyproflanilide)、氟氯虫双酰胺(fluchlordiniliprole)、辛菌胺(seboctylamine)和三氟杀线酯(trifluenfuronate) 12种为中国创制的新品种。其中,乙唑螨腈、喹草酮、双唑草酮、环吡氟草酮、苯唑氟草酮、三唑磺草酮和辛菌胺(醋酸盐) 7种已在中国登记(表2),其他中国创制品种的登记也正在进行中。
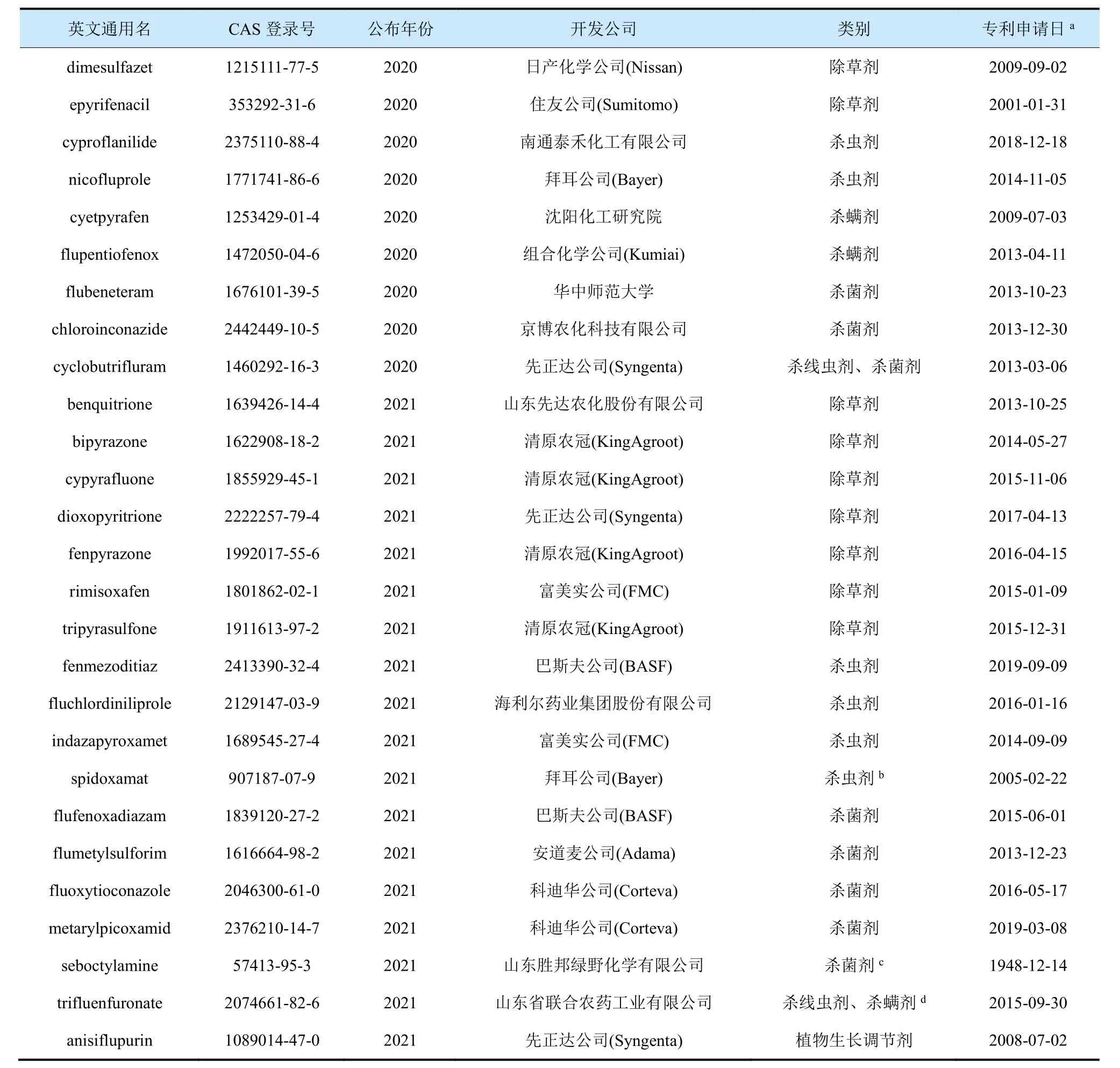
表1 2020-2021年ISO新公布的27种农药品种

表2 2020-2021年ISO新公布的农药品种中国登记情况a
2020年1月公布的除草剂dimesulfazet、杀菌杀线虫剂三氟吡啶胺(cyclobutrifluram)、杀菌剂氟苯醚酰胺、杀螨剂乙唑螨腈和flupentiofenox 5个品种作者已有报道[1],在此不作赘述。值得注意的是,除flupentiofenox属全新结构类型外,其他可视为分别衍生自氟草磺胺(perfluidone)、啶酰菌胺(boscalid)、联苯吡菌胺(bixafen)和腈吡螨酯(cyenopyrafen)(本文将这种衍生方法视为一种可能的新农药“创制思路”,图1)。三氟吡啶胺被确定为线粒体琥珀酸脱氢酶抑制剂[2-3]。
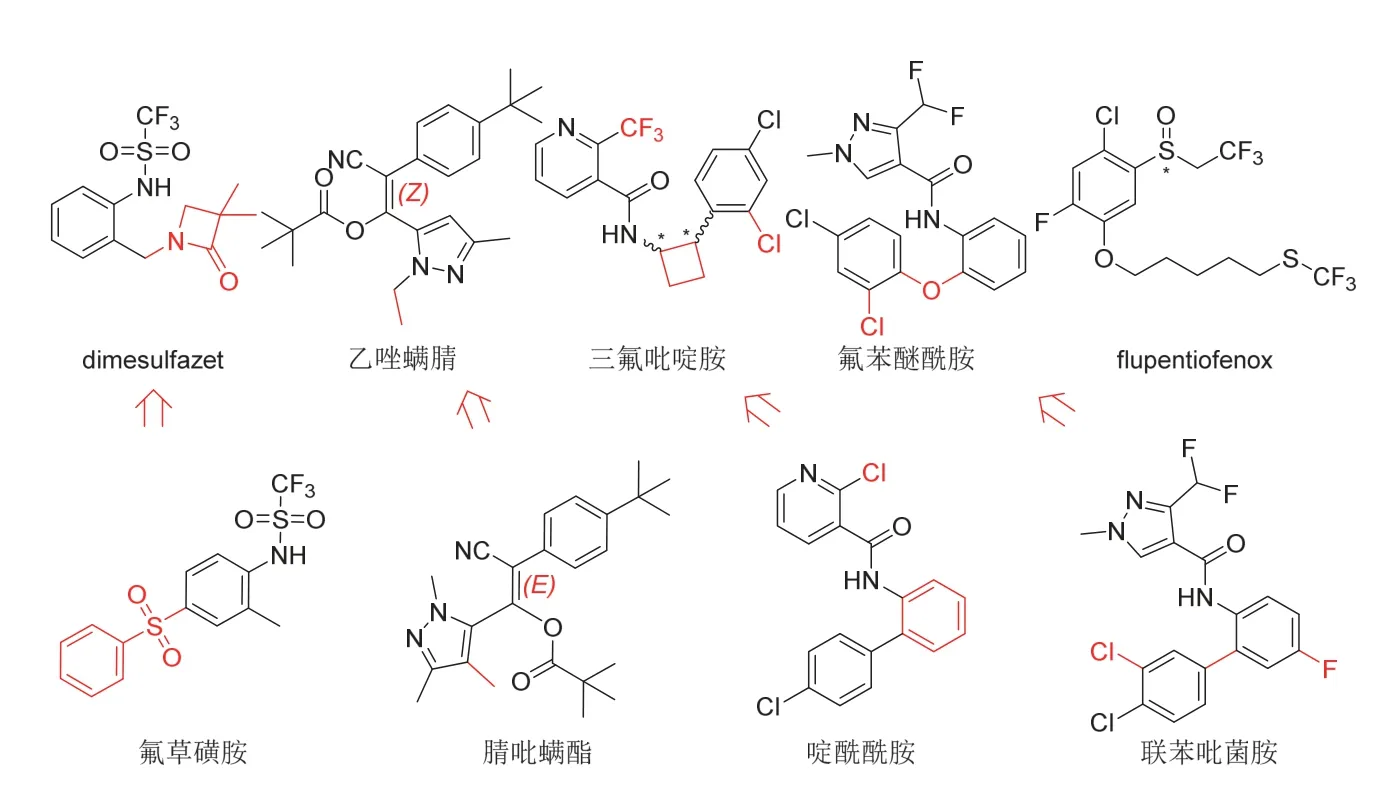
图1 2020年1月新公布的5个农药品种的化学结构和创制思路
2 除草剂
2020-2021年ISO新公布的9种除草剂按作用机制和/或结构类型可分为磺酰苯胺类(如dimesulfazet)、芳酰基环己二酮类(又称三酮类)、苯甲酰吡唑类、异噁唑类和苯基尿嘧啶类(又称苯基酰亚胺类) 5大类。
2.1 芳酰基环己二酮类除草剂
喹草酮(开发代号Y13161)和dioxopyritrione分别是华中师范大学[4]和先正达公司[5]研究发现的新型选择性除草剂,前者由山东先达农化股份有限公司进行开发。喹草酮和dioxopyritrione可视为由硝磺草酮(mesotrione)分别引入喹唑啉二酮和哒嗪酮片段得到,推测其也为对羟基苯基丙酮酸双氧化酶(HPPD)抑制剂[6-7],同时喹草酮还具有内吸活性[7]。室内生测结果表明[4-5]:喹草酮以150 g/hm2施用后15 d对苘麻、马唐、反枝苋、稗草、鳢肠和狗尾草的防效达80%~100%,以37.5 g/hm2和75 g/hm2施用对反枝苋和狗尾草的防效优于硝磺草酮,以75 g/hm2和150 g/hm2在小麦田和玉米田施用对作物安全;dioxopyritrione以125 g/hm2或250 g/hm2施用后14 d对茼麻、反枝苋和稗草的防效达100%,同时对大麦安全。喹草酮[4]和dioxopyritrione[5,8]的化学结构、创制思路和合成路线见图2,合成时都用到芳酰基环己二酮类除草剂的关键中间体环己二酮。
2.2 苯甲酰吡唑类除草剂
双唑草酮[9]、环吡氟草酮(开发代号QYM201)[10]、苯唑氟草酮(开发代号QYC101)[11]和三唑磺草酮(开发代号QYR301)[12]都可看作是由苯唑草酮衍生得到选择性苗后除草剂,双唑草酮、苯唑氟草酮和三唑磺草酮还对其吡唑上的羟基进行了保护(图3)。根据中国农业农村部药检所农药登记信息[7],这4种新型苯甲酰吡唑类除草剂也为HPPD抑制剂,都具有内吸传导作用。以水稻田除草剂三唑磺草酮为例,其进入植物体后便被水解为羟基吡唑类代谢物HDT (图3),再与HPPD活性中心的亚铁离子螯合形成稳定的双配合位化合物而抑制HPPD活性、阻断尿黑酸合成而引起靶标杂草白化坏死[13]。但与硝磺草酮相比,三唑磺草酮对HPPD的抑制作用约低6倍[13]。
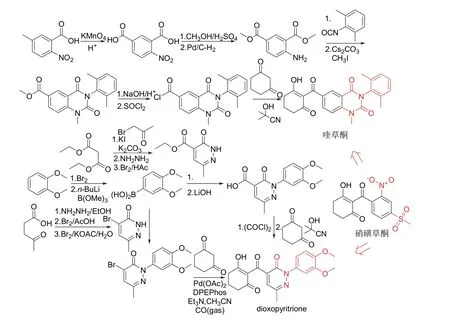
图2 喹草酮和dioxopyritrione的化学结构、创制思路和合成路线
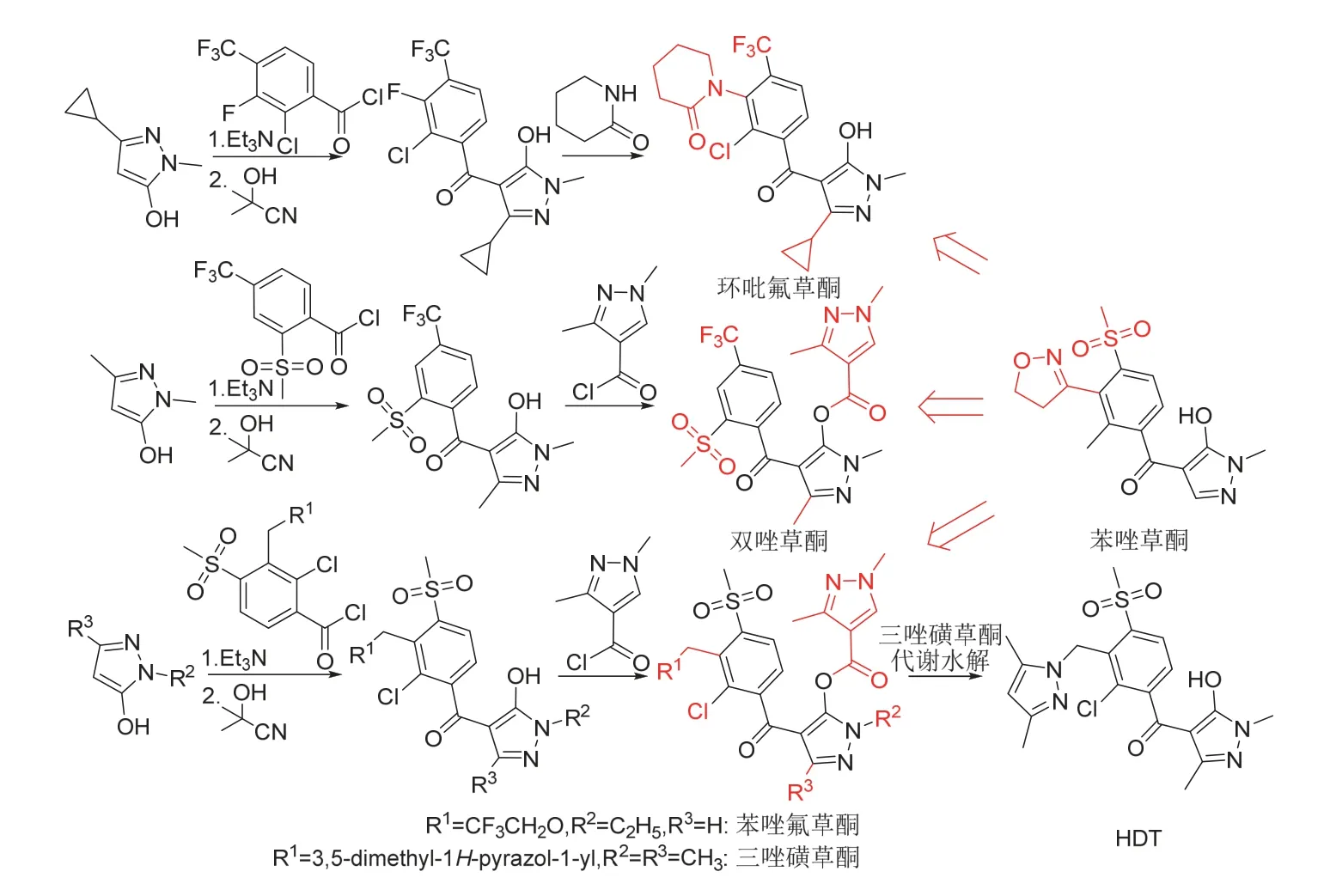
图3 双唑草酮、环吡氟草酮、苯唑氟草酮和三唑磺草酮的化学结构、创制思路、合成路线和代谢途径
研究结果表明,这4种新型除草剂对玉米、小麦或水稻田多种禾本科和阔叶杂草具有显著的防除活性或效果,对抗乙酰乳酸合成酶(ALS)抑制剂、乙酰辅酶A羧化酶(ACCase)抑制剂和/或激素类除草剂的稗草、千金子及其他杂草均有效,同时对当季和后茬作物安全。双唑草酮以30 g/hm2在茼麻、野油菜、田紫草、稗草和千金子3叶期处理对其具有优异防效,同时对玉米安全;以150 g/hm2在播娘蒿、荠菜、田紫草和猪殃殃3叶期处理对其具有优异防效(但对早熟禾无效),同时对小麦安全;田间以150 g/hm2在水稻3叶期处理对稗草、萤蔺和慈姑等具有优异防效,但对水稻存在一定药害[9],对苯磺隆等ALS抑制剂产生抗性的荠菜也有优异防效[14]。环吡氟草酮以90~180 g/hm2在玉米苗后处理对稗草、绿色狗尾草和反枝苋的防效达80%以上,与多种除草剂复配还具有增效作用,同时对玉米安全[10]。苯唑氟草酮以250 g/hm2在杂草4叶期处理对耐甲基二磺隆和炔草酯等ALS和ACCase抑制剂的日本看麦娘,耐苯磺隆和双氟磺草胺等ALS抑制剂的播娘蒿、荠菜、田紫草和繁缕等具有优异防效,同时对小麦安全[11];以15 g/hm2在玉米苗后处理对龙葵、反枝苋、马唐、马唐和狗尾草的防效达80%以上,田间以45~ 135 g/hm2施用可减少88.7%~97.4%的杂草并使玉米增产10.1%~22.2%[15];夏玉米苗后处理对后茬种植冬小麦、大蒜和菠菜也无不利影响[16]。三唑磺草酮以120 g/hm2在作物2~3叶期处理对稗草具有优异防效,同时对玉米、小麦和水稻安全[12]。
双唑草酮、环吡氟草酮、苯唑氟草酮和三唑磺草酮的化学结构、创制思路、合成路线[9-12]和代谢途径[13]见图3。值得注意的是,合成时应控制工艺条件以获取稳定的原药晶型,如双唑草酮的C晶型[17],苯唑氟草酮的无定形态[18],三唑磺草酮的B晶型[19]等。
2.3 异噁唑类除草剂
Rimisoxafen是美国富美实公司新研发[20]的含氟和嘧啶醚结构的新型异噁唑类除草剂,其作用机制尚未知。试验结果表明[20],rimisoxafen以16~125 g/hm2苗前和苗后(1~4叶期)处理13~15 d后对猪殃殃、藜、茼麻、反枝苋和西部苋等杂草都具有高防除活性,对小麦相对安全但对玉米、油菜和大豆有害;以250 g/hm2封闭处理对2叶期的水稻田各种杂草防效优异,但对水稻有害。值得注意的是,rimisoxafen对马唐、狗尾草、繁缕、地肤和牵牛等杂草的防效会因用药时期不同而存在较大差异。Rimisoxafen的化学结构和合成路线[20]见图4。
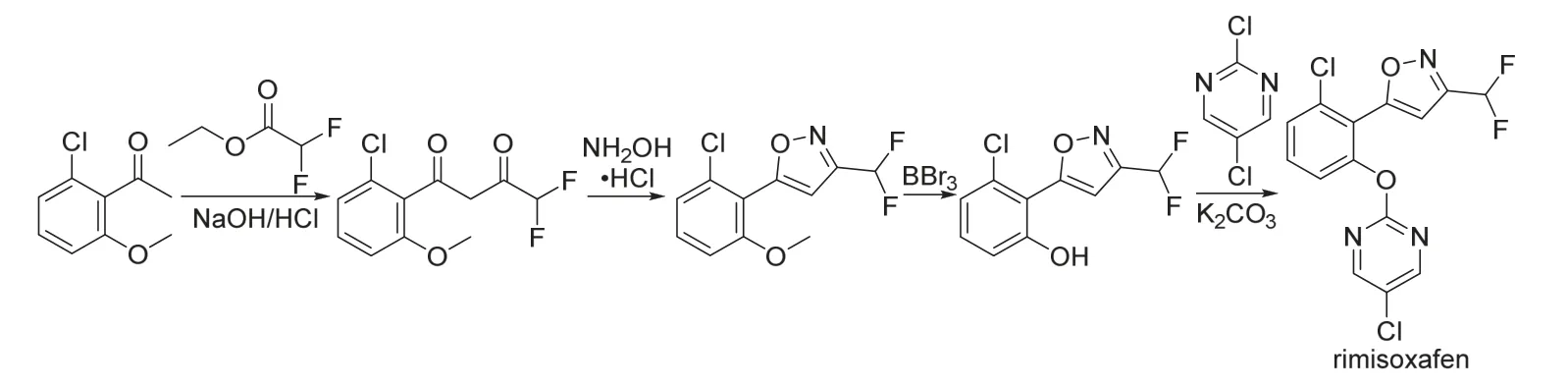
图4 Rimisoxafen的化学结构和合成路线
2.4 苯基尿嘧啶类除草剂
Epyrifenacil (开发代号S-3100)为日本住友公司新研发[21]的含吡啶结构的苯基尿嘧啶类除草剂,通过抑制植物体内血红素和叶绿素合成过程中的关键酶——原卟啉原氧化酶(PPO)[22]起作用。研究结果表明[21],10% epyrifenacil EC以有效成分125 g/hm2茎叶喷雾处理后16 d,或500 g/hm2土壤喷雾处理后19 d均可完全控制牵牛和茼麻。此外,epyrifenacil还对路边的黑麦草[Lolium perennessp. multiflorum(Lam.)]和小叶海金沙(Lygodium microphyllum)等杂草以及多种抗性杂草具有较好防效,预计于2025年上市。Epyrifenacil的化学结构、创制思路和合成路线[21]见图5,合成时可共用氟嘧硫草酯(tiafenacil)的关键中间体1-甲基-3-(2,5-二氟-4-硝基苯基)-6-三氟甲基嘧啶-2,4(1H,3H)-二酮,但需要控制晶型[23]以生产相关稳定的制剂。
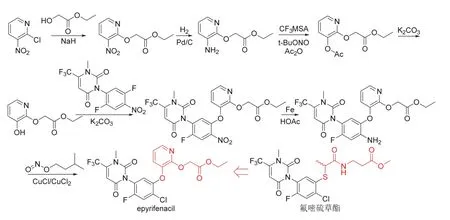
图5 Epyrifenacil的化学结构、创制思路和合成路线
3 杀菌剂
2020-2021年ISO新公布的8种杀菌剂按作用机制和/或结构类型分别归属于烟酰胺类(如三氟吡啶胺)、吡唑酰胺类(如氟苯醚酰胺)、酰肼类、苯甲酰苯胺类、嘧啶类、三唑类、吡啶酰胺类和烷基多胺类8大类。
3.1 酰肼类杀菌剂
氯吲哚酰肼是由天津大学以β-咔啉生物碱为先导化合物发现[24-25]的酰肼类杀菌剂,后转让给京博农化科技有限公司进行商业化开发。以烟草花叶病毒(TMV)为例,氯吲哚酰肼具有多重作用机制[25]:一方面改变病毒粒子的形态结构和增加抗氧化酶的活性,使TMV在侵染作物时减少诱导的活性氧(ROS)产生;另一方面显著增强水杨酸应答基因表达,并通过该信号途径减少TMV的侵染。研究结果表明[24],氯吲哚酰肼(1S,3S)-对映体在100 mg/L和500 mg/L时对烟草花叶病毒离体和活体钝化、治疗和保护的相对抑制率分别大于29%和64%,与宁南霉素大致相当;在50 mg/L时对苹果轮纹病、小麦纹枯病、油菜菌核病、水稻纹枯病、辣椒疫霉病和马铃薯晚疫病等的病原菌的离体抑制率不低于80%,同时对西瓜炭疽病、花生褐斑病、小麦赤霉病、玉米小斑病、水稻恶苗病、黄瓜枯萎病、黄瓜灰霉病和番茄早疫病等的病原菌也有不同程度的抑制作用,可作为多菌灵和百菌清的补充。此外,氯吲哚酰肼对鳞翅目和双翅目害虫存在一定的杀虫活性。氯吲哚酰肼及其(1S,3S)-对映体的化学结构和合成路线[24]见图6,氯吲哚酰肼可以色氨酸为原料来合成。
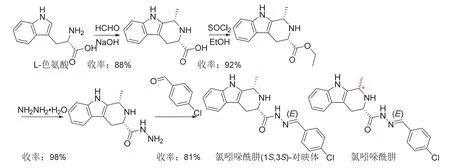
图6 氯吲哚酰肼及其(1S, 3S)-对映体的化学结构和合成路线
3.2 苯甲酰苯胺类杀菌剂
Flufenoxadiazam是巴斯夫公司新发现[26]并开发的含噁二唑结构的新型苯甲酰苯胺类杀菌剂,其作用机制可能与氟酰胺(flutolanil)[2]相同,即通过抑制病原菌呼吸作用中的琥珀酸脱氢酶发挥作用。研究结果表明[26],flufenoxadiazam在600 mg/L时对大豆亚洲锈病病原菌(Phakopsora pachyrhizi)的抑制率达80%以上。Flufenoxadiazam的化学结构、创制思路和合成路线[26]见图7。
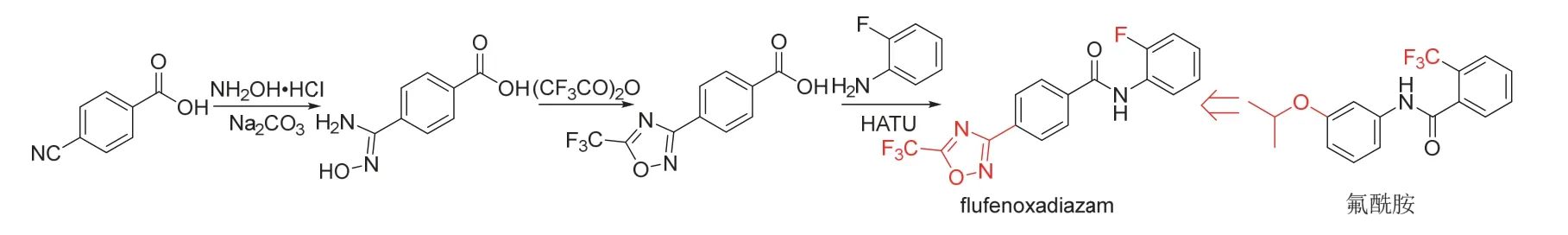
图7 Flufenoxadiazam的化学结构、创制思路和合成路线
3.3 嘧啶类杀菌剂
Flumetylsulforim (开发代号ADF-16和DAS-609)曾被科迪华公司作为中间体用于新型杀菌剂的创制研究[27-28],后由安道麦直接将其作为嘧啶类杀菌剂进行商业化开发,其作用机制尚未知。研究结果表明[29-30],flumetylsulforim对小麦叶枯病以及由子囊菌纲和担子菌纲真菌引起的植物病害具有较好的防治效果,与三唑类、甲氧基丙烯酸酯类和吡唑酰胺类等杀菌剂复配对多种病害具有协同增效作用。Flumetylsulforim的化学结构和合成路线[28]见图8,但合成时需控制条件以获取稳定晶型[31]的原药。
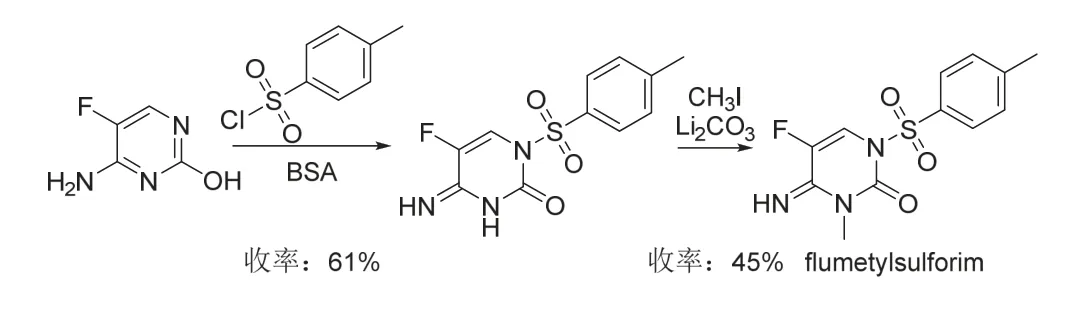
图8 Flumetylsulforim的化学结构和合成路线
3.4 三唑类杀菌剂
Fluoxytioconazole (开发代号X12499481、XR-481和XDE-481)是美国维亚梅特制药公司(Viamet Pharmaceuticals Inc.)发现[32]的含吡啶的三唑类杀菌剂,后由科迪华公司进行商业化开发。Fluoxytioconazole的作用机制尚未见报道,推测应与丙硫菌唑等杀菌剂同为甾醇生物合成C14-脱甲基抑制剂[2]。研究结果表明[32],fluoxytioconazole具有较好的亲脂性,以1.56~100 g/hm2处理小麦3 d后对叶枯病的预防和治疗效果不低于80%,且预防效果优于治疗效果。Fluoxytioconazole为含有一个手性碳原子的外消旋体,其化学结构、创制思路和合成路线[32]见图9,合成时可共用丙硫菌唑等三唑类杀菌剂的重要中间体三氮唑。
3.5 吡啶酰胺类杀菌剂
Metarylpicoxamid (开发代号X12690747、XDE-747和XR-747)是陶农科公司发现[33]的吡啶酰胺类杀菌剂,可看成是由吡啶菌酰胺(florylpicoxamid)衍生化创制而来。Metarylpicoxamid很有可能作用于线粒体Qi位点的线粒体电子传递链细胞色素bc1复合体,与甲氧基丙烯酸酯类和三唑类杀菌剂无交互抗性。室内生测结果表明[33],metarylpicoxamid以25 mg/L处理大豆后对亚洲大豆锈病的1 d预防效果和3 d治疗效果均大于80%。Metarylpicoxamid为单一对映体,熔点87~88 ℃,其化学结构、创制思路和合成路线[33]见图10。Metarylpicoxamid合成时可共用吡啶菌酰胺和fenpicoxamid的关键中间体3-羟基-4-甲氧基-2-吡啶甲酸,后者可通过百草枯和敌草快等的中间体吡啶合成[34]。
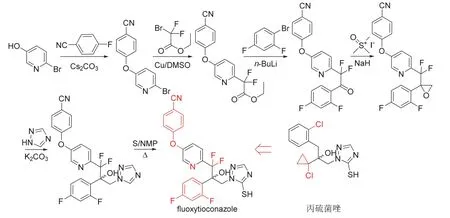
图9 Fluoxytioconazole的化学结构、创制思路和合成路线
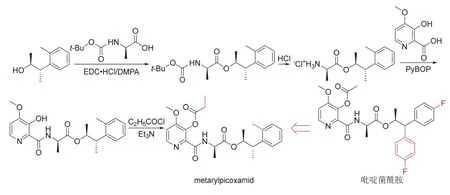
图10 Metarylpicoxamid的化学结构、创制思路和合成路线
3.6 烷基多胺类杀菌剂
辛菌胺为直链烷基多胺类杀菌剂,由德国赢创德固赛公司(Evonik Goldschmidt GmbH)最先作为具有灭菌作用的化合物报道[35]。该品种最早由山东省人才开发服务中心化工技术开发公司从日本以消毒剂“菌毒清”的名义引入,后由山东胜邦绿野化学有限公司最先在中国并完成农药登记和工业化生产。中国农业大学在2008年对农药登记的老品种进行清理时发现“菌毒清”的主要活性成分并非二(单)辛基二乙烯三胺甘氨酸(盐酸盐),而是二正辛基二乙烯三胺,于是将其通用名修订为辛菌胺[36]。辛菌胺一般以醋酸盐或盐酸盐形式存在,其杀菌机理是在水溶液中电离的亲水基部分含有很强的正电性,吸附呈负电性的各类细菌、真菌和病毒从而抑制其繁殖,并凝固病原菌蛋白质、使其酶系统变性;同时病原菌表面形成的聚合物薄膜堵塞了其离子通道,使其立即窒息死亡,从而达到较佳的杀菌或灭菌效果[37]。作为农药,辛菌胺醋酸盐在中国被广泛登记用于防治苹果树腐烂病和果锈病,棉花枯萎病,水稻稻瘟病、条纹叶枯病、细菌性条斑病、黑条矮缩病和白叶枯病,番茄病毒病,辣椒病毒病,烟草病毒病、黑胫病、猝倒病和花叶病毒病等植物病害防治(表2)。最新的研究表明[38],辛菌胺还对黄瓜根结线虫、大豆孢囊线虫、小麦粒线虫、马铃薯茎线虫、水稻干尖线虫、松材线虫和柑橘半穿刺线虫等植物寄生线虫具有较高活性。辛菌胺存在2个同分异构体,其化学结构和合成路线[36-37]见图11。
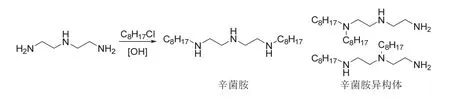
图11 辛菌胺及其同分异构体的化学结构和合成路线
4 杀(线)虫剂
2020-2021年ISO新公布的9种杀(线)虫剂按作用机制和/或结构类型分别归属于β-酮腈衍生物类(如 乙 唑 螨 腈)、三 氟 甲 基 硫 醚 类(如flupentiofenox)、芳基吡唑类、间苯二酰胺类、特特拉姆酸类、双酰胺类、介离子类、吲哚酰胺类和三氟丁烯类9大类。
4.1 芳基吡唑类杀虫剂
Nicofluprole (开发代号BCS-CY39089)是拜耳公司公司新研究开发[39]的含吡啶基的芳基吡唑类杀虫剂,可用于宠物体外寄生虫、公共卫生和农业害虫防治。Nicofluprole的作用靶标被认为[40]是γ-氨基丁酸门控氯离子通道受体,与现有的氟虫腈等同类杀虫剂无交互抗性。研究结果表明[39],nicofluprole以5 μg/cm2(500 g/hm2)对血红扇头蜱(Rhipicephalussanguineus)成虫和猫栉首蚤(Ctenocephalides felis)成虫暴露处理后48 h杀死率分别为< 80%和100%,以100 mg/L暴露处理希伯来花蜱(Amblyomma hebraeum)后42 d杀死率为100%,以5 μg/只注射处理敏感和抗性(Parkhurst品系)微小牛蜱(Boophilus microplus)雌成虫后42 d卵孵化率均为0%,以100 mg/L饲喂处理猫栉首蚤成虫、铜绿蝇(Lucilia cuprina) 1龄幼虫和家蝇成虫后2 d杀死率均为100%,以500 g/hm2喷雾处理桃蚜(6 d)、辣根猿叶甲幼虫(7 d)、草地夜蛾(7 d)和二斑叶螨(6 d)的杀死率均为100% (以100 g/hm2处理的杀死率小于100%),以20 mg/m2处理冈比亚按蚊种品系RSPH (homozygot kdr)、催命按蚊种品系FUMOZ-R和埃及伊蚊种品系MONHEIM成虫暴露接触后24 h杀死率大于90%。Nicofluprole的化学结构、创制思路和合成路线[39]见图12。
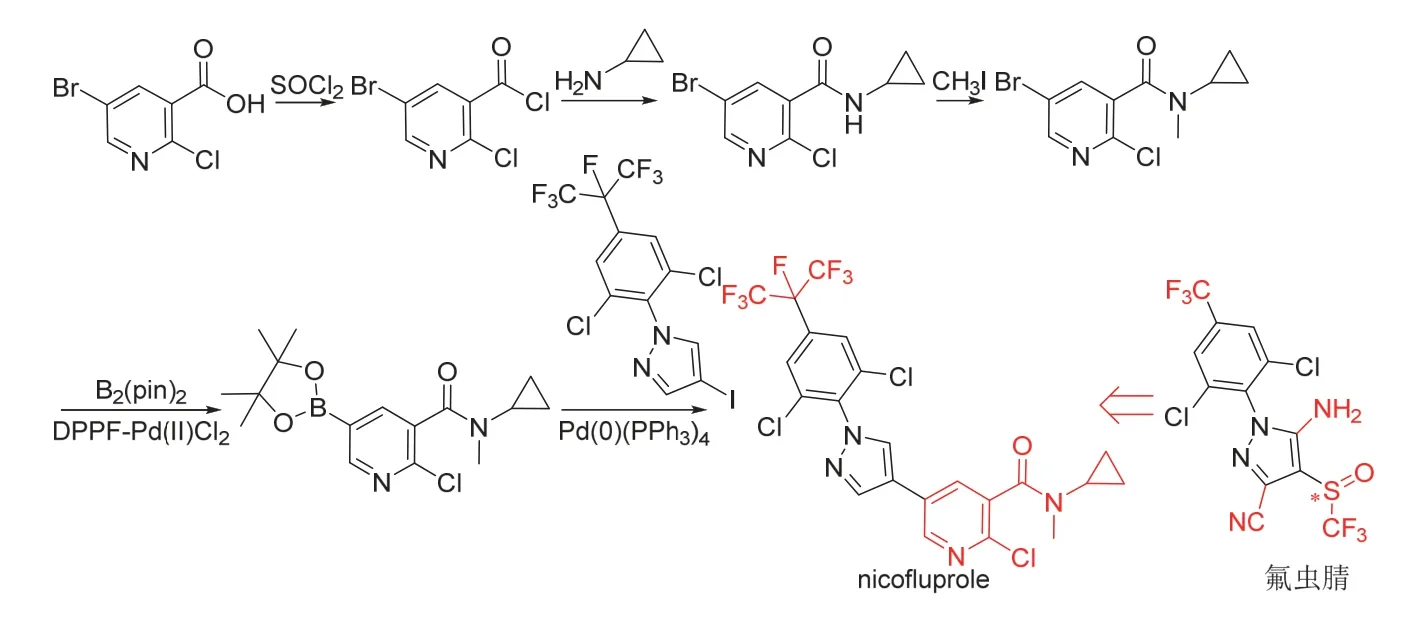
图12 Nicofluprole的化学结构、创制思路和合成路线
4.2 间苯二酰胺类杀虫剂
环丙氟虫胺可视为将环丙基引入溴虫氟苯双酰胺(broflanilide)或modoflaner得到,其作用靶标也被认为[40]是γ-氨基丁酸门控氯离子通道受体,与现有的氟虫腈等同类杀虫剂无交互抗性。室内生测结果表明[41],环丙氟虫胺1 mg/L处理对黏虫、甜菜夜蛾和斜纹夜蛾3 d杀死率不低于90%,0.4 mg/L处理小菜蛾、5 mg/L处理二化螟3 d杀死率均不低于90%。特别地,环丙氟虫胺对敏感和抗性二化螟的杀虫活性优于阿维菌素、氯虫苯甲酰胺(chlorantraniliprole)和甲氧虫酰肼[40]。环丙氟虫胺的化学结构、创制思路和合成路线[40-41]见图13,合成时可共用溴虫氟苯双酰胺和modoflaner的关键中间体。
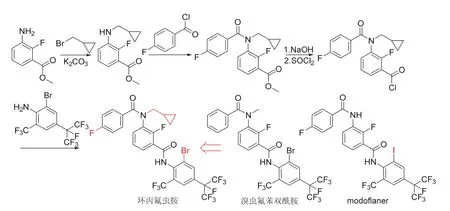
图13 环丙氟虫胺的化学结构、创制思路和合成路线
4.3 特特拉姆酸类杀(线)虫剂
Spidoxamat (开发代号BCS-AA10147)是拜耳公司新研究开发[42]的又一特特拉姆酸类杀(线)虫剂。与其他特特拉姆酸类杀虫剂不同,spidoxamat中的一个羰基是以游离羟基而不是以保护前体的形式存在的。然而,spidoxamat的作用机制应与螺虫乙酯(spirotetramat)和甲氧哌啶乙酯(spiropidion)的[43]相同,即通过抑制害虫体内脂肪合成过程中的ACCase起作用。室内生测结果表明[42],spidoxamat对桃蚜(1 000 mg/L)、棉蚜(1 000 mg/L)、猿叶甲幼虫(1 000 mg/L)、抗性二点斑叶螨(100 mg/L)和南方根结线虫(20 mg/L)都具有较好的防治效果。特别地,spidoxamat以250 mg/L苗前土壤处理对稗草(Echinochloaspp.)、狗尾草(Setariaspp.)、苋(Amaranthspp.)、拉拉藤(Galiumspp.)和白芥(Sinapisspp.)等单子叶和双子叶杂草或植物还具有优异的封闭作用[42]。推测这可能与靶标植物体内的ACCase受到抑制有关,应用时应注意spidoxamat对作物的安全性。由于在植物体内的可移动性高,spidoxamat低剂量茎叶处理或土壤施用可防治大豆、棉花、水果和蔬菜等作物上的多种刺吸式口器害虫[44]。该品种有望在2024年上市,峰值销售额达2亿欧元。Spidoxamat的化学结构、创制思路和合成路线[42]见图14,合成时可共用甲氧哌啶乙酯的关键中间体2,6-二甲基-4-氯-苯乙酰氯。
4.4 双酰胺类杀虫剂
氟氯虫双酰胺是继氯氟氰虫酰胺(cyhalodiamide)、四氯虫酰胺(tetrachlorantraniliprole)和硫虫酰胺(thiorantraniliprole)之后又一个中国自主创制的双酰胺类杀虫剂,可看成是在氯虫苯甲酰胺的苯环上引入氟和氯而得到的。推测其作用机制与氯虫苯甲酰胺相同,也为鱼尼丁受体变构调节剂。研究结果表明[45],氟氯虫双酰胺以0.25 mg/L处理时对小菜蛾和甜菜夜蛾2~3 d的杀死率达到100%,以4 mg/L处理时对蚜虫2~3 d的杀死率在90%以上。同时,氟氯虫双酰胺对小菜蛾(0.025 mg/L)和二化螟(4 mg/L)的杀死率分别为90%和100%,均优于相同浓度下氯虫苯甲酰胺和溴氰虫酰胺(cyantraniliprole)的。此外,氟氯虫双酰胺还对甘蓝、玉米、水稻、棉花、瓜类、花生、豆类、苹果和荔枝等作物的菜青虫、二点委夜蛾、草地贪夜蛾、玉米螟、二化螟、稻纵卷叶螟、棉铃虫、瓜绢螟、斜纹夜蛾、豆荚螟、卷叶蛾、食心虫和蒂蛀虫等多种鳞翅目害虫以及蓟马等缨翅目害虫都具有较高杀虫活性[46]。目前,氟氯虫双酰胺单剂及与甲氧虫酰肼复配制剂的中国农药登记正在进行之中。氟氯虫双酰胺可以双酰胺类杀虫剂的关键中间体1-(3-氯-2-吡啶基)-3-溴-1H-吡唑-5-羧酸为原料采用类似的合成路线[47]来合成,其化学结构、创制思路和合成路线[45]见图15。
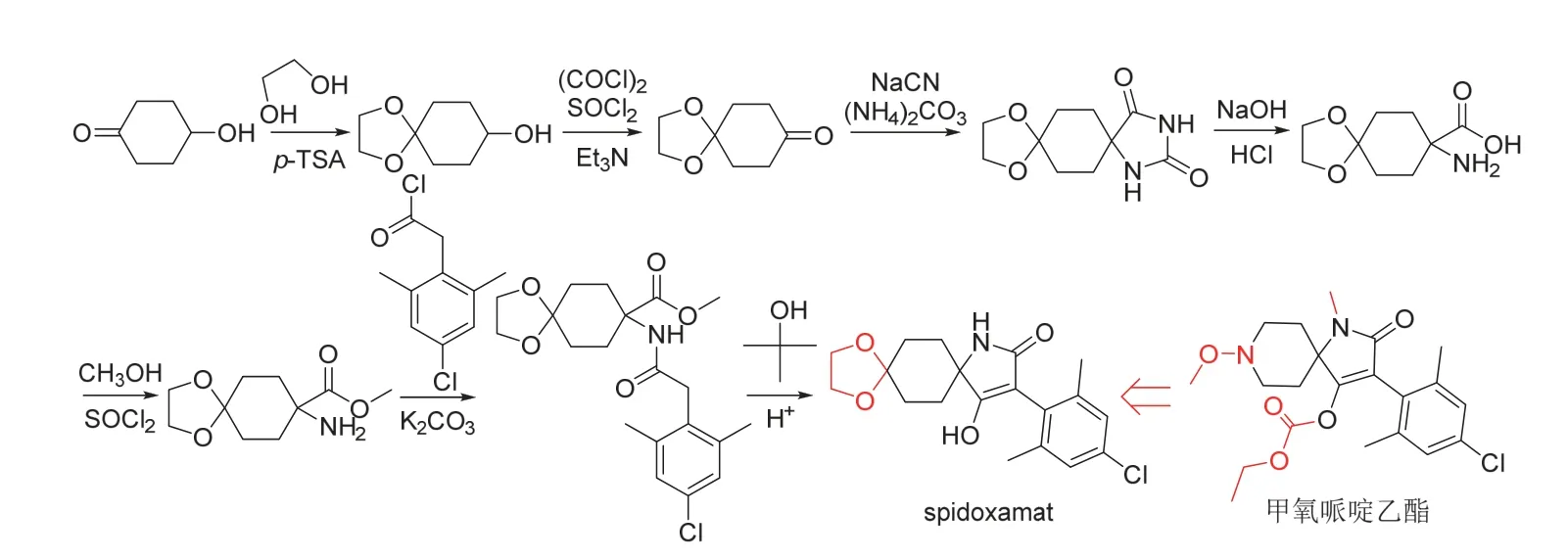
图14 Spidoxamat的化学结构、创制思路和合成路线
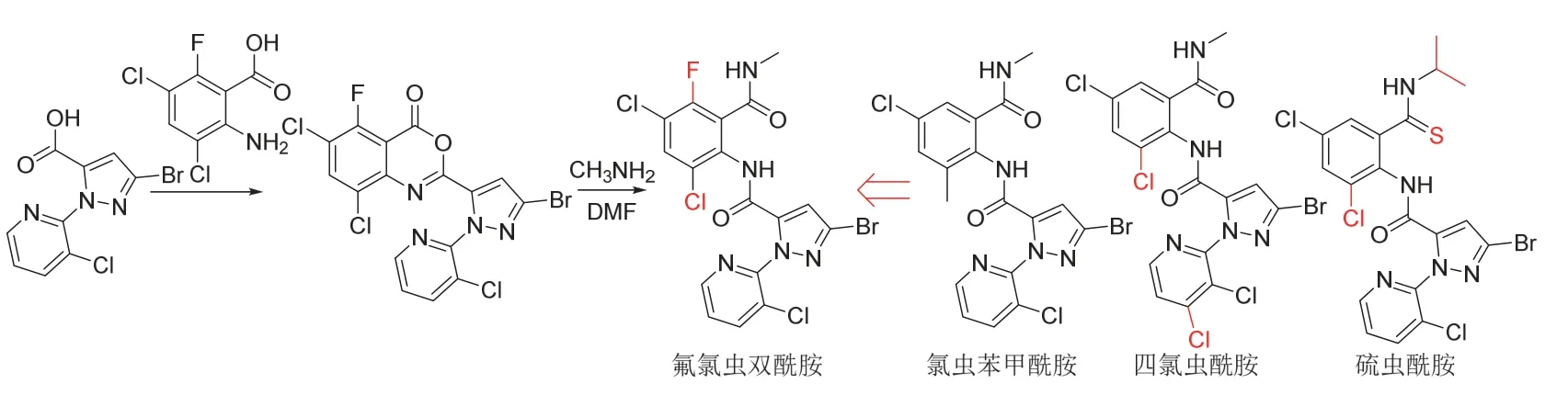
图15 氟氯虫双酰胺的化学结构、创制思路和合成路线
4.5 介离子类杀虫剂
Fenmezoditiaz是继三氟苯嘧啶(triflumezopyrim)和二氯噻吡嘧啶(dicloromezotiaz)后成功开发的第3个介离子类杀虫剂,推测其作用机制也为烟碱乙酰胆碱受体(nAChR)竞争调节剂,对多种抗性害虫有效[43,48]。Fenmezoditiaz的外消旋体在2 500 mg/L时对桃蚜(Myzus persicae) (3 d)、烟芽夜蛾(Heliothis virescens)(5 d)和巢菜修尾蚜(Megoura viciae)(5 d)的杀死率达75%以上,以500 mg/L处理时对兰花蓟马(Dichromothrips corbetti)、二点黑尾叶蝉(Nephotettixvirescens)和褐飞虱(Nilaparvata lugens)的3 d杀死率达75%以上[49]。Fenmezoditiaz为(R)-构型,推测其生物活性优于其(S)-对映异构体,前者可通过控制关键中间体2-氯-5-(2-亚乙基噻唑烷-4-基)噻唑的构型,或对外消旋体进行手性拆分得到[50]。Fenmezoditiaz及其外消旋体的化学结构、创制思路和合成路线[49-50]见图16。
4.6 吲哚酰胺类杀虫剂
Indazapyroxamet是杜邦公司新发现[51]的含吡啶基和环丙烷基的吲哚酰胺类杀虫剂,后由富美实公司进行商业化开发。Indazapyroxamet的骨架结构与现有的杀虫剂不同,可能具有全新的作用机制。Indazapyroxamet对西花蓟马、银叶粉虱、棉蚜和叶蝉等害虫具有较高活性,但对小菜蛾、草地贪夜蛾和南方根结线虫等的活性较低,与噻嗪酮、氯虫苯甲酰胺、吡虫啉、啶虫脒、乙基多杀菌素、氟啶虫胺腈、氟吡呋喃酮、氟啶虫酰胺、毒死蜱、联苯菊酯、氯菊酯、唑虫酰胺、溴氰虫酰胺、螺虫乙酯、库斯塔克苏云金杆菌、灭多威、茚虫威、虫螨腈、甲氧虫酰肼和氟酰脲按一定比例混用具有协同增效作用[51-52]。Indazapyroxamet的化学结构和合成路线[51-52]见图17。
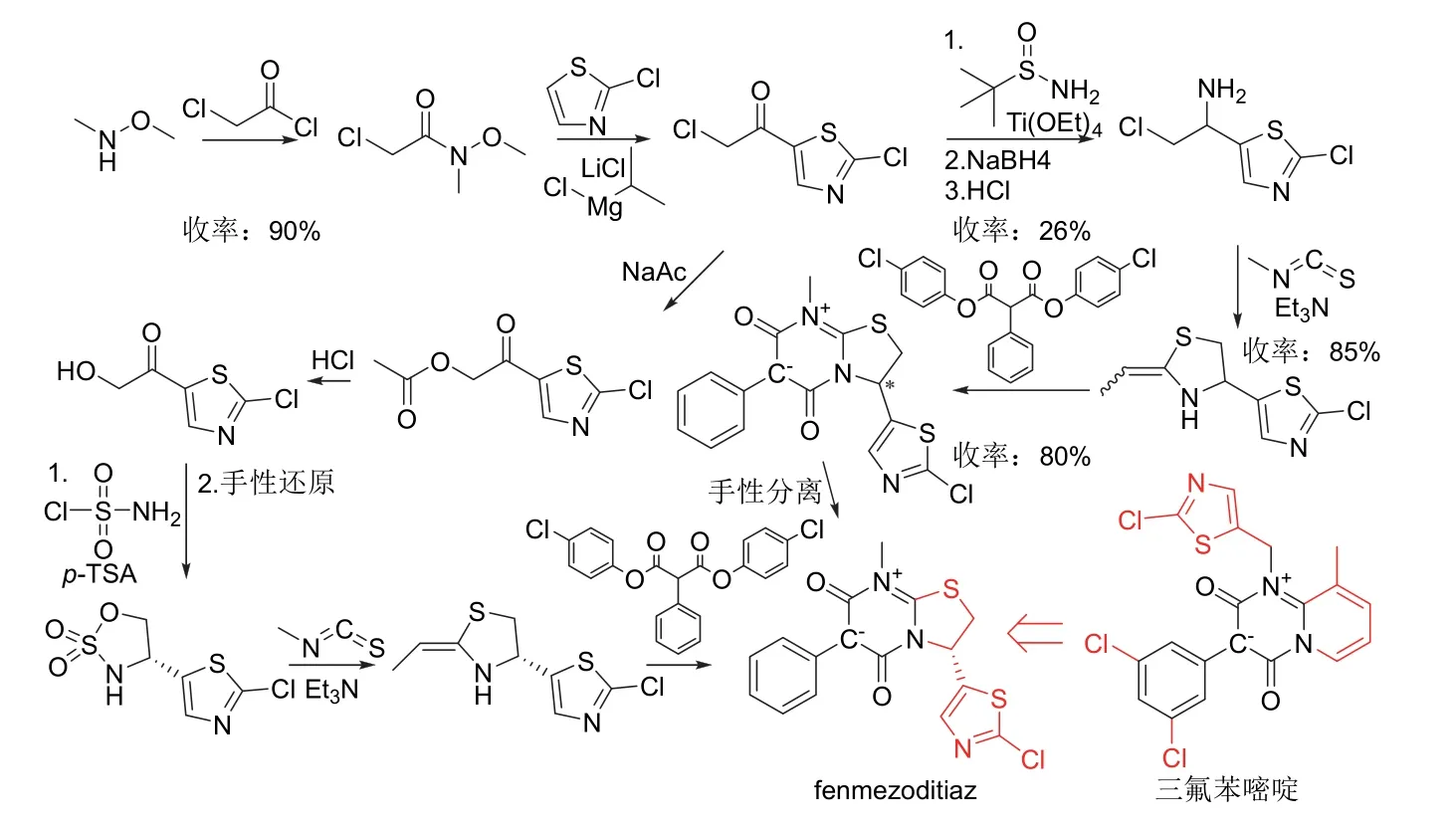
图16 Fenmezoditiaz及其外消旋体的化学结构、创制思路和合成路线
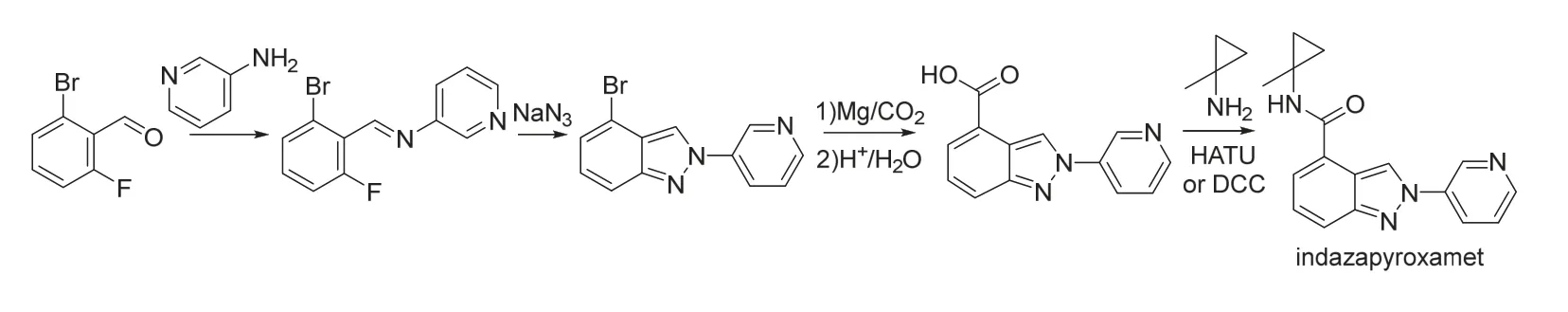
图17 Indazapyroxamet的化学结构和合成路线
4.7 三氟丁烯类杀(线)虫剂
三氟杀线酯(开发代号LH517)是中国自主创制开发[53-54]的三氟丁烯类杀(线)虫剂,其中(2RS,3RS)-反式对映体占60%~80%。三氟杀线酯具有对哺乳动物和土壤生物低毒,安全性高、持效期长,且与噻唑膦无交互抗性等优点。推测与氟烯线砜的作用机制相似,可能同为线粒体脂肪酸β-氧化抑制剂[3]。对根结线虫的室内生测结果表明[55],三氟杀线酯对卵毒力IC50(7 d)为8.92 mg/L,对2龄幼虫毒力LC50(48 h)为16.91 mg/L,与噻唑磷、氟烯线砜和tioxazafen相当;大田试验防效优于阿维菌素和氟吡菌酰胺,与噻唑磷相当。进一步的研究表明[56],三氟杀线酯还具有优异的杀虫杀螨效果,对朱砂叶螨、二斑叶螨、山楂叶螨和柑橘全爪螨等害螨成虫产卵和虫卵孵化的抑制作用均优于乙螨唑,对烟粉虱和迟眼蕈蚊虫卵孵化的抑制作用优于吡丙醚,对小菜蛾和玉米黏虫虫卵孵化的抑制作用优于虱螨脲。三氟杀线酯的化学结构、创制思路与合成路线[53-54]见图18,合成时可共用氟烯线砜的关键中间体4-溴-1,2,2-三氟-1-丁烯。
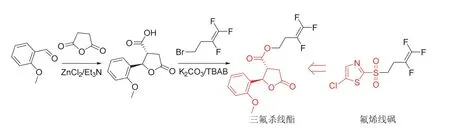
图18 三氟杀线酯的化学结构、创制思路和合成路线
5 植物生长调节剂
5.1 腺嘌呤类植物生长调节剂
2020-2021年ISO新公布的植物生长调节剂anisiflupurin为捷克奥洛穆茨大学(Univerzita Palackeho V Olomouci)和柏林自由大学(Freie Universität Berlin)合作发现[57]的腺嘌呤类物质,对由非生物胁迫诱导的细胞分裂素氧化/脱氢酶起抑制作用。离体试验结果表明[57],anisiflupurin具有较低的毒性,对哺乳动物骨肉瘤细胞系HOS、乳腺癌细胞系MCF-7和小鼠细胞系成纤维细胞NIH-3T3等细胞毒性与激动素(kinetin)相当,80次传代后比激动素对人成纤维细胞抗衰老性更好。在农业方面,先正达公司将该物质作为植物生长调节剂进行商业化开发。相关研究结果表明[58],anisiflupurin可刺激烟草愈伤组织生长、保持离体小麦叶片中叶绿素含量和暗诱导苋菜子叶中β-花青素的合成。Anisiflupurin的化学结构与激动素(kinetin)和谷维菌素(decoyinine)相似,其化学结构、创制思路和合成路线[57-58]见图19。
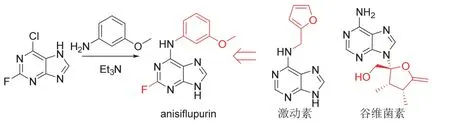
图19 Anisiflupurin的化学结构、创制思路和合成路线
6 总结与展望
农药新品种的持续研发和上市,为农作物增产、农民增收以及农业和经济社会的可持续发展提供了重要的保障。随着有效性、安全性和效益等方面要求的提高,农药新品种研发和上市的难度在增加、速度在放缓。根据Phillips McDougall公司2016年的报道[59],成功上市1个农药新品种,需要筛选16万个化合物,投入3亿美元,耗费长达12年时间,且其商业化成功与否还需市场的检验。以新品种从专利布局申请到ISO英文通用名获批为例,2020年和2021年新公布农药品种的平均耗时长达近10年(表1)。英文通用名获批的农药品种作为商业化开发的重点并引领着新农药研发的方向,但其数量却呈现出逐年减少的趋势。图20对1998-2021年ISO公布的农药品种(部分年份还有硝化抑制剂等非农药品种)数量进行了统计和趋势分析。值得注意的是,ISO新公布的农药品种数量大致在每4~5年达到一个峰值,中国创制农药品种的数量和占比趋势在逐年增加或上升。
虽然面临新冠疫情和经济发展放缓等多重困难和挑战,2020-2021年ISO新公布的农药品种数量还是达到了27种。这些新公布的品种都具有广阔的农业应用和国际市场前景,其研发延续了2018年以来的趋势[1],也出现了新的特点,总结起来主要表现在以下7个方面:⑴ 多个新品种可视为由某个或某类现有品种衍生而来,在化学结构、作用机制、生物活性和安全性等方面与后者存在诸多的相似性,可共用后者的中间体进行合成;⑵ flupentiofenox、rimisoxafen、氯吲哚酰肼、flumetylsulforim和indazapyroxamet等具有全新化学结构的品种得以开发,有望研究得到具有全新作用机制的农药新品类;⑶ 辛菌胺和anisiflupurin等卫生医药领域的化合物,以及flumetylsulforim等创制过程中使用的关键中间体作为农药得以利用,为新农药创制提供了新的思路;⑷ 乙唑螨腈、flupentiofenox、三氟吡啶胺和三氟杀线酯等专用、非专用杀螨剂和/或杀线虫剂品种得到关注,瞄准细分市场农药品种的前景看好;⑸ 三氟吡啶胺、辛菌胺、spidoxamat和三氟杀线酯等具有多重生物活性,开发潜力巨大;⑹ 中国创制品种的国际化和商业化继续取得突破,其数量占新公布品种总数的44%以上,且几乎所有品种均已在中国取得或即将取得农药登记批准;⑺ 农化公司(特别是跨国公司)仍是新品种研发的主力军,高校科研院所参与研发的新品种也在不断通过转让得以产业化。
在研发成功并进行专利布局之后,农药新品种英文通用名的获批为其商业化奠定了基础,随之而来的探索性田间试验、原药和制剂的研发、产品登记布局、应用技术开发和终端市场推广等对这些品种的商业化也颇为重要。未来,应加强对这些农药新品种的作用机制、抗性和应用研究,开发基于综合治理策略的产品组合和应用技术,促进新产品的田间应用与登记推广。另一方面,还应不断优化原药(特别是具有稳定晶型的)和制剂的生产工艺,在提高产品质量和药效的同时降低生产和使用成本,减量增效,提高新品种的市场竞争力。此外,还可利用这些农药新品种及其关键中间体和创制思路等进行深入的创制研究,有望开发得到更多高效低毒的新品种,从而为农民提供实际可用的有害生物治理工具。

