锂硫电池回顾与最新发展
燕绍九, 杨晓辰, 王超君, 陈 翔, 刘佳让,南文争, 刘 津
(1.中国航发北京航空材料研究院 石墨烯储能材料研究中心, 北京 100095;2.中国地质大学(武汉) 材料与化学学院 地质探测与评估教育部重点实验室, 武汉 430074;3.新南威尔士大学 材料科学与工程学院, 悉尼 2032)
随着可持续能源的逐步发展,人们已能高效利用风能和太阳能等可再生能源进行发电,但周期性的用电需求制约了可再生能源利用。电化学储能作为一种可靠、便捷储能方式,可保证供电平衡。锂离子电池是静置时自放电程度最低的电池,充放电循环寿命长,被广泛应用于卫星、电子产品和交通运输等领域,在储能方面作出了巨大的贡献。虽然各类锂电池均存在安全性差、生产条件苛刻等不足,但却可以在电量超量生产时提供稳定的储能条件。这得益于锂电池的高理论比容量(1675 mAh/g)和高能量密度(2600 Wh/kg),弥补锂电池的短板[1]。而且,硫矿源丰富,可稳定提供原材料供给。锂硫电池无记忆效应,可保障能量持续稳定输出可用于航空航天和军事等领域[2]。
锂硫电池最初由Danuta 在1960 年提出[3],之后众多科研团队筛选了如二甲亚砜(DMSO)、四氢呋喃(THF)、1,3-二氧戊环(DOL)等电解液,直到2002 年通过碳负载硫,锂硫二次电池制备技术才有所进展。Nazar 等[4]采用有序纳米结构介孔碳包覆硫。纳米材料可以增强锂硫电池电子导电率和离子导电率,减少电荷载流子特征扩散长度,从而降低动力学势垒。经过10 次充放电循环后,锂硫电池比容量仍可达到1100 mAh/g。纳米材料的使用极大促进了锂硫电池的发展,目前锂硫电池展现出较高的比容量(1586 mAh/g)和良好的循环寿命[5]。
在充电过程中,S8分子经历16 次电子转移,最终转化为Li2S,展现出极高的能量密度。随着放电过程进行,S—S 键逐步断裂产生多种聚合硫,并和锂离子反应生成多硫化锂(Li2Sn,n=1~8)[6]。当n>2时,多硫化锂和醚类电解液1,2-二甲氧基乙烷(DME)具有相似的极性。在浓度梯度和电场作用下溶解在电解液的多硫化锂穿过隔膜到达锂表面,与阳极发生微短路。被还原的Li2S 和Li2S2沉积在阳极上,不仅消耗了阳极活性物质,也减少了锂离子向阴极的传导。这种多硫化物在隔膜两侧往复循环的过程被称为穿梭效应,是目前锂硫电池无法作为商用的主要原因之一[7]。
自2010 年来,众多科研团队设计开发出多种策略以优化锂硫电池能量密度及充放电循环稳定性。例如通过将硫单质填充到碳基体中,掺杂导电宿主,增加硫的负载率;改变电解液的配方,使多硫化物能够吸附在阴极侧,减少穿梭效应;使用人工固态电解液界面(SEI)膜技术和阳极复合技术,对锂阳极进行保护。这些方式均可以有效增加锂硫电池容量,改善充放电循环性能。本综述首先分析锂硫电池的放电机理,其次梳理锂硫电池当前研究成果和进展,最后指出锂硫电池未来发展方向。
1 锂硫电池的机理
锂硫电池由金属锂阳极、硫复合阴极、隔膜以及电解液组成。通过组装扣式电池对电极材料和电解液进行筛选具有局限性,使用多层软包电池进行放大实验会暴露更多问题。难回收的电解液和极片会对自然环境造成较大负担,因此研究锂硫电池工作机理有较大必要性。由于硫导电率低,不能单独作为阴极使用,因此硫复合阴极通常由稳定的单质S8、导电剂和聚合物黏结剂组成。金属锂在放电过程中失去电子生成锂离子并溶于电解液,随后锂离子扩散迁移至阴极与S 进行下述反应。
阴极反应方程式:S8+ 16Li++ 16e-→ 8Li2S[8]
实际上,阴极硫还原是一个多过程的反应,其间产生大量可溶的多硫化锂(Li2Sn,n=3~8)。S8经过开环发生电化学还原并形成长链线性多硫化物,并在不同电位下进一步还原为短链多硫化物,直到全部变成Li2S 和Li2S2[9]。通过X 射线衍射、拉曼光谱、紫外光谱等多种表征方式优先确定其中所含的晶体物质为S8和Li2S[10]。但这些表征方式无法有效区分液相中长链多硫化物的结构,也无法确定其结构变化,更无法将放电过程中的化合物提纯进行深入研究。
研究认为,锂硫电池恒流放电曲线中电压改变与多硫化物长链结构有密切关系。通过充放电过程中电压-容量函数以及Peng 等[11]开发的近边X 射线吸收结构(XANES)技术检测锂硫电池中硫的形态,可分析锂硫电池工作机理(图1)。随着解聚过程进行,阴极活性物质可以与更多阳极锂离子进行反应。如图1(a)所示,单质硫经过固-液两相还原得到了Li2S8,并在2.2~2.3 V 间出现相对稳定的高电压平台。随着阴极活性物质从晶体向非晶体转变,Li2S8溶解在电解液中,标志着放电过程的开始。随着放电过程的进行,多硫化物链长变短,发生液相间的还原,更多锂离子参与到反应中,生成的多硫化物溶入电解液,导致电解液黏度增加,电压急剧下降。而2.1 V 电压平台得益于低聚合度多硫化物向难溶Li2S 或Li2S2进行液-固相转变,所有多硫化物转化成Li2S 和Li2S2,标志着完成全部放电过程。Hoefling 等[10]对锂硫电池进行了核磁共振碳谱(13C NMR)表征,模拟计算了多硫化物链长对α-和β-碳化学位移的影响。确定锂硫电池在放电过程中多硫化物结构以及电池系统中发生的反应,为设计更稳定锂硫电池提供了基础。
XANES 分析指出,锂硫电池溶液中会同时发生化学反应。除目前公认的歧化反应(),自由基作为中间产物对电池性能有很大影响。在锂氧电池研究中,稳定自由基有助于增强电池中氧化还原反应,也会提升电池充放电循环性能[12]。Schwenke 等[13]以甘醇二甲醚系列化合物作为溶剂制备锂氧电池,使用核磁共振氢谱(1H NMR)和傅里叶变换红外光谱(FTIR)对锂氧气电池进行定性研究,使用紫外可见光谱(UV)进行定量研究,证明不稳定氧自由基会对亲核试剂产生不可逆攻击,并对电池循环稳定性有巨大影响。与锂氧电池相似,锂硫电池中碳酸盐基电解质会受到多硫化物中间体的亲核攻击。Zhang 等[14]在研究以四甲基脲(TMU)为电解质的锂硫电池时发现,TMU 表现出类似溶解S3·—的能力,并对锂硫电池自由基溶解路径和过程进行说明,如图2 所示。通过增加电解质偶极矩,可为多硫化锂中的锂离子提供更强的溶剂化作用,从而提高电池稳定性。
自发现S8·—自由基开环引发本体聚合开始,多硫化物反向硫化成为提高锂硫电池容量的另一个研究方向[15]。Almeida 等[16]报道了一种可逆加成-断裂链转移(RAFT)聚合硫技术,可延长传统自由基聚合的反应时间,从而显著提高锂硫电池比容量。该课题组使用2-十二烷基三硫代碳酸酯基-2-甲基丙酸(DDMAT)合成了一种富硫网络,获得活性物质质量分数为90%的锂硫电池阴极极片,并组装成锂硫电池进行电化学性能测试。使用RAFT 聚合可以在一定程度下控制硫的反向硫化,当提高DDMAT 含量时,初次放电比容量提高显著,可达1000 mAh/g。
锂硫电池放电过程中,电压向2.1 V 过渡期间存在低于第二段平台产生的极化曲线。通过对图1进行分析,该极化曲线出现在液-固相转变过程初始阶段。随着多硫化物解聚,反应平衡被打破,发生电化学极化;多硫化锂随着放电过程的进行溶解在电解液中,锂离子迁移到阴极侧发生浓差极化;阴极多硫化物聚合程度改变、活性物质消耗以及电解液黏度变化共同造成电阻改变,发生欧姆极化。这三种极化方式共同作用在锂硫电池体系内,导致极化曲线出现。另外一种猜想是S62—还原产生S3
·—自由基,对电压造成影响,尤其是当阳极锂供给不足时,倾向于优先产生自由基。
经过分析锂硫电池放电过程原始数据发现,其放电曲线在第二个平台并非完全平衡。通过对比质量面积比分别为7 mg/cm2和2 mg/cm2的阴极极片所组装的锂硫电池可以看出,阴极极片质量面积比较小时,所产生的放电电压在2.1 V 平台更稳定,这与硫脱附有关。质量面积比为7 mg/cm2的阴极极片单位面积硫负载更多,导致其不能在放电过程第一阶段完全开环生成多硫化物,电压为2.1 V 时本该反应完全的S8仍在缓慢解聚。使用质量面积比为2 mg/cm2的阴极极片在一定程度上控制了S8可以在放电的第一阶段进行完全开环形成聚合硫。因此阴极活性物质面积质量比决定了S8开环效率,而不稳定的电压平台则说明锂硫电池放电过程中会产生使活性物质聚合度增加的歧化反应或自由基聚合。
2 锂硫电池的自放电
当电池处于开路电压(OCV)时产生容量损耗的现象称为自放电,并直接影响电池储存寿命。电池组装完成后,电解液会与阳极反应形成只允许锂离子通过的SEI 膜[17],但SEI 膜的隔绝作用并不完全,导致在OCV 状态下依然有电子不断穿过SEI膜,并持续发生缓慢反应,造成阳极活性物质减少。由于锂金属极片表面并不光滑,因此很难得到稳定且均一的SEI 膜。粗糙的表面会促进锂枝晶产生,并且部分枝晶在断裂后形成死锂,加速阳极活性物质流失。当枝晶刺穿隔膜后会造成内短路,电池内部温度上升导致低燃点的有机电解液燃烧引起事故[18]。阴极自放电因素主要来自过渡金属离子溶解以及金属与电解液反应生成SEI 膜[17,19]。
对锂硫电池来说,多硫化物溶解也是导致OCV期间发生严重自放电的原因。连续监测OCV 是目前测试锂硫电池自放电主要方法,电池容量会随着时间逐渐减少[20]。常用解决方案是将硫封闭在多孔导电基质中,对硫原子产生化学吸附作用的功能性碳来捕获多硫化物。另一方面,锂硫电池自放电容易受多硫化物溶解度、电解液黏度以及电解液组分与多硫化物之间化学相容性影响[21]。目前,对于锂硫电池自放电的改善仍依赖于阴极材料和电解液的研究。
3 阴极
3.1 提高硫的负载
锂硫电池有良好的电化学性能,但如果硫负载低于2 mg/cm2就无法充分发挥锂硫电池优势[22]。因此,寻找允许高硫负载和高固硫能力的主体材料极为重要。根据Song 等[23]进行的评估,锂硫电池若要实现商业化应用,载硫量需达4.2 mg/cm2。通过分析硫负载以及电解液和硫的比例(E/S)得出,硫负载必须高于2.0 mg/cm2,其比能量才能高于400 Wh/kg。当含硫量增加到3.0~5.0 mg/cm2或更高时,E/S 对比能量影响更为显著。若要将锂硫电池用于驱动电动汽车,硫负载标准则要高于7.0 mg/cm2,这均表明高载硫量是锂硫电池未来发展趋势[24]。
无论是一维碳纳米管,二维石墨烯,或三维多孔碳,均具有高比表面积及良好的导电性和电化学稳定性,是理想硫主体材料[18,25-26]。介孔具有强大的毛细作用力,可促进多硫化物进入内部孔隙,从而提高反应动力学。微孔既是可溶性多硫化物的容器,也是多硫化物的物理阻滞剂,可有效解决锂硫电池库仑效率低、循环寿命低的“双低问题”,对多硫化物穿梭效应也有较好的抑制作用[27-29]。如图3 所示,Du 等[30]制备的分级多孔碳纳米片由三部分组成。孔径分布曲线表明超薄分级多孔碳纳米片(HPCNs)具有三种主要孔结构:(1)大于5 nm孔隙由碳纳米片随机堆叠形成;(2)3.8 nm 介孔由碳纳米片堆叠的板状孔提供;(3)1.3 nm 微孔由多孔聚苯乙烯通过傅里德-克拉夫茨反应(Friedel-Crafts reaction)形成。通过控制炭化时间和温度,HPCNs 比表面积可增加到1420 m2/g。另一个决定锂硫电池阴极电化学性能的因素是碳基体上硫的分散状态,均匀硫负载可提升活性材料利用率和电化学性能。目前,主要的硫负载方法包括液相化学还原和固态熔融扩散[31-32]。液相化学还原可实现硫颗粒在碳基体表面均匀分布,但制备过程较为复杂,所得硫/碳复合材料中硫含量无法精确控制。而固态熔体扩散法则可以精确调节硫/碳复合材料硫含量,合成过程相对简单。
Ding 等[33]报道了一种三维分级碳硫纳米复合材料,使用蔗糖作为碳源,在硫酸催化下通过胶体聚合物和二氧化硅球原位自组装制备具有介孔壁和互联大孔的三维分级有序多孔碳。由该电极材料制备的锂硫电池比容量高达1193 mAh/g,经历50 次充放电后容量保持率可达74%。Chen 等[34]研发的新型蜂窝状氮氧共掺杂多孔碳,通过分级多孔结构协同作用限制多硫化物穿梭效应。氮氧共掺杂为碳材料提供了丰富的活性位点,制备出含硫量达到70~90%的复合电极。如图4 所示,Zhou 等[35]为了将多硫化物有效束缚在阴极,在极片内添加氧化石墨烯制备出更适合硫负载的厚电极。纯氧化石墨烯掺杂可在一定程度上增加锂硫电池的容量,但无法稳定束缚多硫化物,当经历30 次充放电循环后,容量会发生明显衰减。随着充放电循环进行,阴极侧体积膨胀,氧化石墨烯为多硫化物逃逸提供了更多通道和空间。使用支链淀粉对氧化石墨烯/硫复合材料进行包裹可以使阴极适应体积膨胀,聚合物与氧化石墨烯边缘的羟基和羧基间产生的次级键可有效避免多硫化物扩散。
不同尺寸孔隙间协同作用可优化锂硫电池电化学性能,而在硫/碳阴极体系中掺杂聚合物作为导电宿主,可促进多硫化物中间体和导电表面之间的化学相互作用。通过对含氮碳和无氮碳上羰基官能团进行密度泛函理论(DFT)计算表明,氮掺杂能增强硫与羰基官能团的结合以提高稳定性,如图5 所示[23]。Hou 等[36]通过计算指出氮、氧掺杂能有效增强碳基体与多硫化物的相互作用。另外,在阴极材料中掺杂具有催化活性的过渡金属氧化物、硫化物、碳化物、氮化物以及金属有机骨架衍生的复合材料在近几年逐渐成为热门研究方向[37]。合适的极性和本征电导率对于锂硫氧化还原反应至关重要,而极性导体具有增强表面电化学动力学和液-固相转移的能力。
3.2 氮元素掺杂
氮与碳在元素周期表中相邻,因此氮元素容易掺杂在碳材料中,常以吡啶氮、吡咯氮、石墨氮和氨基氮四种含氮分子进行掺杂。氮原子掺杂状态和含量可以通过退火温度和催化剂来控制[38]。近年来使用氮元素掺杂于不同种类的多孔碳并将其应用于锂硫电池的代表性工作如表1 所示[39]。Van Dommele 等[40]使用乙腈作为氮源,研究了不同退火温度下氮元素掺杂状态。当退火温度为823 K 时,吡啶氮为主要存在形式,当退火温度升高到1123 K 时,氮元素转变为更稳定的氮化胺,且氮和碳含量与温度成反比。
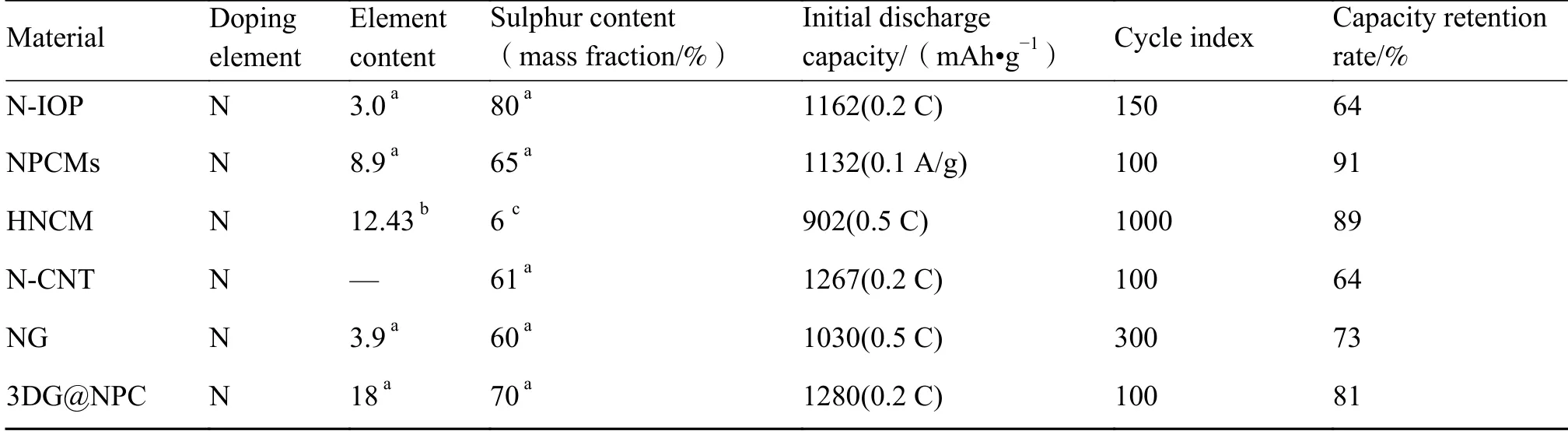
表1 碳质材料掺杂氮元素制备的锂硫电池性能[39]Table 1 Performance of lithium-sulfur battery prepared by carbon material doped with nitrogen element[39]
Wu 等[41]通过树脂高温炭化获得氮掺杂碳(NPMC)与二氧化硅纳米复合材料,制备出高硫负载阴极极片,其活性物质质量面积比为4.2 mg/cm2。与吡啶氮掺杂羧基和吡咯氮掺杂羰基作横向对比,发现NPMC 中的氮元素可促进硫原子和碳原子上氧官能团之间成键。Tong 等[5]通过十二烷基硫酸钠(SDS)极性基团在水热条件下吸收长链葡萄糖酸,脱水聚合成微小自组装碳核,形似绣球花状氮硫共掺杂介孔碳(NSHC)。在6.72 mg/cm2的高硫负载的情况下,NSHC 电极所制备的锂硫电池仍然表现出699 mAh/g 的高比容量和稳定的充放电循环性能。对该电极进行DFT 计算,确定氮硫共掺杂位点能增加NSHC 的极性并提高吸附能,有利于捕获多硫化锂。
Wang 等[42]使用喷雾干燥技术制备出一维氮掺杂的碳纳米管微球(HNCM)。通过X 射线电子能谱(XPS)分析发现,随着温度从700 ℃升高至900 ℃,氮原子分数从18.28%下降到7.05 %。这是由于吡啶热稳定性较差,温度升高导致吡啶逐渐分解。当煅烧温度为800 ℃时,负载活性硫的HNCM 电极具有最优化学性能。HNCM800 电极不仅有高电导率,还具有良好固硫能力,这对后续研究碳材料中氮元素最佳掺杂量具有良好的参考价值。Qiu 等[43]通过氧化石墨烯热氮化制备出氮掺杂的石墨烯片(NG),进一步研究了氮掺杂对多硫化物穿梭效应的抑制作用。结果表明,NG 对多硫化物有强结合作用。掺杂过程中NG 可以重构官能团中带负电氮离子,使得SxLi…N 之间产生强偶极-偶极相互作用,而与多硫化物离子之间不存在静电引力。这对于捕获高阶多硫化锂和充放电时再沉积过程至关重要。Han 等[44]以分层多孔结构氮掺杂三维逆蛋白石碳(N-IOP)制备出高表面硫含量的阴极材料,XPS 结果显示吡咯氮和吡啶氮的氮原子比接近7∶3。优异的电化学性能主要是由于这两种氮原子可有效捕获多硫化物,增加活性物质利用率,并通过与导电碳的协同作用优化电池性能。
根据对氮元素掺杂碳基体材料的介绍可以发现,无论在一维或是多维碳基体材料中,氮掺杂都对锂硫电池性能带来较大提升。由于吡啶氮和吡咯氮含有的孤对电子具有很强电负性,在电池充放电循环过程中可以形成SxLi…N 结构,其相互作用更有利于抑制多硫化锂溶解进入电解液并发生穿梭效应。硼元素比碳元素电负性更小,因此将硼掺杂到碳基体材料中可以与多硫化物阴离子形成较强的电荷吸附效应[45]。对比几组文献数据发现,硼掺杂的碳基材料电导率要高于无硼掺杂的材料,并且硼掺杂阴极极片在首次放电中容量和氮掺杂相差不多,但活性物质负载率和循环稳定性较差[46]。
3.3 二元掺杂
单元素掺杂可通过物理限制和化学吸附抑制多硫化物穿梭效应,却无法激活沉积在碳基体材料上已经失活的固态硫化锂。而掺杂具有催化活性的过渡金属可以在增强基体与多硫化物结合时加速多硫化物氧化还原反应动力学,控制Li2S 在基体上沉积,在充电过程中提供更小分解势垒[47]。表2 总结了近年来多孔碳、碳纳米管和石墨烯在锂硫电池中的应用研究成果[48]。Xie 等[28]和Li 等[49]设计的钴掺杂碳,分别展现出85.36%的容量保持率(300 次充放电循环)和1130 mAh/g 的高比容量,但仅有Co 掺杂碳基体所制备的阴极极片综合性能仍无法达到商业化要求。使用两种或多种元素进行掺杂,可以将各类掺杂元素优点进行结合。筛选合理的元素配比能实现掺杂元素之间功能协同,从而提高碳基体电化学性能。二元掺杂是在一种掺杂元素基础上,使用另一种掺杂元素进行同方向配合以提升基础掺杂元素性能,或通过不同方向配合以实现附加性能。如氮镍共掺杂中氮元素可抑制多硫化物穿梭效应,镍元素催化活性可加速氧化还原反应,快速溶解Li2S 并提高锂硫电池循环稳定性[50]。二元掺杂的锂硫电池反应机理更加复杂,可选择元素种类众多,元素配比需要筛选,对制备阴极极片带来很多困难。以氮元素作为二元掺杂首选元素是因为氮掺杂较为简单易行,并且可以增加碳材料导电性、场发射性能、氧化还原催化活性以及碳源稳定性[51-52]。众多研究结果表明,氮硫掺杂在活性物质负载和首次放电容量上有着较好表现。氮钴掺杂则在循环稳定性、高倍率和容量保有率中有良好成绩。
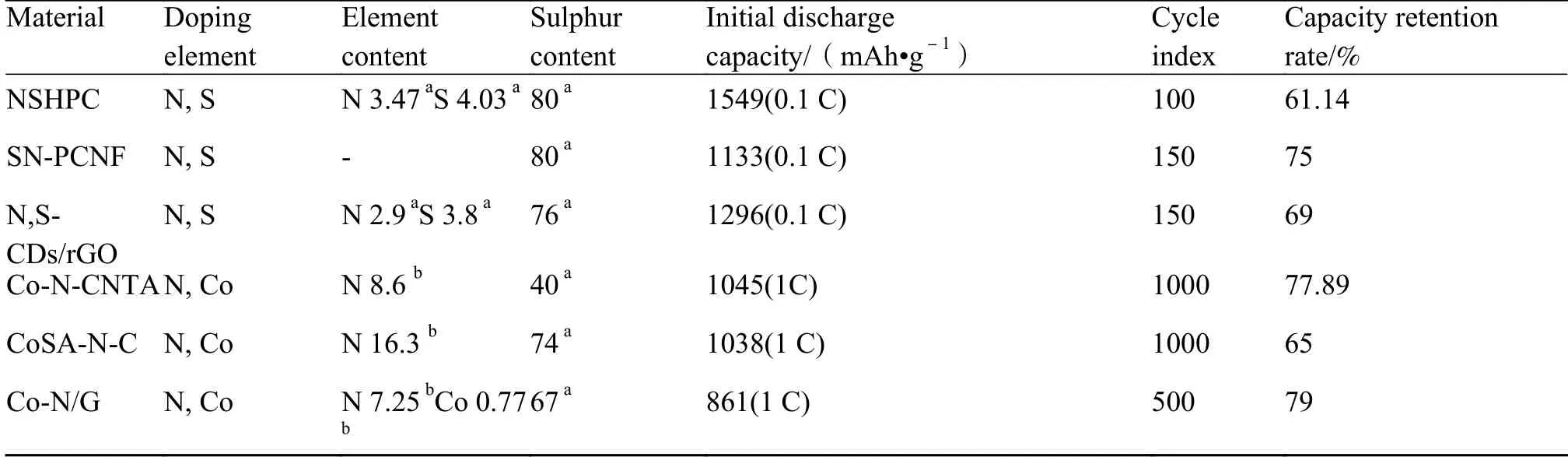
表2 碳质材料进行二元掺杂制备的锂硫电池性能[48]Table 2 Performance of lithium-sulfur batteries prepared by binary doping of carbonaceous material[48]
3.3.1 氮硫二元掺杂
硫元素掺杂可以改变导电基体电子云密度分布,以提供更多吸附位点,增强载体材料对多硫化锂吸附,为阴极提供更多空间,增加硫负载。Li 等[53]使用莲子作为氮源和硫源,对材料进行一步活化、炭化和掺杂处理,制备出蜂窝状氮硫二元掺杂分级多孔炭化合物。该材料被用于阴极和隔膜间柔性夹层,有效降低电荷转移阻力,促进锂离子传输,增加多硫化物静电排斥力。Wang 等[54]设计的多孔硫氮双掺杂石墨烯(SNGE)与Li 等设计思路类似,使用SNGE 附着在阴极表面,在充放电过程中起到保护隔膜作用。通过对多硫化物的物理限制和增加吸附位点共同抑制多硫化物穿梭,使电池具有良好充放电循环稳定性。Chabu 等[55]以蛋清作为氮源和硫源,在还原氧化石墨烯上通过水热法进行氮硫掺杂,制备出一种新型复合材料(N,S-CDs/rGO),如图6 所示。水解蛋清中氨基酸和肽在水热过程中部分被炭化成硫和氮,并在聚合前附着于GO 上,为多硫化物提供丰富活性位点。由该材料制备的电池在首次放电容量达到1549 mAh/g。当电流密度达到7 C 时,放电比容量仍能达到
740.8 mAh/g。
3.3.2 氮钴二元掺杂
氧化还原过程中固态多硫化物的转化率低,放电过程中Li2S 和Li2S2沉积不均匀以及充电过程中Li2S 和Li2S2无法完全溶解是导致锂硫电池充放电循环性能较差因素之一。氮钴共掺杂可以在硫溶解和沉积过程中提供丰富的多硫化物吸附位点,诱导Li2S 均匀沉积,改善锂硫电池氧化还原反应动力学[56]。因此,氮钴协同作用对高性能锂硫电池开发具有重要意义。为解决多硫化锂延迟氧化还原反应动力学以及穿梭效应,Hu 等[57]构建了Co-N-Co 掺杂碳纳米管阵列(Co-N-CNTA)并将其用作硫载体。通过比较不同掺杂元素在碳基体中Li2S6的电流密度和过电位与Li2S4还原峰,发现Co-N-CNTA 在电化学反应中具有最高电流密度和最低极化程度。这表明氮钴掺杂可降低多硫化物反应势垒并有效加速氧化还原反应动力学。Li 等[58]通过盐模板法制备出钴氮原子催化的氮掺杂碳纳米片(CoSA-NC),发现钴氮原子可为多硫化物离子提供更多结合位点,而引入氮元素可促进吸附多硫化锂末端锂离子,如图7 所示。钴位点与其周围的氮以Co-N4结构进行结合,可同时达到加速多硫化物转化,降低Li2S 氧化动力学阻力的目的,使Li2S 更容易被还原为S8分子。
当硫负载质量分数大于70%时,纯碳基体材料难以抑制多硫化物穿梭效应。元素掺杂到导电碳基体可改变其局部电子分布,增强导电性和活性物质利用率。二元掺杂对锂硫电池电化学性能正向影响更为显著,氮硫掺杂通过协同作用可有效减弱穿梭效应,提高阴极活性物质负载率;氮钴掺杂通过增加吸附位点来固定多硫化物,提升充电过程中Li2S 的氧化反应速率。同时,研究者们也在尝试更多类型的元素掺杂,如氮硼、氮氧等二元掺杂。而两种以上碳基材料元素掺杂受限于其化学状态,影响相邻碳原子电子结构,随着元素种类增加,锂硫电池充放电机理也更加复杂。多元掺杂工艺目前并不成熟,相关的报道较少,但依然有研究证明三元掺杂的可行性,并制备出以氮、氧、钴和石墨介孔复合材料的阴极极片[59-60]。
使用不同的元素掺杂可以提升锂硫电池电化学性能,利用计算分析电子结构可以判断掺杂元素特性。借助多物理场耦合分析软件对不同的掺杂元素进行模拟,明确掺杂机理,可达到节省材料、保护环境等作用。元素掺杂在保持碳基体材料高电导率基础上,增加了对多硫化物的吸附能力,但掺杂元素选择不得当也会对电池电化学性能造成负面影响,应注意元素之间是否存在抑制作用,控制掺杂元素质量比,以减弱对电池能量密度影响。现在仍没有发现可以完全满足市场需求的阴极极片配方,无论是成本、环境友好以及制备工艺,锂硫电池仍无法规模化生产。
4 锂硫电池电解液
电解液在锂硫电池中主要功能是传输电极之间离子,提高化学和电化学稳定性。理想电解液具有高离子电导率,且能提供稳定、安全的化学反应环境,与电池组份产生高亲和力。另外,减小多硫化物溶解的电解液可有效避免穿梭效应,但没有多硫化物溶解,硫元素还原反应就只能发生在硫/碳界面上,导致大量活性物质无法被有效利用[52]。因此,电解液的改进需要针对活性物质特性进行研究,包括使用不同溶剂、锂盐和添加剂等。电解液离子传输所带来的高电位可以加速高倍率锂硫电池的氧化还原反应。
目前对锂硫电池电解液研究方向主要分为液态电解液(如醚基、碳酸盐基电解液)和固态电解液(如聚合物和非聚合物电解液)。液态电解液是最常用的电解液,具有表面张力低、黏度低、浸润性好等特性,电解液和活性材料之间接触能力更好。同时液态电解液具有界面电阻低,溶液易制备及离子易扩散等特性,因此被广泛应用和研究[61]。而固态电解液可抑制多硫化物的穿梭效应和锂枝晶生长,可有效提高锂硫电池电化学性能。
4.1 液态电解液
4.1.1 醚基电解液
由于聚合硫可以稳定存在与醚基电解液中,并且具有高离子传导率,是使用最广泛的液态电解液。醚基电解液可使锂硫电池以相对较低的电势(<3 V)运行,优化醚基电解液的组成是实现锂硫电池高性能和高循环寿命的关键因素[62]。在多种醚类溶剂中,链状醚如DME、聚乙二醇二甲醚(PEGDME)和四乙二醇二甲醚(TEGDME)等都对多硫化物有良好溶解能力[52]。Mikhaylik 等[63]分别研究了单一DME 和DOL 溶剂以及DME/DOL二元溶剂,发现DOL 有助于在锂表面形成SEI 膜,但溶解多硫化物能力较低。DME 与锂更容易反应,可以提高多硫化物溶解度来加快反应。将这两种溶剂以一定比例混合,在锂硫电池比容量和充放电循环寿命方面表现出良好协同作用。Wang 等[64]以LiClO4作为锂盐溶质,测试不同比例DME/DOL对锂硫电池电化学性能的影响。发现当体积比DME∶DOL = 2∶1 时,所制备的锂硫电池初始放电容量可达1200 mAh/g,经历20 次充放电循环后,仍有800 mAh/g 比容量得到保留。Kim 等[65]筛选了多种电解液,分析锂硫电池在不同溶剂下的充放电行为,发现随着DME 含量增加,充放电循环性能和容量保持率均有着显著提升。Zhou 等[66]发现二丁醚(DBE)能有效避免多硫化物溶解。如图8 所示,分别显示了Li2S6在DBE、DME/DOL 和TEGDME中溶解度差异。经过24 h 搅拌后,观察到DBE有明显抑制多硫化物溶解的能力,静置50 天后溶液仍可保持淡黄色透明澄清液体。随着对醚基溶剂深入研究,氟化醚如1,1,2,2-四氟乙基-2,2,3,3-四氟丙基醚(TTE)和二异丙基醚(DIPE)也相继被开发出来,但均伴随有阳极锂枝晶生长过剩,电极膨胀等负面影响[67-68]。
4.1.2 碳酸盐基电解液
常见的碳酸盐基电解液有碳酸亚乙酯(EC)、碳酸二乙酯(DEC)、碳酸亚丙酯(PC)和碳酸二甲酯(DMC),可为锂电池提供高电导率和化学稳定性,但碳酸盐基电解液易与多硫化物发生反应,硫化物阴离子和碳酸盐之间的化学反应会在放电过程中形成甲基硫醇盐和硫醚,导致容量严重衰减[69]。Wang 等[70]尝试在碳酸盐基电解液中使用硫化聚丙腈(SPAN)抑制多硫化物与EC 溶液反应,在经历30 次充放电循环后,其容量保持率可达90.4%,但该阴极材料硫负载率最高仅为46.3%,随着活性物质含量增加,其电化学性能明显下降。由该复合材料制备的电池首次放电电压较低,平均值仅为1.5 V(以比容量中值为基准),低于后续循环,显示出明显过电位现象。将等量EC 和DMC 加入LiPF6,通过搅拌使其变为凝胶作为电解液可有效提升锂硫电池比容量。在经历50 次充放电循环后,仍有1276 mAh/g 比容量得到保留,但活性物质硫负载仅为1.52 mg/cm2。为了更详细地了解EC 和DMC 溶剂对锂硫电池影响,Li 等[71]制备了有序微孔碳作为限制多硫化物溶解的阴极复合材料,并对碳酸盐基电解液中电极结构进行理论计算。结果表明,电解液和碳基体微观结构对电化学性能有重要作用。EC 和DMC 的直径分别为0.574 nm 和0.796 nm,大于有序多孔碳微孔尺寸,表明微孔可以有效阻止碳酸盐分子渗透,保护活性物质不与碳酸盐发生反应,增强锂硫电池倍率性能和充放电循环稳定性。
4.2 固态电解液
4.2.1 固态聚合物电解液
有机液态电解液在锂硫电池开发中占据主导地位,但无法避免多硫化物的穿梭效应和锂枝晶形成,而采用固态电解液可有效提高锂硫电池电化学性能[61]。通过放电曲线可以观察固态电解液和有机液态电解液最大的区别。固态电解液只表现单一平台,这是由于从S8到Li2S 的过程中仅发生了固-固单相还原,且能抑制反应动力学和极化[72]。另外,固态电解液比有机液态电解液燃点更高,且不易发生内部短路、泄漏,在穿刺实验中表现出更好安全性能[73]。目前主要研究的两种固态电解液为固态聚合物电解液和无机固态电解液。固态聚合物电解液机械稳定性高,与锂金属形成的界面稳定并可抑制锂枝晶形生长。固态聚合物电解液通常由高分子聚合物溶剂主体以及溶解在其中的锂盐组成。聚合物溶剂包括聚环氧乙烷(PEO)、聚苯醚(PPO)、聚丙烯腈(PAN)、聚偏二氟乙烯(PVDF)等,溶质则包括LiClO4、双(三氟甲基磺酰氨基锂)(LiTFSI)、LiBF4和LiPF6等锂盐。
Jeon 等[74]研究出PEO-LiClO4组合,由于PEO 与碱金属离子可以形成配位键,因此常作为薄膜高能量密度电池中的电解液,但其离子导电率仅为10-7~10-6S/cm,并且,PEO-LiX聚合物力学性能差、低温下离子导电率低。Teran 等[75]使用PEO为原料,针对聚苯乙烯-b-聚(环氧乙烷)共聚物和多硫化锂混合物形态开展研究,证明嵌段共聚物作为电解液的可能性。更换电解液中锂盐是改善电导率的一种有效途径。使用溶胀法将PEO 和LiTFSI 以20∶1 混合到乙腈溶液中所制备的电解液可以将电导率提升到1.22×10-5S/cm[76]。在主体聚合物中使用SiO2、TiO2、ZrO2等无机纳米陶瓷填料可有效提升导电率[77]。纳米填料有利于降低聚合物溶剂结晶度,增加非晶态离子电导率,填料表面基团与PEO 氧原子会产生相互作用,交联聚合物链能延缓结构重组,增加锂离子迁移率。Kim 等[78]认为,10 %(质量分数)的ZrO2作为锂硫电池固态电解液添加剂可在锂金属表面形成精细的分散层,同时也增加导电率。Hassoun 等[79]以全固态PEO18Li(CF3SO2)2N-10 作为聚合物主体,ZrO2作为固态电解质,使用有均匀通道的介孔球碳作为硫阴极导电基体材料。与常规锂硫电池相比,该复合材料所制备的电池在充放电循环性能上有较大的提升,25 次充放电循环后可逆容量依旧达800 mAh/g。
4.2.2 凝胶聚合物电解液
凝胶聚合物电解液具有高于固态聚合物电解液的导电率和机械稳定性,所制备的锂硫电池具有稳定的循环性能和较高首次放电容量[80]。在凝胶聚合物电解液中,液相的存在降低了固相玻璃化转变温度,也促进聚合物基体在固相中分段运动[81]。使用多孔膜与N-甲基-N-丁基吡咯烷鎓双(三氟甲磺酰基)亚胺离子溶液制备凝胶聚合物电解液的热稳定性和阳极氧化能力表现较好[82]。该凝胶聚合物电解液制备的锂硫电池首次放电容量达到1217.7 mAh/g,并具有良好循环稳定性。采用化学修饰PEO 网络制备凝胶聚合物电解液使锂硫电池可在常温下使用。Zhou 等[83]采用与PEO 具有相似结构的聚(乙二醇)二缩水甘油醚(PEDGE)和接枝聚乙烯亚胺(PEI)制备出一种新型凝胶聚合物电解液。其中氮元素提供丰富孤对电子,可构建超导凝胶。在醚基、氨基与锂离子协同作用下所构建的锂硫电池电导率在30 ℃时达到7.5×10-4S/cm,可在1.5 C 电流密度下实现400 次稳定的充放电循环。聚偏二氟乙烯(PVdF)是目前研究最多的聚合物骨架,强大的吸电子基团和高介电常数有利于锂盐溶解[84]。当添加EC 或PC 作为增塑剂时,基于PVdF 的凝胶聚合物电解液可以形成均质混合薄膜。然而,锂阳极界面不稳定是PVdF 凝胶聚合物电解液面临的最大挑战。使用有机多硫化物和PVdF 组合获得稳定界面是目前常用方法[85]。Zeng等[86]合成了几种有机多硫化物聚合物作为电解液添加剂或助溶剂,并将其引入到PVdF 凝胶聚合物电解液中,用以稳定SEI 膜。所制备的聚合物对锂离子具有选择渗透性,有机多硫化物聚合物还可作为转移介质,改善Li2S 和Li2S2在电极表面沉积状态[81]。凝胶聚合物电解液具有高柔韧性,体积耐受性以及良好兼容性,但同时面临界面不稳定和充放电循环寿命差等缺点。界面不稳定导致锂阳极更容易产生枝晶,并易与穿梭到阴极侧的多硫化物发生反应,因此使用凝胶聚合物电解液时也应关注阴极保护。另外,相较于固态聚合物电解液,凝胶聚合物在循环寿命上略有提高,但在长期服役时会发生溶液泄露,也无法完全避免多硫化物穿梭效应。对于凝胶聚合物电解液来说,仍需在大量研究来探索相界面以及SEI 的特性。
4.2.3 非聚合物电解液
非聚合物电解液又名无机固态电解液,由无机锂盐构成,在高热的工作环境和化学稳定性方面有较强的优势[87]。ABO3钙钛矿型、Li3N 和Li4SiO4是目前锂硫电池中常用的非聚合物电解液,具有高离子电导率、高离子转移数以及低电导活化能,是良好的离子导体和电子绝缘体[88]。随着对高功率和高能量密度电池需求逐渐增大,非聚合物电解液在锂电池特殊应用领域有望取代有机液态电解液。氮化锂作为最初被发现的非聚合物电解液材料具有很高的离子导电率(室温下为6×10-3S/cm),但低电化学分解电位限制了氮化锂在实际中的应用。常见非聚合物晶体材料电解液离子电导率大约为10-3S/cm[87]。Hayashi 等[89]研究了室温下具有10-3S/cm 的高电导率Li2S-P2S5玻璃态电解液。硫/碳复合电极和Li2S-P2S5电解液推进了玻璃陶瓷电解液的发展,在室温下以1.3 mA/cm2电流密度进行200 次充放电循环后,可逆容量保持在850 mAh/g 以上。Kamaya 等[90]开发的Li10GeP2S12具有10-2S/cm的高导电率,使非聚合物电解液在锂硫电池中有良好应用潜力。通过该材料制备的锂硫电池表现出接近理论值的可逆容量和高达11000 W/kg 的功率密度[91]。同时他们也比较了Li10GeP2S12以及其他固态电解液、聚合物电解液、离子电解液和凝胶电解液的离子电导率的热演化,如图9 所示[90]。Wang等[92]制备的Li1+xTi2-xAlx(PO4)3电导率大于1 mS/cm,但金属锂与Ti4+接触后会引起晶体变形并导致晶胞各向异性,在陶瓷电解液中发展成小裂缝并削弱晶体连接,使电极膨胀。用锗离子代替钛离子可以获得理想且稳定电化学性能。
Chen 等[93]认为,使用多硫化物不可渗透的非聚合物电解液代替液态电解液可以消除锂硫电池容量快速衰减的问题。同时,他们探索了以Li6PS5Br 为全固态锂硫电池的充放电循环性能、电解液稳定性和老化机制。通过两步球磨制备结晶硫复合阴极,得到1355 mAh/g 的初始放电容量,经过50 次充放电循环后容量保持率为80%。同时他们认为,使用结晶硫代磷酸盐固态电解液在更高的球磨速度(500 r/min)中可以最大限度减少球磨对菱沸石结构的损伤,并增加无定形相电导率。在25 ℃通过循环伏安法(CV)发现高电导率纳米多孔β-Li3PS4能有效抑制锂枝晶生成,并且在后续开发中尝试使用β-Li3PS4来包覆纳米级Li2S 颗粒作为阴极活性材料[94]。使用硫代磷酸盐作为非聚合物电解液初始放电容量可以达到1216 mAh/g,但容量保持率却不尽如人意。这是由于低比表面积的碳基体材料使硫/硫化物与功能底物之间缺乏相互作用。硼氢化锂的晶界电阻低、化学性能和六方晶型稳定、机械强度高、柔韧性良好,也被用作固态电解液[95]。Nguyen 等[96]分析了一类硼氢化物LiM(BH4)3Cl 作为固态电解液中的锂盐,其中以铈组成的LiCe(BH4)3Cl 性能最稳定,用其制备的锂硫电池在70 ℃下首次放电容量达到1186 mAh/g。
硫的低电导率和锂枝晶形成严重阻碍锂硫电池实际应用。除研究阴极材料外,电解液开发也逐渐被重视,包括有机液态电解液和固态电解液都为锂硫电池应用提供帮助。液态电解液具有高离子导电率、低黏度以及为多硫化物和锂离子提供良好的相容性。在锂硫电池的研究中,电解液开发逐渐偏向为单独阴极材料服务,以达到更好性能。在未来研究中,液态电解液需在以下几个方面进行系统的比较和研究:了解不同电解液充放电循环机制、设计高效电解液态系,以及研究SEI 膜形成机理。而固态电解液可有效消除多硫化物的穿梭效应,促进锂硫电池商业化应用。对于其未来的研究方向,固态电解液需要将聚合物电解液和非聚合物电解液的离子电导率进一步提高,并进一步研究固态电解液的锂离子传输和多硫化物放电过程中的断键机理。
4.3 电解液添加剂
4.3.1 硝酸根添加剂
电解液添加剂能有效维持电池体系中极片稳定,LiNO3添加剂有助于在锂表面形成稳定的SEI膜。将含有LiNO3电解液LS002 和不含LiNO3的电解液LS001 所组成锂硫电池分别进行电化学测试,发现使用LS002 电解液的电池容量和工作寿命均有较大优势。LiNO3添加剂在锂硫电池系统中与锂反应形成的SEI 膜可有效抑制多硫化物的穿梭效应。该SEI 膜会形成两个固相层,包括顶层(多硫化物氧化产物)、底层(多硫化物和LiNO3还原产物)。这表明LiNO3添加剂和多硫化物的存在可为SEI 膜提供分级结构,并让锂离子通过SEI 膜的传输阻抗显著降低[97]。然而硝酸根离子会随着钝化膜破坏以及新SEI 膜再生逐渐消耗,使电解液中硝酸根离子不能有效地改善锂阳极表面形貌[98]。使用金属阳离子作为添加剂可以在锂金属表面形成金属层或合金层,提高阳极稳定性。然而,金属阳离子作为电解液添加剂仍需要进一步探索,因为金属锂还原性过强,锂阳极表面电化学溶解/沉积反应过快,导致SEI 膜形貌不可控。Liu 等[99]提出将硝酸镧(La(NO3)3)作为电解液添加剂以减缓阳极锂电化学沉积反应,提高电池循环稳定性。通过对比有无La(NO3)3电池的电化学性能发现,La(NO3)3、多硫化物和锂之间通过寄生反应形成的SEI 膜会导致首次放电电压平台略低于不添加La(NO3)3的电池。因此在电池组装完成后需要更长的静置时间对电池进行活化。与之类似的是使用双功能添加剂硝酸氧锆(ZrO(NO3)2),其中的ZrO2+不仅可以催化溶解多硫化物,同时也可以捕获多硫化物避免其溶解在电解液中[100]。
4.3.2 硫添加剂
含硫元素添加剂可以减少锂硫电池阴极活性物质溶解,并快速补充循环过程中损失的活性物质,目前主要研究方向包括二氧化硫、二硫化碳以及多硫链烃[101]。但气体添加剂会导致电池内部压力过大,因此,针对二氧化硫添加剂的研究尚处于起步阶段。而多硫化物作为电解液添加剂对锂硫电池比容量有促进作用。Wagner 等[102]使用P2S5作为添加剂能有效促进Li2S 溶解,并在浸润期间形成较薄聚合物-电解液界面(PEI)。Lin 等[103]通过CV 研究了Li2Sx/P2S5配合物的电化学性质,证明该钝化层的主要成分为Li3PS4。对含有Li2Sx/P2S5添加剂的锂硫电池进行电化学测试,得到了最高1350 mAh/g 的可逆容量和大于90%的库仑效率。多链硫醚作为含硫电解液添加剂可与醚类电解液互溶,能有效提升锂硫电池电化学性能。二硫化碳与醚类溶剂同样有提高电化学性能的能力,这是因为二硫化碳可以与多硫化物在电解液中反应,减少对锂阳极的腐蚀,同时二硫化碳也是SEI 膜优化剂[104]。
电解液添加剂种类繁多,如含磷、氟、以及砜类添加剂等。固态电解液中也有研究人员尝试使用添加剂来提高锂硫电池电化学性能,但有机液态电解液添加剂种类则更为丰富。添加剂主要依赖所含官能团与极片反应形成SEI 膜保护极片,同时减少多硫化物穿梭效应。随着阴极极片的逐渐开发,研究人员也在尝试对不同极片、电解液针对性使用添加剂,通过协同作用提升电池的性能。
5 阳极
相比锂硫电池中阴极和电解液的广泛研究,针对锂硫电池阳极研究相对较少。对于锂硫软包电池来说,初始能量密度由整个电池中硫的质量决定,而容量保持率和使用寿命则依赖于锂金属阳极[105]。多硫化物的高比表面积可阻止锂枝晶生长,缓解死锂对锂硫电池的影响。但锂硫电池所产生的穿梭效应会使多硫化物迁移到阳极侧与锂金属反应产生难溶Li2S、Li2S2固体,导致容量不可逆的损失。在锂硫电池充电过程中,持续的氧化还原反应会导致库仑效率降低,阳极侧表面变得松散且不光滑,导致电化学性能下降。当采用软包电池评估电化学性能时,阳极作用更突出。因为硫负载面积大,同时需要匹配相应面积的阳极,当电流通过时会在锂金属表面生成大量多硫化锂。且电流一般不会均匀分布在阳极表面,会导致电流集中,死锂沉积以及电解液消耗[106]。活泼的锂金属使电解液可在锂表面被还原,形成SEI 膜,导致较大不可逆容量损失,降低沉积效率。
5.1 人工SEI 膜技术
现在对锂金属阳极保护主要集中在改善SEI膜性能,如上文提到的通过电解液添加剂以促进SEI 膜生成。除此之外,还可通过原位或非原位方法合成人工SEI 膜,有效阻止锂被电解液和多硫化物腐蚀并抑制锂枝晶生长[107]。理想的人造SEI 膜在锂硫电池循环过程中具有稳定的化学性质、优异的锂离子传导性,同时也应具有电子绝缘性,可以使锂离子通过SEI 膜扩散[108]。常见人造SEI 技术包括直接镀膜技术、喷涂或溅射镀膜技术和化学镀膜技术。
直接镀膜法是操作最简单,应用最广泛的人造SEI 膜技术。Liu 等[109]将Cu3N 纳米粒子和丁苯橡胶混合在四氢呋喃(THF)中制备出稳定的胶体溶液,采用液滴铸造法将胶体溶液涂在锂阳极表面制备SEI 膜,如图10 所示。Cu3N 和丁苯橡胶联合作用使SEI 膜具有很高的机械强度和柔韧性。Cu3N 与锂晶片接触后,生成了具有超高离子电导率的Li3N,使电池循环寿命提高40%。直接镀膜法虽然操作简单方便,但部分涂层牢固性差,容易脱落,并且锂金属的强还原性会破坏阳极保护层[22]。喷涂或溅射镀膜常使用磁控溅射和气流喷涂技术,在锂阳极表面产生雾化颗粒形成保护涂层。该技术可快速制备损伤小、纯度高、致密且均一的SEI 膜[110]。Fan 等[111]使用溅射镀膜技术将氟化锂镀在锂晶片表面构建规则保护膜。与纯锂极片相比,在氟化锂的保护下锂金属沉积更稳定,并且氟化锂的高表面能和低扩散能可有效抑制锂枝晶生长。通过调节氟化锂含量能改变人造SEI 膜厚度,以改善电导率和机械强度,提高锂硫电池循环稳定性。化学涂层技术是通过化学反应在锂表面形成保护涂层,包括化学气相沉积(CVD)、层组装等。通过引发剂和锂金属产生化学反应可以在锂阳极上生成不同保护膜。使用化学涂层技术制备保护膜更加稳定、柔软,也是目前人造SEI 膜的主要研究方向[112]。Yan等[113]利用六方氮化硼(h-BN)和石墨烯直接在铜金属集流体上进行气相沉积,形成的二维原子晶体层能有效阻止锂枝晶产生。由于BN 键能高,化学性质稳定,所制备SEI 膜界面很薄且具有高机械强度、化学性质稳定、柔韧性高的特点。铜金属表面生长的h-BN 薄膜中的亚纳米缺陷为锂离子沉积提供了良好通道,该材料所制备的锂硫电池经过电化学测试得到了97%的库仑效率和稳定的循环性能。
5.2 锂阳极复合技术
锂阳极复合技术是将锂与一种或几种材料结合形成复合阳极。常用的复合材料包括硅、碳和一些金属材料,可使锂硫电池阳极储存大量锂离子,并为其提供良好电子通道,实现高循环性能。由于碳材料具有良好的力学性能,因此常作为锂硫电池复合阳极材料[88]。Liu 等[114]设计了一种独特的复合结构,以3D 中空碳纤维(3D-HCF)作为容器来容纳锂金属。3D-HCF 质量轻且柔韧性强,具有较高表面活性,有利于改善锂硫电池的化学沉积,所制备的锂硫电池经历350 次充放电循环后仍可稳定工作。3D-HCF 为锂金属提供了足够空间,理论上能够容纳9.77 mg/cm2的锂,同时空间限域作用能有效抑制锂枝晶生长。除碳材料外,硅材料具有高理论储锂容量,也可作为阳极复合材料,被认为是最有前途的锂阳极复合材料。Lee 等[115]设计了一种锂化Si/SiOx纳米球阳极新型电池。传统的阴极被混合双型硫阴极替代,首次放电容量可达1000 mAh/g,并且在500 次充放电循环过后,容量保持率可达80%。
6 结论
多年来,锂电池在储能领域一直占据主导地位,锂硫电池作为一种高能量密度电池体系具有比容量高、生产成本低及环境友好等特点,在便携式电子设备储能应用中有巨大的发展潜力[116]。目前研究者致力于将锂硫电池应用于航空、电动汽车、固定房屋、国防和海洋环境等领域,尝试用锂硫电池取代锂离子电池。然而,锂硫电池中硫元素离子电导率低、多硫化物穿梭效应,以及锂枝晶生长等问题严重阻碍其商业化应用。锂金属储存也制约着锂硫电池的发展,无论是优化SEI 膜或是使用锂合金,批量生产锂硫电池同样应考虑成本所带来的影响。通过梳理近年来锂硫电池研究工作,笔者认为以下几个方面的研究将有效推动锂硫电池电化学性能提升:
(1)锂硫电池阴极侧反应机理复杂,在放电过程中伴随多硫化物解聚,使用液态电解液时会产生固-液-固相变化,而化学反应和电化学反应会使电压平台波动,影响锂硫电池的能量密度。随着大量碳基体材料和电解液的开发,锂硫电池研究方向将不仅限于硫的还原机理,如元素掺杂、SEI 膜形成和锂离子传输等机理都需要进行详细的研究。机理研究虽困难,但详细且透彻的机理却能为将来研究提供更多理论依据,有助于推动锂硫电池性能提升。先进的表征技术有助于发现和理解锂硫电池氧化还原反应中的电化学机制。可测试性技术(design for testability,DFT)是一种有效研究储能设备数值的工具,其建模目标是基于量子力学知识阐明多组分系统的电子结构。利用DFT 技术可指导电池的最优结构,并更好地了解缺陷形成。通过计算对锂硫电池的机理进行分析,并将其参数化验证所得结论是非常有效的,这些模型不仅提供有关电池的化学信息,也有助于设计针对性的实验;但仅凭模拟无法确定电池中涉及的大量变量,通常,理论计算和独立实验测试进行适当结合,会带来更令人信服的结果。
(2)阴极材料的研究主要集中在提高硫负载和元素掺杂,在抑制多硫化物穿梭效应、减少自放电和提升电池容量中有非常重要的价值。高硫负载对于实现锂硫电池商业化应用很关键,使用分级多孔碳纳米材料可以有效限制多硫化物的穿梭效应,改变不同孔径碳基体的比例也可以对锂硫电池性能进行调整,为活性物质负载提供足够空间。元素掺杂能局部改变阴极材料微观结构,通过官能团和多硫化物结合达到吸附效果,合适的掺杂比例可以实现两种或多种元素的功能协同,强化吸附效果同时激活沉积在碳基体上的固态硫化锂。
(3)合适的电解液配方能增加离子电导率、提高化学稳定性。液态电解液成本低,易制备,是目前应用最广泛使用的电解液。电解液添加剂应用于液态电解液有助于形成SEI 膜,能对阳极提供较好的保护。固态电解液安全性更好、适用范围更大、能力密度更高,能有效解决锂硫电池穿梭效应,有替代液态电解液的趋势。对于固态锂硫电池来说,最重要的是如何在电极和固态电解质之间建立良好的离子界面。此外,硫阴极的体积变化和锂金属枝晶形成会影响固态锂硫电池界面性能。在阴极侧,关键是要尽量减小硫的粒径,将硫均匀分散到导电基体中,确保硫与固态电解质充分接触,降低固态锂硫电池的界面阻抗。通过进行如下工作,笔者认为可以克服固态锂硫电池界面挑战的问题:1)通过实验和理论计算方法从根本上理解阴极/固态电解质的界面行为;2) 开发合适的材料合成和工艺技术,能够精确调整硫、导电基质和固体电解质的界面结构。
(4)锂硫电池中锂阳极在充放电循环中极易产生锂枝晶,沉积后产生的死锂对电池使用寿命和容量保持率有着较大影响。阳极保护主要针对SEI 膜的形成,使用人工SEI 膜技术能有效阻止锂被多硫化物和电解液腐蚀,同时抑制锂枝晶生长。锂阳极复合技术对提升锂硫电池库仑效率有很大的帮助,组合改性法对锂阳极的发展有巨大的帮助。近年来,锂硫电池中涉及阴极材料和电解质出版物数量远高于阳极,因为锂金属的研发条件相对苛刻,需尽量保证在无水无氧的环境下进行电池组装或改性研究。尽管硅、锡和碳材料替代锂阳极也在持续研究,但对相应的阴极有特殊要求,这使得锂阳极成为主要选择。寿命长且高效的锂金属阳极依然面临很多挑战。在了解SEI 膜的重要性后需要深入研究富含多硫化锂环境中,SEI 膜的形成和锂离子去溶剂化机制的基本认识。对于高能量密度锂硫电池,锂金属的质量应与阴极中硫的质量适当匹配,过量的锂会降低电池的能量密度。除了高温熔融锂和电化学预锂化之外,获得3D 主体复合锂金属阳极有效方法仍然很少见。因此,开发合成复合阳极的新型策略非常必要。
总体而言,锂硫电池商业可用性需要进一步的科学技术发展和更多研究,重点放在其整体设计上。性能令人满意且可靠的锂硫电池需要不断优化硫阴极、锂阳极和电解液,以满足市场需求。此外,需要简单、可持续和可扩展的锂硫电池组件制造方法,因为成本效益对于工业规模生产非常重要。相信锂硫电池技术在不久的将来可以应用于交通运输和大规模电网储能。

