胡桃醌对胃癌SGC-7901细胞增殖、侵袭和糖酵解的影响
俞萍萍,金晓昇
(1浙江中医药大学·浙江 杭州 310000;2中国科学院大学宁波华美医院·浙江 宁波 315010;3中国科学院大学宁波生命与健康产业研究院·浙江 宁波 315010;4瑞安市人民医院消化内科·浙江 瑞安 325200)
胃癌是常见的恶性肿瘤之一,多数患者发现时已为晚期,其死亡率较高[1]。目前手术联合放化疗仍然是治疗胃癌的重要手段,但其容易复发,同时会引起一系列并发症。转移和侵袭是恶性胃癌细胞的主要特征,也是导致其高死亡率的重要原因[2]。肿瘤细胞的糖酵解代谢模式为肿瘤的主要特征之一,与肿瘤的多种恶性生物学表征密切相关[3]。胡桃醌(Juglone)是从胡桃科植物胡桃楸的未成熟外果皮、枝叶和树皮中分离出来的一种天然化合物,属于萘醌类化合物[4]。目前已有研究报道,胡桃醌具有抗菌、抗病毒以及抗肿瘤等药理作用[5],对人白血病细胞(HL-60)、人肝癌细胞(BEL-7402)和人肺癌细胞(A549)等均有显著的抑制作用[6-8]。然而,关于胡桃醌对胃癌细胞的迁移、侵袭和糖酵解的作用及机制尚不清楚。因此,本文以SGC-7901细胞为研究对象,探讨胡桃醌对胃癌细胞增殖、侵袭和糖酵解的作用,并进一步阐明其作用机制。
1 材料
1.1 细胞 人胃癌细胞SGC-7901购买于中国科学院上海细胞库。
1.2 实验药物与试剂 胡桃醌(98%):四川维克奇生物科技有限公司,批号:481-39-0。RPMI1640培养基、胎牛血清:美国Hyclone公司;四甲基亚唑蓝(MTT):美国Sigma公司;细胞周期检测试剂盒:杭州联科生物技术有限公司;葡萄糖、乳酸、ATP检测试剂盒:南京建成生物工程研究所;BCA蛋白浓度测定试剂盒:上海碧云天公司;抗体(PKM2、GLUT1、LDHA、p-Akt、Akt、p-mTOR、mTOR、GAPDH):美国CST公司。
1.3 仪器 BB150型细胞培养箱:美国Thermo公司;LRH-150型生化培养箱:上海齐欣科学仪器有限公司;guava easyCyte流式细胞仪:美国Minipore公司;ERD-4C荧光倒置显微镜:北京世纪科信科学仪器有限公司;CMaxPlus酶标仪:美国MD公司;PowerPac Basic电泳仪:美国BIO-RAD公司;3300 Mini化学发光成像系统:中国CLinX公司。
2 实验方法
2.1 细胞培养与分组 SGC-7901细胞株培养于含10%胎牛血清的RPMI1640培养基中,置于37 ℃、5% CO2培养箱中培养。每2 d换液1次,待80%~90%融合后,以0.25%胰蛋白酶消化,按1∶3传代,置37 ℃、5% CO2培养箱内继续培养,取对数期细胞用于实验。实验分组:0 μmol·L-1、1 μmol·L-1、5 μmol·L-1、10 μmol·L-1。
2.2 MTT实验检测细胞存活率 收集对数期细胞,调整细胞密度为3 000个/孔,每孔100 μL加入到96孔板,置CO2培养箱培养。待细胞贴壁后加入胡桃醌溶液,其药液终浓度分别为0、1、5、10、20、40、80、100 μmol·L-1,用药组和对照组均设4个复孔继续培养24 h,每孔加入20 μL MTT溶液,培养箱中继续孵育4 h后每孔加入200 μL三联液,37 ℃恒温培养箱中作用18 h,用酶标仪在570 nm条件下测定吸光度OD值。重复实验3次,以平均值统计结果,计算各浓度下细胞相对存活率。
2.3 细胞克隆实验 取对数生长期的各组细胞,于6孔板培养板中各实验组接种500~1 000个细胞/孔,按照“2.1”的给药分组进行实验,给予药物处理。每个实验组设3个复孔,置细胞培养箱中培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养弃去上清液,加4%多聚甲醛固定细胞。弃固定液后加结晶紫染色液染2 min,然后用流水洗去染色液,干燥后拍照计数。最后计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
2.4 流式细胞术检测细胞周期 将状态良好的SGC-7901细胞以6×105/孔传代于6孔板中,待细胞贴壁之后,按照“2.1”分组给药,每组设置3个复孔,继续培养24 h后用PBS洗2遍,用胰酶消化后,用PBS重悬细胞,洗涤离心后立即加入70%的冰乙醇,保存在4 ℃过夜,细胞固定之后,将前一天的细胞悬液在离心机上离心,吸去用于固定的乙醇,再用冷的PBS洗涤细胞2 次,除去上清液,加入含有RNase的PI染液,避光室温染色30 min,流式细胞仪检测每组细胞中的荧光强度,独立实验重复3次。
2.5 细胞划痕实验 用marker笔在6孔板背面,均匀的划横线(利用直尺),约每隔0.5~1 cm一道,横穿过孔,每孔至少穿过3条线。往6 孔板每孔加入约5×105个细胞,培养过夜,待细胞铺满整孔,第2天用枪头比着直尺,尽量垂至于背后的横线划痕,用PBS洗细胞3次,弃去划下的细胞,加入无血清培养基,根据分组情况调整药物浓度。放入培养箱培养。在0 h、24 h取样,拍照。
2.6 细胞侵袭实验 将无血清培养基500 μL,水化基底膜10 min,上室加入200 μL浓度为2×104个/mL的细胞悬液,下室加入含药物的无血清培养基,将细胞置于37 ℃,5% CO2及饱和湿度的细胞培养箱中孵育24 h。从培养箱中取出小室,弃去上室液体,用甲醇固定5 min,PBS洗3次,用苏木素和尹红各染5 min,自来水冲洗,冲去残余的染料。用棉签擦去上室内的细胞,Transwell小室反过来底朝上在正置显微镜下观察,拍照,计数视野内的细胞数,即细胞从小室上室穿越Matrigel胶和聚碳酯膜的细胞侵袭数。
2.7 ELISA法检测糖酵解水平 将状态良好的SGC-7901细胞以8×105/孔传代于6 cm培养皿中,待细胞贴壁之后,按照分组的情况加入含有不同浓度胡桃醌的完全培养基,作用24 h后收集细胞进行实验,8 000 r/min离心10 min,收集上清,经0.22μm微孔滤膜过滤,滤过液-20 ℃保存备用。按照葡萄糖检测试剂盒、乳酸检测试剂盒、ATP检测试剂盒说明书要求检测细胞中葡萄糖的摄取、乳酸的生成及ATP的水平。
2.8 Western blot检测相关蛋白 将状态良好的SGC-7901细胞以8×105/孔传代于6 cm培养皿中,待细胞贴壁之后,按照分组情况加入含有不同浓度胡桃醌的完全培养基,作用24 h后加入裂解液,冰上裂解30 min后,收集裂解后的细胞液,离心(12 000 r/min)取上清,采用BCA试剂盒测定蛋白浓度后,处理蛋白随后上样。用SDS-PAGE分离总蛋白,随后用湿转法转移至PVDF膜上,加入一抗(PKM2、GLUT1、LDHA、p-Akt、Akt、p-mTOR、mTOR、GAPDH)4 ℃过夜,用PBST洗3次,每次在水平摇床上摇5 min,再加入相应的二抗,二抗室温孵育2 h后,用ECL显色液显影,在3300 Mini化学发光成像系统下拍照,记录实验结果。
3 结果
3.1 胡桃醌对SGC-7901细胞增殖的影响 MTT结果显示胡桃醌能够剂量依赖性地抑制SGC-7901细胞的增殖,IC50为26.33 μmol·L-1,见图1。与空白对照组相比,各加药组的细胞克隆能力显著下降,表现出剂量依赖性,且差异均有统计学意义(P<0.05或 0.01)。见表1。

图1 胡桃醌作用下SGC-7901细胞成活率
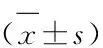
表1 胡桃醌作用下SGC-7901细胞克隆数量
3.2 胡桃醌对SGC-7901细胞周期的影响 与空白对照组比较,不同胡桃醌给药浓度组细胞S期细胞比例呈现浓度依赖性减少,其中5 μmol·L-1组和10 μmol·L-1组差异有统计学意义(P<0.05或P<0.01)。与空白对照组比较,不同胡桃醌给药浓度组细胞G0/G1期细胞比例呈现一定程度增加,其中5 μmol·L-1组和10 μmol·L-1组差异有统计学意义(P<0.05或P<0.01)。见图2。

注:与0 μmol·L-1组比较,*P<0.05,**P<0.01图2 胡桃醌对SGC-7901细胞周期的影响
3.3 胡桃醌对SGC-7901细胞迁移和侵袭的影响 与对照组比较,不同胡桃醌给药浓度组细胞迁移率和侵袭个数呈现剂量依赖性下降,其中5 μmol·L-1组和10 μmol·L-1组差异有统计学意义(P<0.05或 0.01)。表明胡桃醌能够有效抑制SGC-7901细胞迁移和侵袭。见图3,图4。

注:与0 μmol·L-1组比较,*P<0.05,**P<0.01图3 胡桃醌对SGC-7901细胞迁移的影响(细胞划痕实验)

注:与0 μmol·L-1组比较,*P<0.05,**P<0.01图4 胡桃醌对SGC-7901细胞侵袭的影响(Transwell侵袭实验)
3.4 胡桃醌对SGC-7901细胞糖酵解的影响 与对照组比较,不同胡桃醌给药浓度组细胞葡萄糖摄取量、乳酸生成量、ATP量呈现浓度依赖性下降,其中5 μmol·L-1组和10 μmol·L-1组的乳酸生成量、ATP量差异有统计学意义(P<0.05或0.01),各组葡萄糖摄取量均有统计学意义(P<0.05或0.01);见表2。与对照组相比,胡桃醌各加药组能够剂量依赖性地降低PKM2、GLUT1和LDHA的表达量,其中5 μmol·L-1组和10 μmol·L-1组表现出显著性差异(P<0.05或0.01)。见图5。

注:与0 μmol·L-1组比较,*P<0.05,**P<0.01图5 胡桃醌对SGC-7901细胞糖酵解相关蛋白表达的影响
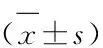
表2 胡桃醌对SGC-7901细胞葡萄糖摄取量、乳酸生成量、ATP量的影响
3.5 胡桃醌对SGC-7901细胞Akt/mTOR信号通路的影响 与对照组相比,胡桃醌各加药组的p-Akt和p-mTOR表达水平逐渐降低,Akt与mTOR蛋白表达水平无显著性变化,统计结果显示5 μmol·L-1组和10 μmol·L-1组p-Akt/Akt显著降低(P<0.05),10 μmol·L-1组p-mTOR/mTOR显著降低(P<0.05)。见图6。

注:与0 μmol·L-1组比较,*P<0.05,**P<0.01图6 胡桃醌对SGC-7901细胞Akt/mTOR信号通路的影响
4 讨论
胡桃楸是我国传统的治疗癌症的中药,胡桃醌是从胡桃楸中提取的羟基萘醌类化合物,又名5-羟基-1,4-萘醌,是酶Pin1(肽基脯氨酰异构酶)的天然抑制剂和ROS的诱导剂[9-10]。有文献报道,胡桃醌具有良好的抗肿瘤活性,对各种类型的肿瘤均有一定的抑制作用,为今后研发抗肿瘤新药提供了重要线索[4]。已有学者指出胡桃醌能够通过ROS-p38通路诱导胶质母细胞瘤肿瘤干细胞样细胞凋亡[11],此外,胡桃醌还能够通过抑制AKT、ERK、NF-κB信号通路表达和下调Vimentin、MMP-2、MMP-9表达从而抑制人卵巢癌SKOV3和IOSE80细胞的增殖和侵袭[12]。为了探究胡桃醌对胃癌细胞的发生发展的作用,本研究以胃癌SGC-7901细胞为研究对象,从增殖、侵袭和糖酵解的角度探究胡桃醌对胃癌细胞的影响,并进一步阐明其作用机制。本文中MTT实验和细胞克隆实验结果表明,胡桃醌能够有效地抑制胃癌SGC-7901细胞增殖。另外,细胞周期实验结果显示,用胡桃醌干预后,SGC-7901细胞在G0/G1期的细胞比例显著增加,表明胡桃醌能够阻滞SGC-7901细胞于G0/G1期,进而导致SGC-7901细胞的增殖能力减弱,也预示着胡桃醌在治疗胃癌疾病中存在一定的价值。
细胞划痕实验证明,胡桃醌能够显著降低SGC-7901细胞的相对迁移率。transwell实验结果显示,胡桃醌干预后,细胞侵袭的数量明显减少;证实胡桃醌能够显著降低SGC-7901细胞的迁移、侵袭能力。
恶性胃癌细胞的扩散和侵袭很大程度上基于其对能量代谢的运用,主要为糖酵解反应[13]。糖酵解反应是维持恶性肿瘤细胞增殖、迁移、侵袭的关键,肿瘤细胞利用糖酵解反应,产生ATP维持线粒体呼吸,同时提供肿瘤细胞生物合成所需的蛋白质等,癌细胞对葡萄糖的吸收能力是正常细胞的10~15倍[14]。糖酵解会伴随乳酸的增加,造成肿瘤微环境呈酸性,从而导致细胞的不稳定性,有利于肿瘤细胞侵袭转移[15],因此,肿瘤细胞的葡萄糖摄取量、乳酸生成量以及ATP水平是反应糖酵解效应的重要指标。本研究结果显示,胡桃醌能够显著降低SGC-7901细胞的葡萄糖摄取量、乳酸生成量以及ATP水平。当糖酵解途径被激活时,二型丙酮酸激酶(PKM2)、葡萄糖转运蛋白1(GLUT1)以及乳酸脱氢酶A(LDHA)等糖酵解途径关键酶表达会显著升高[16]。PKM2是细胞葡萄糖代谢的关键限速酶,其参与细胞丙酮酸的生成,同时也能催化二磷酸腺苷转化为三磷酸腺苷即产生ATP;GLUT1表达水平通常与细胞的糖代谢速率有关,并且与葡萄糖跨细胞膜转运密切相关,上调GLUT1能促进细胞对葡萄糖摄取;LDHA是肿瘤微环境的调节者,在无氧糖酵解的最后一步发挥重要作用,肿瘤细胞中LDHA表达上调,增强糖酵解,促进ATP 和乳酸的产生。本研究结果显示,胡桃醌干预显著降低了SGC-7901细胞中PKM2、GLUT1和LDHA的表达,从蛋白层面验证了胡桃醌对SGC-7901细胞糖酵解的抑制作用。
AKT/mTOR信号传导通路具有抑制细胞凋亡、加快细胞周期运行、促进血管形成、促进肿瘤侵袭以及转移等功能,在恶性肿瘤的发生发展中发挥着重要的作用[17]。有研究显示AKT/mTOR信号通路与恶性肿瘤的糖酵解水平有关[18-19]。本研究结果显示,胡桃醌能够有效降低SGC-7901细胞中Akt和mTOR的磷酸化水平,表明胡桃醌能够抑制胃癌细胞AKT/mTOR信号通路的活性。
综上所述,本研究结果证明胡桃醌能够通过调节AKT/mTOR信号通路,抑制胃癌细胞增殖、侵袭和糖酵解,而胡桃醌的抗胃癌作用所涉及的其他机制仍需要更深入的研究。

