敌敌畏降解菌的筛选鉴定和降解能力研究
张荣,赵振华,白鹤,贾晓强
(1.天津大学 环境学院,天津 300350;2.天津大学 化工学院,天津 300350;3.天津华勘环保科技有限公司,天津 300170)
敌敌畏(DDVP)是一种高效的有机磷杀虫剂,2018年使用量达到了104t[1],严重污染环境[2]。三氯乙烯(TCE)是含氯污染物的代表物,其已被列入有毒有害水污染物名录[3]。
DDVP通过光催化化学降解[4]、化学水解[5]和微生物法降解[6]进行降解。目前能够对DDVP进行降解的细菌如铜绿假单胞菌、鞘氨醇单胞菌等[7-15],真菌有曲霉属、木霉属和酵母属等[16-18]。对TCE进行降解的有恶臭假单胞菌属[19-20]、伯克霍尔德氏菌属[21]。
本研究以DDVP为唯一碳源,从土壤中筛选出多株高效降解菌,研究其对DDVP降解特性和生长最适条件以及对TCE降解情况,对农药污染土壤的原位修复提供实验基础和理论依据。
1 实验部分
1.1 试剂与仪器
DDVP(有效成分含量77.5%);三氯乙烯由阿拉丁公司购得;细菌基因组提取试剂盒和琼脂糖凝胶试剂盒均购自博迈德生物技术有限公司;引物由擎科(北京)生物技术有限公司合成;其他试剂均为分析纯。
ME204精密天平;FE20K pH计;LDZX-75KBS立式压力蒸汽灭菌器;SW-CJ-2FD超净工作台;HNY-111B恒温培养振荡器;GC-430气相色谱仪;HT-TFG-01通风橱;UV-1200紫外分光光度计;Powercycler 96 PCR仪;DYY-6C电泳仪;LRH-150生化培养箱;DW-HW328超低温冰箱;ECLIPSE E200显微镜;H1650-W台式迷你离心机。
1.2 土壤样品采集
于天津市某农药厂污染地块采集农药污染土样,约100 g,用封口袋封装留存。
1.3 培养基
1.3.1 无机盐(MSM)培养基(g/L) NH4NO31,K2HPO41,KH2PO41,MgSO4·7H2O 0.2,NaCl 5,CaCl20.02,FeSO40.05,酵母粉0.02,pH=7.2。
1.3.2 LB培养基(g/L) 蛋白胨10,酵母粉5,NaCl 5。
1.3.3 YPD培养基(g/L) 酵母膏10,蛋白胨20,葡萄糖20。
1.3.4 MRS培养基(g/L) 蛋白胨10,牛肉膏10,酵母膏5,柠檬酸氢二铵2,葡萄糖20,吐温80 1(mL/L),Na2CO35,K2HPO42,MgSO40.58,MnSO40.25,pH=6.5。
1.3.5 富集驯化培养基 MSM培养基依次加10 g/L 土样+100,300,500 mg/L农药作为碳源,逐级驯化。
1.4 敌敌畏降解菌分离
参考贺赟[22]的方法,以敌敌畏为唯一碳源,利用菌种驯化、摇瓶富集的方式分离土壤中的降解菌株。具体步骤如下:①在250 mL锥形瓶中加入100 mL MSM液体培养基,并湿热灭菌。加入100 mg/L 的DDVP,再添加5 g土壤样品,于30 ℃,200 r/min摇床中培养10 d;②取步骤①中的培养液5 mL加入到200 mg/L DDVP的MSM液体培养基中,放于30 ℃,200 r/min摇床中培养10 d;③取步骤②中的培养液5 mL加入到300 mg/L DDVP的MSM液体培养基中,放于30 ℃,200 r/min摇床中培养10 d。
稀释涂布后,平板法筛选单菌株。取转接后经降解的菌液1 mL于1.5 mL移液管中,以10倍稀释法稀释成10-5、10-6、10-7、10-8、10-9涂平板,筛选单菌落划线培养[23]。
1.5 敌敌畏降解菌菌株鉴定
1.5.1 菌株形态学鉴定 分离得到的目标菌株划线在6种固体培养基平板上,以分离出单菌落,放入30 ℃恒温培养箱中培养,观察菌株生长情况及菌落形态、大小、颜色、边缘等菌落的基本特征。采用革兰氏染色法确定菌株革兰氏类型。扫描电子显微镜观察菌株显微结构。
1.5.2 16sRNA基因序列分析 利用细菌基因组DNA快速提取试剂盒提取目的菌株基因,以上述提取的基因组DNA为模板,使用16SrDNA通用上游引物27F和下游引物1492R, 27F:5′-AGAGTTTGATCCTGGCTCAG-3和1492R:5′-GGTTACCTTGTTACGACTT-3′扩增降解菌株的 16S rDNA 区域序列。经琼脂糖凝胶电泳验证,将PCR产物送往金唯智测序公司进行测序,测序结果使用NCBI数据库中的BLAST程序查找同源序列进行比对分析,确定种属。
1.6 敌敌畏降解菌生长条件探究
1.6.1 生长曲线测定 将筛选菌株按1%接种率接种于对应富集培养基中,摇瓶培养220 r/min,30 ℃ 恒温培养。初期每2~3 h取样测定OD600(即溶液在波长为 600 nm 处的吸光值),根据菌株生长情况不同,后期可根据具体情况调整测样间隔时间直至菌株生长到衰退期。
1.6.2 培养条件探究 最适温度的测定分5个水平,分别为20,25,30,37,40 ℃。每个水平做3个平行实验。利用分光光度计法测定菌浓。
1.6.3 生长pH条件优化 最适pH值的测定分5个水平,分别为5,6,7,8,9。每个水平做3个平行实验。利用分光光度计法测定菌浓。
1.7 DDVP降解率及其耐受能力测定
1.7.1 DDV农药提取及其分析 降解菌株在对应富集培养基中培养活化至对数生长期,离心,去上清,无菌MSM培养基洗涤菌体3次,并对菌体进行稀释,制成OD600在3左右的菌液,用等体积培养基悬浮菌体,4 ℃保存备用。
将菌液按照1% 的接种比例分别接种于含有DDVP 100,200,300,500,1 000 mg/L的无机盐基础培养液中(MSM,不含琼脂),摇瓶220 r/min,最适温度下培养7 d。取上述培养液15 mL,8 000 r/min离心,去除菌体,取上层清液10 mL,加人10 mL丙酮,剧烈振荡;再加入氯化钠至饱和,剧烈振荡1 min,室温下静置5 min,使水相与丙酮相分层。移出上层丙酮,过无水硫酸钠柱,收集流出的丙酮,留待气相色谱测定。
1.7.2 气相色谱测定条件 GC-430气相色谱仪,FID检测器:检测用色谱柱为Rxi-1HT(30 m × 0.32 mm × 0.25 μm)非极性色谱柱。方法:进口温度290 ℃,检测器温度300 ℃,载气为氮气(99.999%),流速1 mL/min不分流,进样1 μL。程序升温60 ℃ 保持1 min,以30 ℃/min升至130 ℃,再以5 ℃/min升至170 ℃,280 ℃保持2 min。采用色谱纯丙酮为溶剂,按峰面积定量。
底物的降解率计算:在每个样品中,包括对照组和实验组。在计算出底物残留峰面积的积分之后,底物降解速率公式如下:

式中,AF指的是残留底物的峰面积。
1.8 TCE降解率及其耐受能力测定
降解菌株的培养部分同1.7.1节,用正己烷萃取培养基中底物。每瓶萃取 2 次,萃取液取至50 mL 试管中,用有机系滤膜过滤,去掉细微杂质,将样品装入 1.5 mL 的干净的离心管中,置于-20 ℃ 保藏,待气相色谱测定。
气相色谱条件同1.7.2节,方法:进口温度250 ℃,检测器温度260 ℃,载气为氮气(99.999%),流速1 mL/min,分流比10∶1,进样1 μL。 程序升温40 ℃ 保持4 min,以20 ℃/min升至250 ℃。采用色谱纯正己烷为溶剂,按峰面积定量。
2 结果与讨论
2.1 DDVP降解菌分离
采用富集培养,逐级驯化,平板划线分离的方法,从长期受DDVP污染的土壤中分离筛选目的菌,在富集培养基上获得了5株DDVP降解菌株(图1A),命名为PD-1、PD-2、PD-3、PD-4、PD-5。对5株菌进行扫描电镜观察(图1B),菌落形态特征描述见表1。

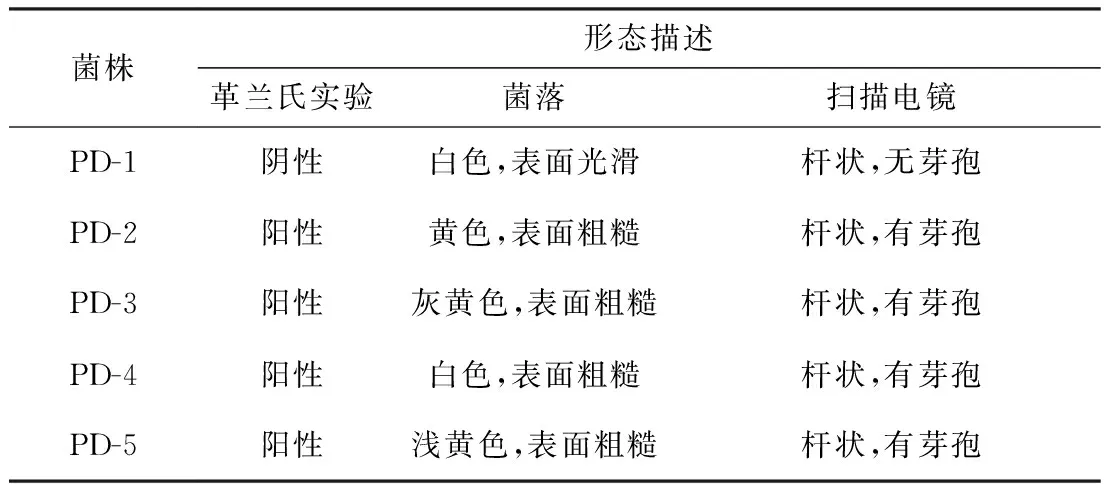
表1 菌落形态特征Table 1 Colony morphology
2.2 DDVP降解菌分子生物学鉴定
将各个菌种纯化后的PCR产物用DNA测序,获得的16SrDNA序列在NCBI中比对(表2)。

表2 16SrDNA比对结果Table 2 16SrDNA comparison result
2.3 环境因素对DDVP降解菌生长的影响
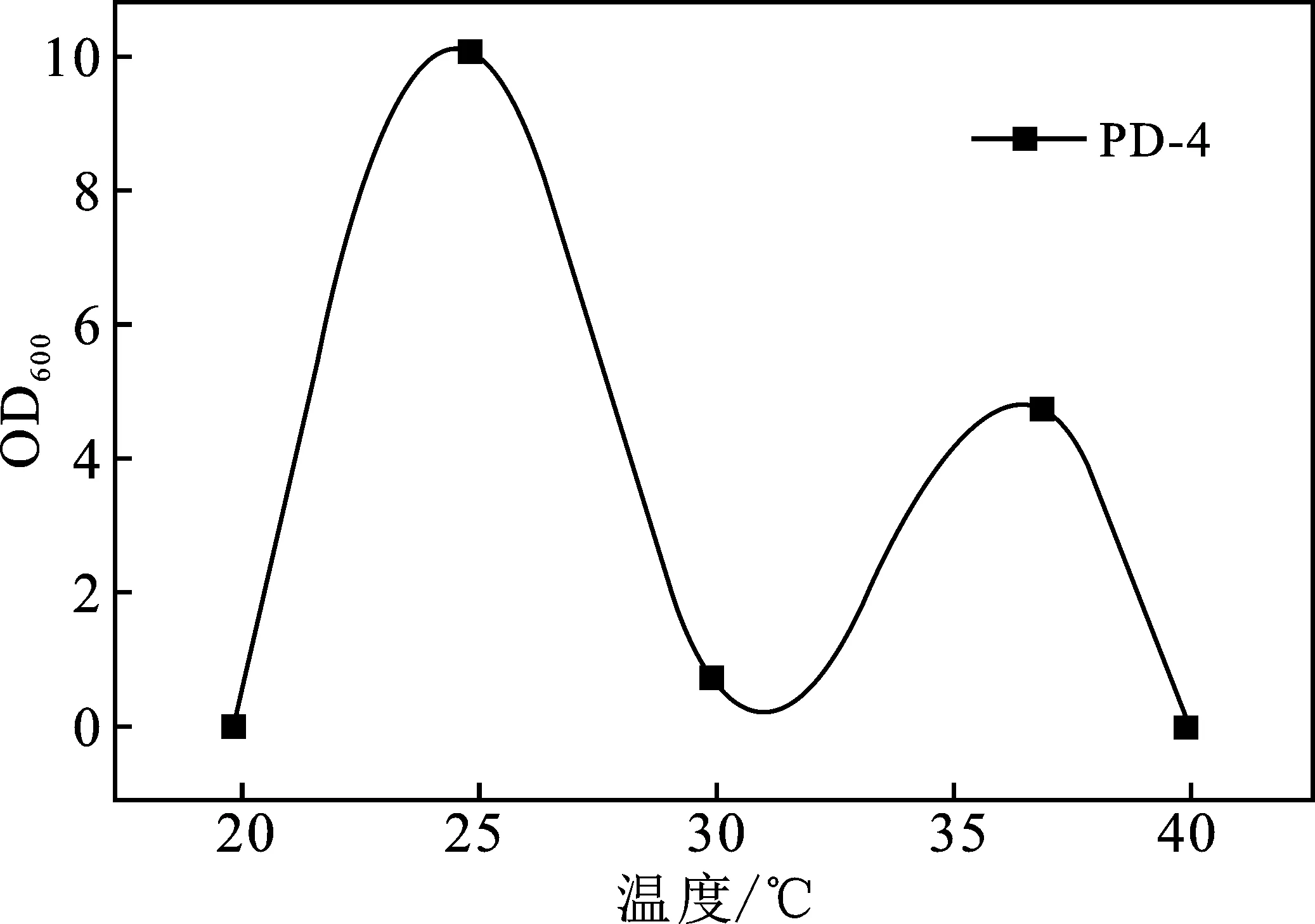
温度对5株菌生长的影响都较大,生长情况在10~40 ℃范围内呈现先增大后减小的趋势(图2A),检测培养24 h的OD600值,5株菌的最适温度分别为25,25,35,25,37 ℃。pH值4.0~9.0范围内,除PD-1外,其他菌株生长趋势均随pH增大而增大(图2B),5株菌的最适pH值分别为6,8,7,9,9。
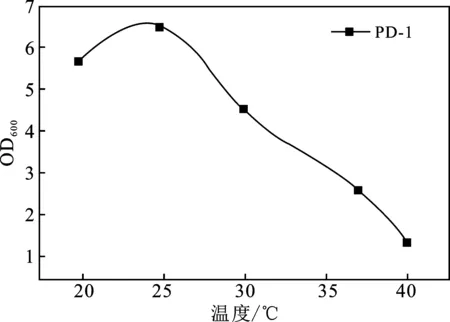
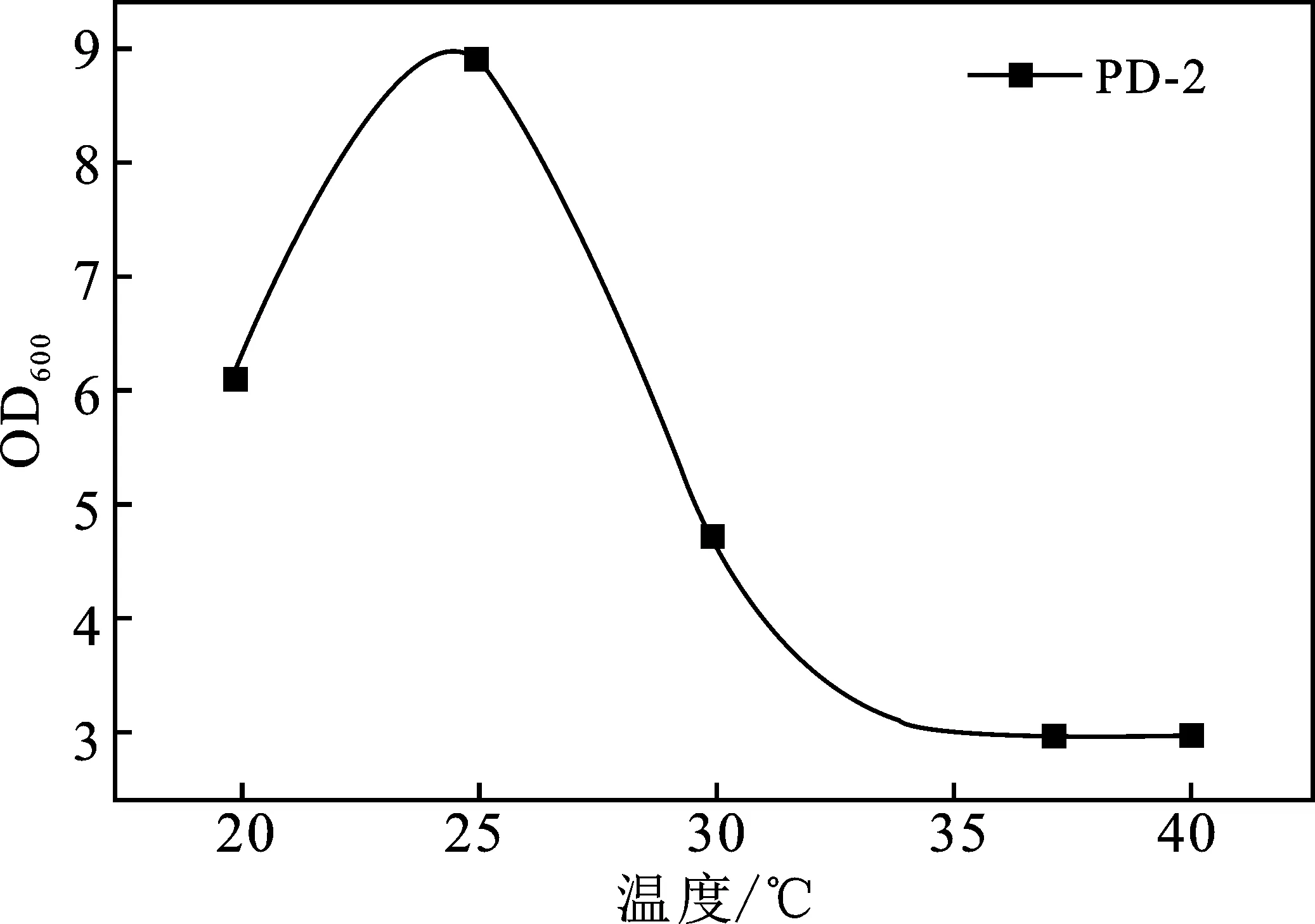
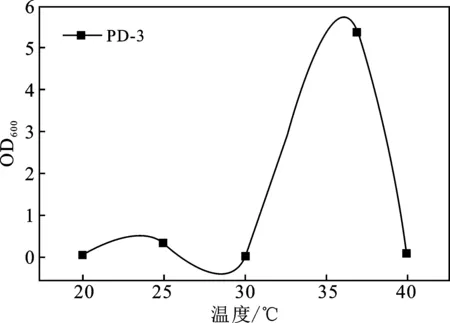
2.4 DDVP降解菌降解率及耐受情况分析
对5株菌进行7 d,5个浓度梯度的降解率测定结果见表3。
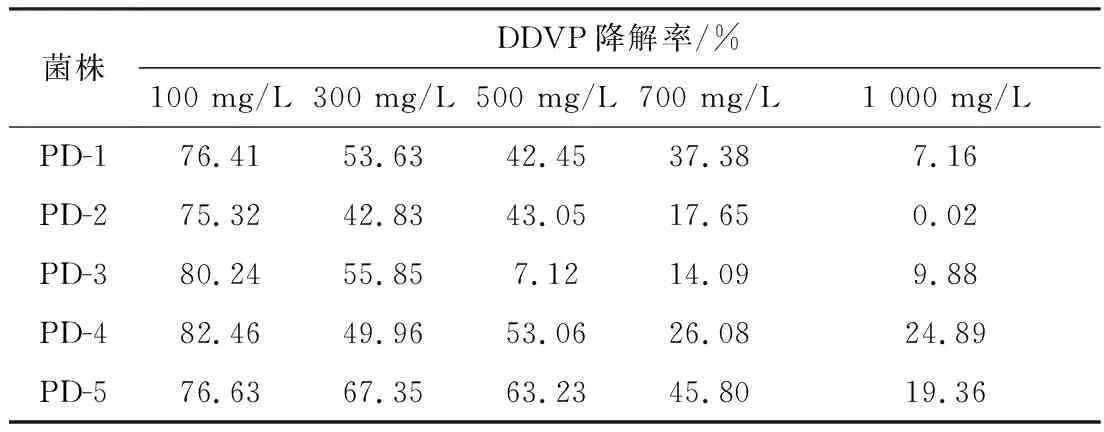
表3 DDVP降解率Table 3 Degradation rate of DDVP
由表3可知,5株菌在DDVP 含量100 mg/L下降解程度均超过75%,其中PD-3、PD-4降解率超过了80%,最高降解率为PD-4的82.46%。随着DDVP浓度的增加,降解率呈下降趋势,当DDVP含量达到1 000 mg/L时,PD-4降解率为24.89%。
对5株菌进行了TCE降解率测定,在TCE浓度100 mg/L,30 ℃条件下培养5 d,PD-1降解率达到53.57%。5株菌可耐受TCE浓度为500 mg/L。
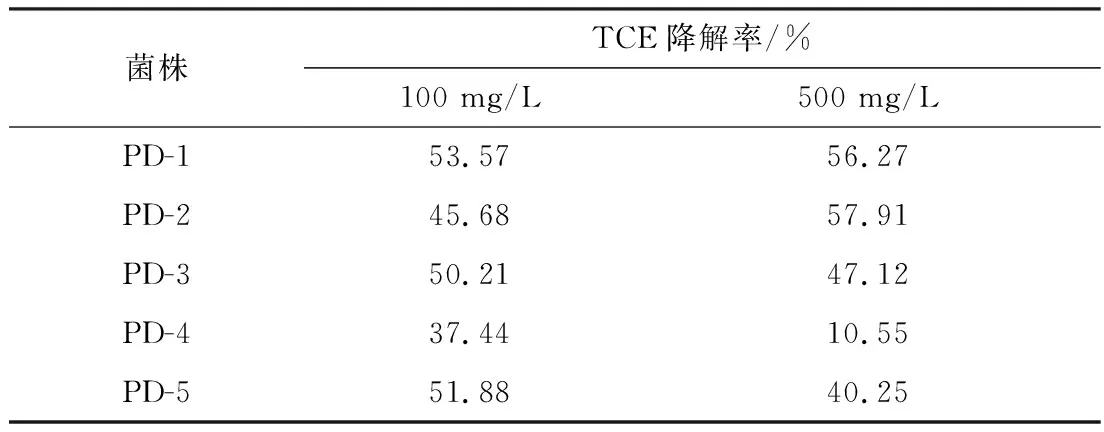
表4 TCE降解率Table 4 Degradation rate of TCE
2.5 讨论
以微生物修复手段为主的含磷农药污染降解技术是解决土壤农药残留的有效途径。文献中已经报道了很多能够降解或无害化农药残留的微生物,包括真菌、细菌、放线菌等,其中以细菌为主。蔡颖慧等[13,23]从污染土壤中分离得到甲基杆菌属DDW-1,在温度28 ℃,初始pH为7.0条件下,500 mg/L DDVP经 DDW-1菌株代谢3 d后,降解率达63.7%。杨瑞红等从南疆长期使用有机磷农药的梨园采集叶片,分离出DDVP降解菌假单孢菌属PP-Y1,在pH 6.5,培养7 d条件下DDVP降解率达53.4%。本研究从长期受农药污染土壤中筛选出了5株高效DDVP降解菌,经鉴定1株属于气单胞菌属,4株属于芽孢杆菌属,在DDVP 100 mg/L,装液量100 mL/250 mL,培养7 d条件下,降解率均超过75%,最高达到82.46%,比蔡颖慧和杨瑞红的研究都高。利用微生物降解DDVP潜力巨大,微生物不仅可以降解DDVP,还可以降解其他含磷污染物和其他含卤污染物,体现了微生物对环境的强大适应能力。
DDVP降解菌株的效率与环境因素的影响密切相关,温度、pH、DDVP浓度等因子均可以影响它们的降解率。DDVP浓度对降解率的影响相当大,当DDVP浓度<300 mg/L时, DDVP的增加,会促进菌株生长,当DDVP浓度>300 mg/L时,则抑制菌株生长,这与付文祥等[16]的研究基本相同。DDVP是一种复杂的有机物,一方面可以作为碳源被微生物利用,另一方面,由于DDVP具有一定的毒性,不能被微生物直接利用,当DDVP浓度较大时,会阻碍菌株生长,使生长量和降解率下降。
除含磷农药对土壤的污染外,以三氯乙烯为代表物的含氯污染物也会对农用土地产生污染。钱丽敏从高浓度三氯乙烯污染土壤中分离出一种丛毛单胞菌Comamonassp.以醋酸钠为共代谢基质,10 d对TCE降解率超过90%[24]。本文研究了5株菌对TCE的降解和耐受能力,结果表明5株菌能够有效降解和耐受TCE,说明在实际操作中能够适应复杂的污染环境,同时对多底物进行降解。
3 结论
(1)从长期受农药污染的土壤中筛选出了5株对DDVP有良好降解能力的菌株,确定其最适温度分别为25,25,35,25,37 ℃,最适pH值分别为6,8,7,9,9。
(2)5株菌表现出高效的DDVP降解能力。在DDVP 100 mg/L,装液量100 mL/250 mL,培养7 d条件下,降解率均超过75%,最高达到82.46%。随DDVP浓度的增大,降解效率不断降低,当DDVP浓度为1 g/L时,PD-4降解率为24.89%。
(3) 探究了5株菌对TCE的耐受能力,5株菌在TCE 100 mg/L,装液量100 mL/250 mL,培养5 d条件下,降解率最高为53.57%,并显示出对TCE良好的耐受能力。

