长期外用或系统应用糖皮质激素对小鼠代谢水平及器官的影响
陈利红潘 萌郑 捷徐牧迟
(上海交通大学医学院附属瑞金医院皮肤科,上海 200025)
糖皮质激素(glucocorticoid,GC)主要用于类风湿关节炎患者,具有很好的疗效,现阶段GC已经成为临床上最重要且应用最广泛而有效的一种治疗自身免疫性和炎症性疾病的药物。由于糖皮质激素在临床上广泛使用,2011年卫生部颁布《糖皮质激素药物临床应用指导原则》来规范糖皮质激素在各科各种疾病上的应用[1]。临床医生通常应根据疾病情况、患者条件等综合考虑风险/收益比来决定GC的使用时间、剂量、使用方法、药剂剂型和强度等,而不当用药会不同程度导致GC的副作用,给患者的健康甚至是生命带来重大影响。常见的不良反应有Cushing综合征,主要表现为肥胖、高血压、糖尿病和血脂异常等特征[2-4]。长期使用GC患者会对心血管系统、肝系统、骨骼系统、中枢神经系统和眼部疾病等产生一定的副作用[5-7]。有研究发现,长期大面积外用强效GC的副作用显著小于系统给药。对于以皮肤为主要受累器官的疾病,例如大疱性类天疱疮(一种主要累及老年人的严重的致死性自身免疫性水疱病[8]),大面积外用强效GC(0.05%丙酸卤米松软膏)导致的不良反应和死亡率也显著小于系统给药[9-10]。但长期大面积大量外用或系统应用GC导致的不良反应却未见详细报道。本文旨在探讨长期大面积大量外用或系统应用GC(外用、口服、皮下注射)对小鼠代谢水平和主要脏器的影响,为进一步指导临床合理利用GC治疗患者提供线索和依据。
1 材料和方法
1.1 实验动物
清洁级KM小鼠共60只,雄性,体重32~35 g,8周龄,购于北京维通利华实验动物技术有限公司[SCXK(京)2019-0009],常规饲养于上海交通大学医学院附属瑞金医院实验动物科学部[SYXK(沪)2018-0027],饲养温度20℃~24℃,相对湿度50%~60%,光照12 h明暗交替。研究经上海交通大学医学院附属瑞金医院伦理委员会审批(20180223)。所有实验程序遵循上海交通大学医学院瑞金医院实验动物保护和应用条例,饲养小鼠的过程中严格遵守3R原则并给予人道主义关怀。
1.2 主要试剂与仪器
0.05%卤米松乳膏(澳能)(香港澳美制药厂生产);醋酸泼尼松片(泼尼松,每片5 mg)(上海信宜制药厂生产);2 mg/mL地塞米松磷酸钠注射液(上海信宜制药厂生产);尿素软膏(上海市瑞金医院制剂科)。血糖检测仪及试纸(罗康全(Roche公司)活力型ACCU-CHEK Active);智能无创动物血压计(日本SOFTRON公司BP-98A型);旋转切片机(德国LAICA);光学显微镜(德国ZEISS);显微图像分析仪(SPOT software)。
1.3 实验方法
1.3.1 实验动物分组
将实验动物随机分成4组,分别为正常对照组(NC组),0.05%卤米松乳膏外用组(Halo组),泼尼松灌胃组(Pred组)和地塞米松皮下注射组(Dx组),每笼饲养5只小鼠。NC组和Halo组(外用GC组),实验前以及每两天小鼠背部30%体表面积用剃毛器除毛,NC组每只小鼠每天背部涂抹尿素软膏1 g,Halo组每只小鼠每天背部涂抹0.05%卤米松乳膏1 g。Pred组和Dx组为系统应用GC组,选用临床最常用的泼尼松片和地塞米松磷酸钠注射液。参考相关文献中大剂量给药法以及药物效价[11],根据人-小鼠体表面积换算公式[12],将人体使用糖皮质激素剂使用剂量换算为小鼠使用剂量(见表1)。Pred组将醋酸泼尼松片溶于0.9%氯化钠溶液,给予每只小鼠6 mg/(kg·d)灌胃给药,Dx组每只小鼠在大腿根部皮下注射0.9 mg/(kg·d)地塞米松磷酸钠注射液。

表1 人体与小鼠激素使用剂量换算Table 1 Dose conversion between human and mice
1.3.2 小鼠体重测量
每周用电子天平对小鼠称重并记录小鼠体重。
1.3.3 小鼠血压测量
在实验开始第0月、第3月和第6月用无创血压计检测小鼠心率(HR)、收缩压(SBP)、舒张压(DBP),并计算平均动脉压(MAP),计算公式为:MAP=(SBP+DBP ×2)/3。
1.3.4 小鼠空腹毛细血管血糖(FCBG)和口服糖耐量(OGTT)测量
分别在实验第0月、第3月和第6月,将小鼠禁食6 h后,在鼠尾取血测FCBG并记录。实验第3月和第6月给予葡萄糖2.0 g/kg灌胃,分别于灌胃前,灌胃后15 min、30 min、1 h和2 h分别割尾取血测定OGTT,并观察各组小鼠在给予葡萄糖后各时间点血糖曲线下面积(AUCg)的变化。血糖曲线下面积计算公式:AUCg(mmol/L·h)=(7.5 × 0 min血糖值+15 × 15 min血糖值+22.5 × 30 min血糖值+45 × 60 min血糖值+30 × 120 min血糖值)/60。
1.3.5 小鼠器官组织病理学检测
实验结束后解剖实验小鼠,采集心脏和肝组织各一块,将各组织标本用PBS溶液冲洗后经4%多聚甲醛固定,常规脱水,石蜡包埋,4 μm厚连续切片,苏木精-伊红染色(HE染色),送至上海交通大学医学院病理生理学教研室与上海交通大学附属瑞金医院病理科,分别在光学显微镜下观察组织病理变化。
1.4 统计学方法
所有的资料应用SPSS 21.0进行统计学分析,GraphPad Prism 6.0制图。所有计量资料平均数±标准差(±s)表示,比较两个计量资料运用t检验,两个以上的计量资料方差分析(One way ANOVA),并用LSD或Tamhane法依据方差齐性进行事后检验。P<0.05认为差异有统计学意义。
2 结果
2.1 小鼠体重的变化
各组小鼠平均体重在实验开始前未见明显差异。实验第1个月起,Pred组和Dx组与NC组相比差异有显著性(P< 0.05);随着时间的延长,在第3月与第6月Pred组和Dx组小鼠体重增长更明显,较NC组具有显著统计学意义(P<0.001);Pred组和Dx组之间,Halo组与NC之间比较无显著性差异(P>0.05),见表2。
表2 各组小鼠各时间点平均体重(±s,n=5)Table 2 Body weight of the mice in each group
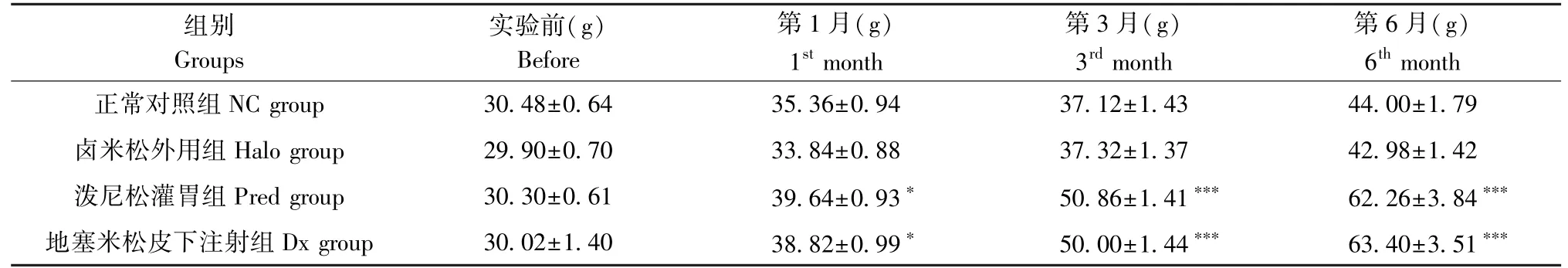
表2 各组小鼠各时间点平均体重(±s,n=5)Table 2 Body weight of the mice in each group
注:与正常对照组相比, *P<0.05,***P<0.001。Note. Compared with NC group, *P<0.05, ***P<0.001.
?
2.2 小鼠心率(HR)和平均动脉压(MAP)的变化
实验前各组之间HR无明显差异。实验第6月,Halo组、Pred组和Dx组的HR与同组用药前相比明显加快,差异具有显著性(P<0.05),其中Pred组最为显著(P<0.001),表明口服泼尼松对小鼠HR有明显刺激作用;NC组实验前后HR无显著差异(P>0.05),见表3。
表3 各组小鼠实验前和实验第6月HR变化(±s,n=5)Table 3 Heart rate before and at 6thmonth

表3 各组小鼠实验前和实验第6月HR变化(±s,n=5)Table 3 Heart rate before and at 6thmonth
注:与同组别实验前心率比较, *P<0.05,***P<0.001。Note. Compared with the HR of the same group before treatment, *P<0.05, ***P<0.001.
?
如表4,各组用药之前组间MAP均无明显差异。随着用药时间增长,实验第6个月时各组的MAP值均明显升高,与同组用药前的MAP 相比,具有统计学差异(P<0.05)。其中,Pred组MAP升高最为显著,与NC组和Halo组相比,差异也具有显著性(P<0.05);Dx组MAP值与Halo组相比也有显著差异(P<0.05)。
表4 各组小鼠实验前和实验第6月MAP变化(±s,n=5)Table 4 MAP before and at 6thmonth

表4 各组小鼠实验前和实验第6月MAP变化(±s,n=5)Table 4 MAP before and at 6thmonth
注:组内对比,与实验前MAP比较, *P<0.05;与正常对照组相比, #P<0.05;与卤米松外用组相比,ΔP<0.05,ΔΔP<0.01。Note. Compared with the MAP of the same group, *P<0.05. Compared with NC group, #P<0.05. Compared with Halo group,ΔP<0.05, ΔΔP<0.01.
?
2.3 小鼠FCBG的变化
由表5可见,实验前与实验第3月,各组小鼠间FCBG组间相比无统计学差异。实验第6个月,NC组、Halo组和Dx组小鼠FCBG均有不同程度下降,与实验前同组的FCBG对比,差异有统计学意义(NC组P<0.05,Halo组P<0.05,Dx组P<0.001),NC组和Dx组与同组第3个月FCBG对比,也具有差异显著性(NC组P=0.001,Dx组P<0.001)。而Pred组在实验第6个月时FCBG为(9.20±1.1692)mmol/L,与同组在实验前和实验第3月相比无明显差异(P>0.05),但与第6月的NC组、Halo组和Dx组的FCBG相比,Pred组的FCBG显著性升高(P<0.05),表明口服泼尼松可能具有升高血糖的作用。
表5 小鼠FCBG变化(±s,n=5)Table 5 Change of FCBG during the study
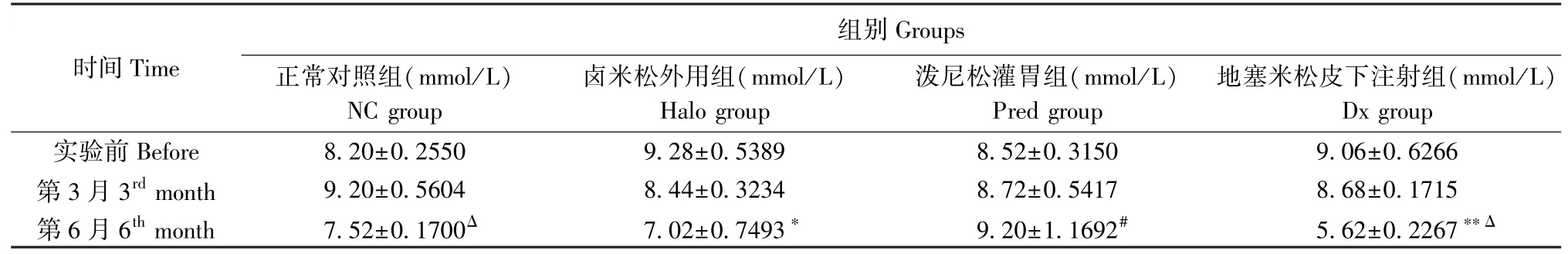
表5 小鼠FCBG变化(±s,n=5)Table 5 Change of FCBG during the study
注:与同组别实验前FCBG相比, *P<0.05, **P<0.01;与同组别第3月FCBG相比,ΔP<0.05;与正常对照组、卤米松外用组以及地塞米松皮下注射组第6月FCBG相比, #P <0.05。Note. Compared with the FCBG of the same group before the study, *P<0.05, **P<0.01. Compared with the FCBG of the same group at 3rd month,ΔP<0.05. Compared with the FBCG at 6th month with NC, Halo and Dx group, #P<0.05.
?
2.4 小鼠OGTT的变化和血糖曲线下面积(AUCg)
在实验前和实验第3月,OGTT各组之间的各个时间点无统计学差异,AUCg各组组间亦无统计学差异。实验第6月,Pred组在0 min与15 min血糖浓度与Halo组相比显著升高(P< 0.05),但与NC组以及Dx组相比无明显差异;在第30 min、60 min和120 min与其余3组相比小鼠血糖也无统计学差异,表明Pred组小鼠瞬时血糖升高较快。同时,Pred组AUCg最高,与Halo组相比有差异显著性(P<0.05),表明口服泼尼松后小鼠血糖清除能力降低,结果见表6。
表6 实验第6月小鼠OGTT以及AUCg(±s,n=5)Table 6 OGTT and AUCg of the mice at 6thmonth

表6 实验第6月小鼠OGTT以及AUCg(±s,n=5)Table 6 OGTT and AUCg of the mice at 6thmonth
注:与卤米松外用组相比, *P<0.05。Note. Compared with Halo group, *P<0.05.
?
2.5 心脏组织观察
通过HE染色结果显示,NC组心肌细胞形态正常,未见明显心肌损害;Halo组有5/10表现为轻度心壁内心肌细胞间脂肪浸润,个别心肌细胞小泡性脂肪变性;Pred组大部分出现轻度心肌间脂肪浸润(8/10),并且同时出现了轻度的细胞变性(8/10);Dx皮下注射组病理损伤程度最重,呈轻度至中度脂肪浸润与细胞变性,并有2张呈重度心壁内心肌细胞间脂肪浸润,部分片灶性脂肪浸润在心肌间质血管周围加强,结果见表7和图1。

表7 各组小鼠心肌的病理学分级(n=10,张)Table 7 Cardiomyocyte classification (pieces)
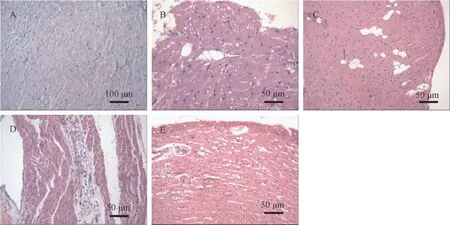
图1 各组小鼠心肌的病理照片(HE染色)Note. A, NC group. B, Halo group. C, Pred group. D/E, Dx group.Figure 1 Pathological photos of myocardium of mice in each group (HE staining)
2.6 肝组织观察
通过HE染色结果显示,NC组中可见少于一半的切片呈现轻度脂肪浸润;Halo组异常组织切片(6/10)可见弥漫性肝细胞小空泡变性,星形细胞轻度至中度肥大,显示脂肪增多;Pred组均可见轻至中度星形细胞肥大,脂肪浸润(10/10),并伴有多数点状坏死灶和炎性细胞浸润,其中有2只小鼠切片呈重度损伤,伴有小叶结构破坏;Dx组肝损伤程度与Pred组相似,亦有2张切片可见重度损害,其一甚至可见星形细胞弥漫性增生,累及全部肝组织,增生的星形细胞明显肥大,胞浆富含脂肪空泡,伴炎症细胞浸润,肝细胞多受压而萎缩,部分肝细胞也发生脂肪变性,肝小叶结构部分破坏,结果见图2。
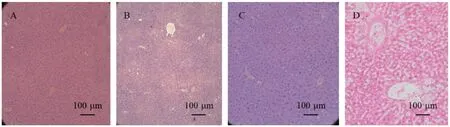
图2 各组小鼠肝病理照片(HE染色)Note. A, NC group. B, Halo group. C, Pred group. D, Dx group.Figure 2 Pathological photos of mice liver in each group (HE staining)
病理分级评分可见Halo组肝组织损伤轻微,与NC组相比无统计学差异;系统应用GC组肝组织呈现明显的细胞变性、脂肪浸润、细胞坏死、炎细胞浸润,与外用GC组相比,有统计学差异,表明系统应用GC组对小鼠肝的损伤大于外用GC组,且主要呈现脂肪代谢障碍以及炎症浸润等表现,结果见表8与表9。
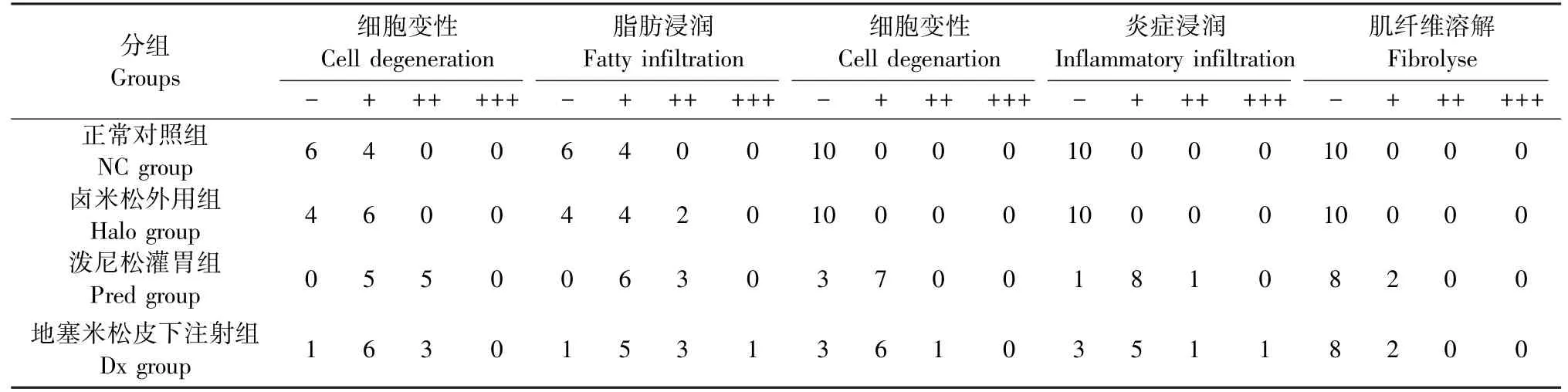
表8 各组小鼠肝的病理学分级(n=10,张)Table 8 Hepatic pathology classification (pieces)
表9 各组小鼠肝病理分级评分(±s,n=10)Table 9 Hepatic pathology grading score
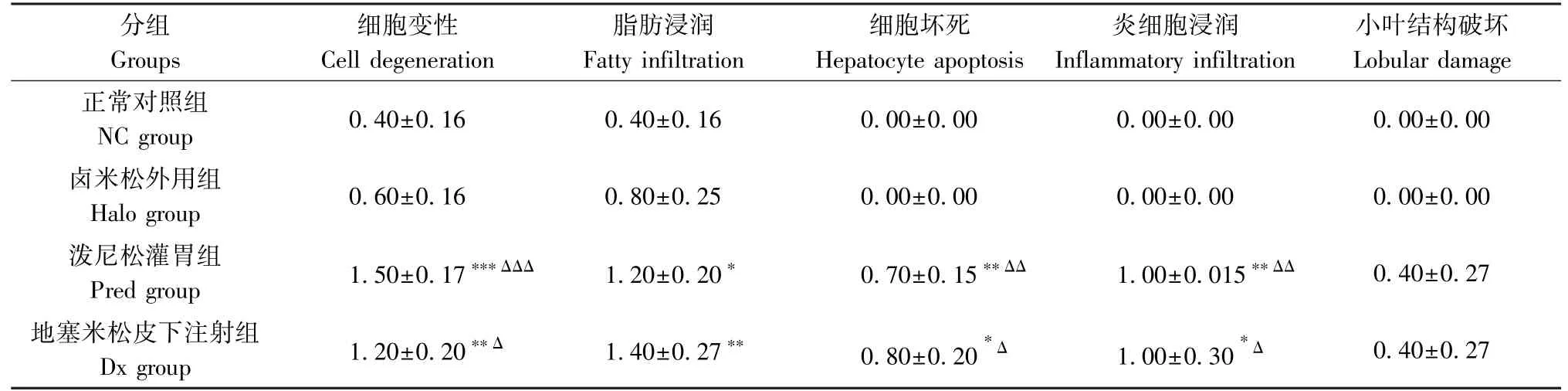
表9 各组小鼠肝病理分级评分(±s,n=10)Table 9 Hepatic pathology grading score
注:-:0分;+:1分;++:2分;+++:3分。与正常对照相比, *P<0.05, **P<0.01,***P< 0.001;与卤米松外用组相比,ΔP<0.05,ΔΔP<0.01,ΔΔΔP<0.001。Note.-, 0 point. +, 1 point. ++, 2 points. +++, 3 points. Compared with NC group, *P<0.05, **P<0.01, ***P<0.001.Compared with Halo group, ΔP<0.05, ΔΔP<0.01, ΔΔΔP<0.001.
?
3 讨论
对于外源性给予GC后小鼠体重的变化目前尚无定论,大多数报道倾向于口服GC诱发小鼠肥胖[13-14],而种植皮质酮缓释片或腹膜内注射GC可能导致小鼠体重下降[15-17]。本研究在第一月外用卤米松组小鼠体重较对照组更轻,与本课题组早前的实验结果相符,即外用卤米松有轻度的体重抑制作用[18],但到实验第6个月时外用卤米松组与对照组小鼠体重并无统计学差异,即长期外用卤米松对小鼠体重没有明显影响。本研究结果同时也表明系统用药组即泼尼松灌胃组和地塞米松皮下注射组较对照组小鼠体重有明显增长,同时两组系统用药组小鼠体重在各时间段相比没有差异。已有文献报道,口服GC 28 d小鼠体重增加加快[14,19],本实验结果与之相符的同时也证明,更长时间口服(6个月)GC的小鼠体重仍继续呈快速增长的趋势。此外,不同于通过腹膜内给药或皮下种植皮质醇缓释片给药后导致小鼠体重下降,本实验中地塞米松皮下注射组小鼠体重亦增长明显,这可能与给药方式相关。且本实验中给药浓度较其余已报道的研究实验更高,故可在后期实验中进一步探究不同剂量与不同给药方式对小鼠体重的影响。
对于长期外用或系统应用糖皮质激素对小鼠血压及心率的影响,已有研究报道大约20%长期使用外源性激素的患者出现了高血压[20],并且高血压的发病率与GC的使用剂量呈正相关[21]。还有研究指出GC与盐皮质激素有相似作用,能够结合肾脏盐皮质受体,加速水钠潴留进而升高血压[22]。与此相一致,本实验证明了长期外用或系统应用GC后小鼠平均动脉压均较用药前明显升高,系统用药组平均动脉压升高的差值百分比明显高于外用组,且具有显著统计学差异。本研究还对比了试验前后小鼠的心率,结果发现无论是长期外用还是系统应用糖皮质激素,都会导致小鼠心率明显加快,其中泼尼松灌胃组心率升高最为显著。
对于糖皮质激素对小鼠糖代谢水平的影响,最近一项Meta分析报道,对小鼠模型短期或长期系统给药甲强龙可以诱导小鼠肝糖类代谢功能异常[23]。还有研究表明使用GC治疗的患者得糖尿病的几率是正常人的2.23倍[24],给有糖尿病的患者使用GC会使血糖升高,给没有糖尿病的患者使用高剂量GC也很大可能会出现高血糖[25]。本研究结果证明,小鼠口服泼尼松具有升高血糖的作用,特别是口服药物后至15 min的时间血糖升高的作用非常显著;同时,口服泼尼松后血糖清除能力降低,这进一步导致血糖的升高,与其余3组的血糖水平相比具有显著的统计学差异。但是也有研究报道,短期和长期皮下注射地塞米松不会引起SD大鼠的血糖升高,反而会导致血糖的降低[18],这可能是由于地塞米松通过胰岛β细胞肥大和前体细胞的新生而增加胰岛β细胞体积,从而增加胰岛素分泌[26],维持血糖的平衡或者降低血糖。本实验结果与此相一致,皮下注射地塞米松组小鼠的血糖相比对照组也没有明显升高。由此可见,长期外用糖皮质激素对小鼠糖代谢没有明显影响,而长期系统应用糖皮质激素在可能会引起糖代谢异常,但需要针对特定的激素类药物进行针对性的分析与研究。
对于糖皮质激素对小鼠脏器的影响,报道发现一位先天性肾上腺皮质增生症的24岁女性患者,接受了为期12年的地塞米松治疗后,肝酶异常,肝活检病理切片发现有继发性脂肪肝病改变[27]。还有文献认为长期使用GC可以对心血管系统造成损害,会引起左心室肥大和纤维化等心室重构现象,导致收缩压升高、心率减缓、心室输出率降低等[26]。本研究对小鼠器官进行病理切片并检测,结果与上述研究结论相一致,长期外用或系统应用糖皮质激素会引起小鼠肝和心脏可见程度不同的损害,主要表现为脂肪浸润和细胞变性,其中外用GC组脏器损伤较轻,系统应用GC组脏器损伤较重,肝损伤主要表现为明显的细胞变性、脂肪浸润、细胞坏死、炎细胞浸润,特别是地塞米松皮下注射组还出现了肝小叶结构部分破坏;心脏损伤主要表现为心壁内心肌细胞间脂肪浸润,地塞米松皮下注射组部分片灶性脂肪浸润在心肌间质血管周围加强。小鼠心肌的损害主要涉及脂肪代谢,可能与小鼠代谢功能异常有关。部分切片可见心肌细胞变性,可能与血压和心率变化等心功能改变有关,但未见到心肌细胞肥大与纤维化等器质性变化。
综上所述,长期外用卤米松乳膏要比系统应用泼尼松和地塞米松对小鼠的代谢水平以及对心脏、肝的脏器损害副作用小,安全性高,而系统应用GC尤其是口服泼尼松对小鼠代谢水平的影响最大,会造成小鼠体重、心率、血压以及血糖代谢等水平紊乱,且对小鼠心脏、肝等器官损伤明显,主要表现是心脏和肝的脂质沉积病变。本研究结果为进一步指导临床合理利用糖皮质激素治疗患者提供线索和依据。

