水产品中5种磷脂含量的HPLC-ELSD检测分析
赵新楠,彭吉星,吴海燕,郑关超,郭萌萌,文艺晓,王联珠,谭志军*
(1.农业农村部水产品质量安全检测与评价重点实验室, 中国水产科学研究院黄海水产研究所,青岛 266071; 2.农业农村部水产品质量安全风险评估实验室, 青岛 266071)
磷脂不仅是生物细胞膜的重要组成成分,同时具有信号转导功能和生理代谢调节作用,水产品中富含活性不饱和脂肪酸,并且大都以磷脂的形式存在。由于磷脂具有防治心血管疾病,增强免疫力等生物功能特性,是相关水产品营养品质评价的重要指标[1]。目前磷脂的研究主要集中在大豆和蛋黄中的卵磷脂,水产品中磷脂的研究较少[2-9]。磷脂类化合物种类多,常见的磷脂有20余种,据文献报道[10-18]水产品磷脂主要有磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、溶血磷脂酰胆碱和鞘磷脂,其中磷脂酰胆碱(卵磷脂)和磷脂酰乙醇胺(脑磷脂)相对含量最高,以上5种磷脂占总磷脂含量的90%左右;牡蛎(Ostreagigastnunb)、鲑鱼(Oncorhynchus keta)、磷虾油、鱼子、蟹和海胆中5种磷脂占其总磷脂含量的95%以上;贝类、刺参(Apostichopusjaponicas)和海胆(Echinoidea)等虽含有磷脂酰丝氨酸(Phosphatidylserine,PS)和心磷脂(Cardiolipin,CL),但仅占磷脂总含量的5%以下(见表1)。因此,本研究中磷脂化合物的分析选择磷脂酰胆碱(Phosphatidylcholines,PC)、磷脂酰乙醇胺(Phosphatidylethanolamine,PE)、磷脂酰肌醇(Phosphatidylinositol,PI)、溶血磷脂酰胆碱(Lysophosphatidylcholine,LPC)和鞘磷脂(Sphingomyelin,SM)5种磷脂。
国内针对磷脂检测发布的相关标准有GB 5537—2008[19]、GB 5009.272—2016[20]、GB/T 35867—2018[21],以上国标方法主要用于植物油或从中提取的卵磷脂中磷脂的检测。GB/T 35867—2018和《中华人民共和国药典》(2015年版)[22]中磷脂的检测均用高效液相色谱-蒸发光散射检测(High performance liquid chromatography-Evaporative Light Scattering Detector,HPLC-ELSD)法,但其适用范围仅涉及到油脂类或药物用品中磷脂的检测,均未涉及水产品。国内常用的检测方法如比色法、分光光度法、电感耦合等离子体原子发射光谱法,只能测定总磷脂的含量,而且影响因素多,成分的准确性较差,无法对其关键成分进行定量分析检测,另外现有食品国标中的磷脂液相色谱检测方法检测范围不包括水产品及其制品,导致不能用于分析评价水产品及其制品磷脂的质量优劣。液相色谱是目前磷脂分离和定性定量分析中最常用的方法,紫外检测器和蒸发光散射检测器是常用检测器,其中,蒸发光散射检测器的响应信号独立于分子中的双键数目,对于紫外吸收弱的磷脂类物质更为准确灵敏,适用于不同来源磷脂的检测,是目前磷脂分析最常用的方法。
实验室前期优化建立了HPLC-ELSD测定南极磷虾(Euphausiasuperba)油中磷脂的方法[23],但是只涉及到磷脂酰胆碱、磷脂酰乙醇胺和溶血磷脂酰胆碱3种磷脂,且只分析了南极磷虾油样品。本研究在实验室前期研究基础上,进一步利用HPLC-ELSD检测不同水产品中5种磷脂的含量,为水产品营养品质评价提供支撑,对促进产业健康发展以及水产品高值化利用具有重要的意义和经济价值。
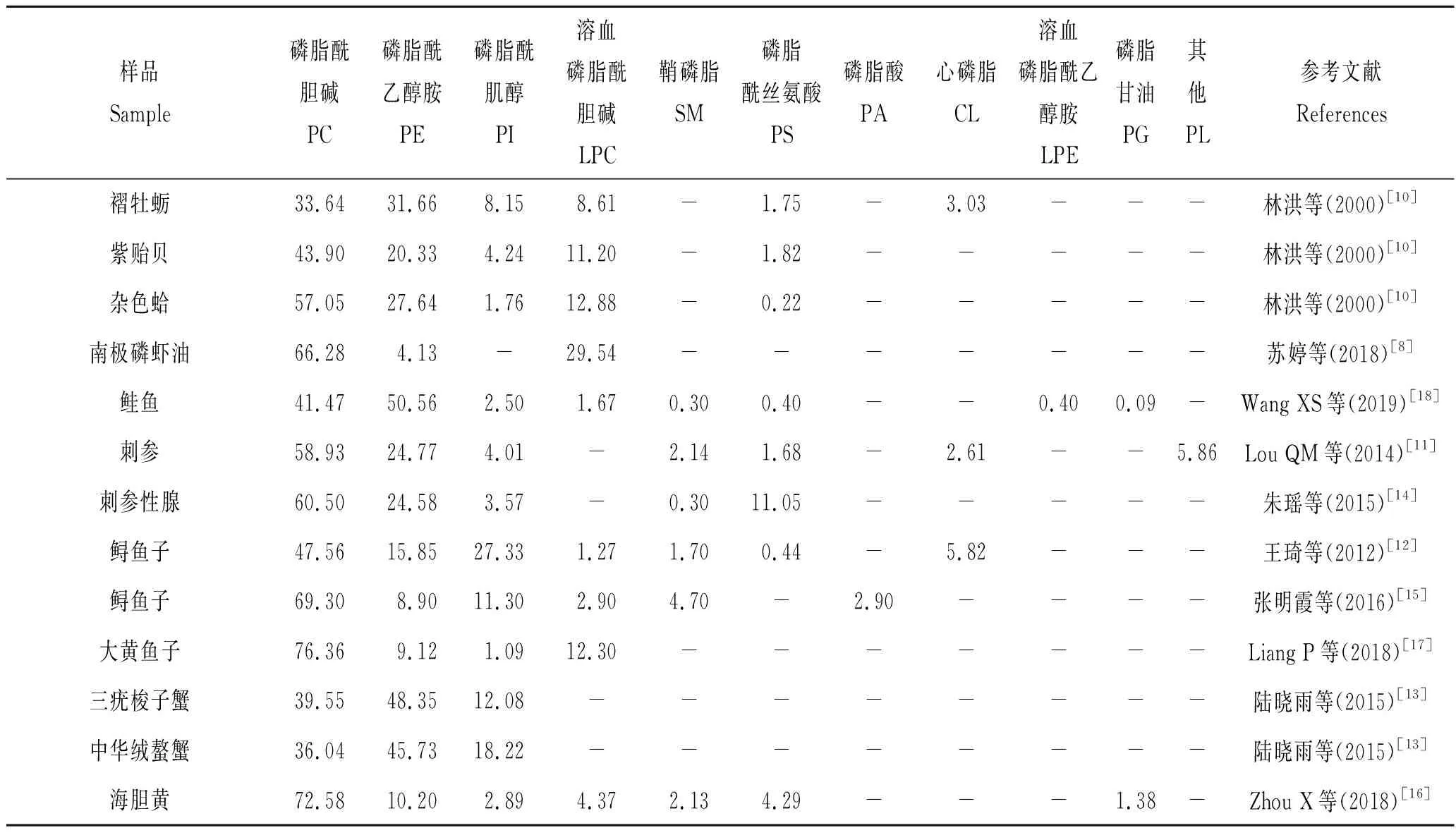
表1 不同水产品中磷脂含量比例Tab.1 The content ratio of phospholipids in different aquatic products
1 材料与方法
1.1 材料与仪器
乳山二倍体牡蛎于春季采自威海乳山海洋所镇南泓村海域;刺参于春季采自威海荣成东楮岛海域;磷虾粉来自青岛康境等磷虾粉加工企业;虹鳟(Oncorhynchusmykiss)、螃蟹、海参性腺、海胆酱、鲟鱼子,购自青岛某超市。磷脂酰胆碱(CAS:8002- 43-5,PC)、磷脂酰乙醇胺(CAS:39382-08-6,PE)、磷脂酰肌醇(CAS:383907-33-3,PI)、溶血磷脂酰胆碱(CAS:9008-30-4,LPC)、鞘磷脂(CAS:85187-10-6,SM),均购于sigma公司,纯度≥98%。盐酸(优级纯),购自国药集团化学试剂有限公司;氯仿、乙醚、丙酮,乙酸均为色谱级,购自美国默克公司;甲醇、异丙醇、正己烷均为色谱级,购自赛默飞世尔科技公司。
N-EVAP-24氮吹仪(Organomation公司);IKA涡旋振荡器(德国艾卡公司);KQ-600DE超声清洗机(昆山舒美公司);sigma 4-88离心机(sigma公司);CPA 1003P天平(美国赛多利斯公司);1 000 mg/6 mL氨基固相萃取柱(Waters公司);Chromolith Performance-Si(100 mm×4.6 mm)硅胶整体柱(Merck公司);Waters 2695高效液相色谱仪(Waters公司);Waters 2424蒸发光散射检测器(Waters公司)。
1.2 试验方法
1.2.1 样品处理
称取适量水产品样品(牡蛎、刺参冻干粉样品0.200 g;磷虾粉样品0.100 g;虹鳟、海胆黄、蟹黄、鲟鱼子、海参性腺鲜样2.00 g)置于50.0 mL离心管中,加入15 mL氯仿∶甲醇(2∶1,V/V)溶液,超声提取30 min,4 000 r/min离心5 min,收集上清液,对残渣重复上述操作2次,合并上清液至分液漏斗中,加入10.0 mL 0.9%氯化钠溶液,振荡摇匀后静置,收集下层氯仿,氯仿加入适量无水硫酸钠脱水过滤后于30 ℃氮吹至近干,得到粗磷脂提取物。
采用氨基固相萃取柱完成磷脂的净化,将粗磷脂提取物置于10.0 mL玻璃试管中,加入2.00 mL氯仿溶解样品。氨基固相萃取柱先用5.00 mL氯仿活化,将溶解的试样移入氨基固相萃取柱中,依次用10.0 mL 氯仿-异丙醇(2∶1,V/V)溶液和10.0 mL乙醚-乙酸(72∶1,V/V)溶液淋洗小柱,再依次用10.0 mL甲醇和10.0 mL甲醇-氯仿-2%盐酸水(100∶200∶1,V/V/V)溶液洗脱,合并洗脱液;在30 ℃下氮吹至近干,加入适量正己烷-异丙醇(2∶3,V/V)溶液溶解试样并定容至10.0 mL,取1.00 mL过0.45 μm尼龙滤膜后上机检测分析。
1.2.2 色谱条件
色谱条件参考文艺晓等[23]的研究,柱温:30 ℃;流速:1.5 mL/min;载气压力:50 psi;漂移管温度:65 ℃,喷雾器:加热模式75%;流动相:A为正己烷-三乙胺(2 500∶1,V/V)溶液,B为丙醇,C为13%乙酸溶液;梯度洗脱程序见表2。

表2 流动相梯度洗脱程序Tab.2 Gradient elution program of mobile phases
1.3 标准溶液配制及标准曲线
分别准确称取30.0 mg磷脂酰胆碱、20.0 mg溶血磷脂酰胆碱、10.0 mg磷脂酰乙醇胺、10.0 mg磷脂酰肌醇和10.0 mg鞘磷脂,用正己烷-异丙醇(2∶3,V/V)溶液溶解定容至10.0 mL作为标准储备液。取适量标准储备溶液用正己烷-异丙醇(2∶3,V/V)溶液稀释配制系列标准工作溶液。将标准系列工作液分别注入液相色谱仪,如图1所示,混合标准工作液中的5种磷脂可以达到很好地分离效果,而且基线平稳、干扰少,能在15 min内完成一次分析。以系列标准溶液中各磷脂质量浓度对数值作横坐标,以相应色谱峰峰面积对数值作纵坐标,标准曲线见表2。根据蒸发光散射检测原理y=axb,其中y指峰面积;x指磷脂标准溶液质量浓度(mg/L);a、b与蒸发温度、流动相性质等条件有关的常数,由于y和x为非线性关系,因此对等式两边取对数,则线性标准曲线方程为lgy=blgx+lga。
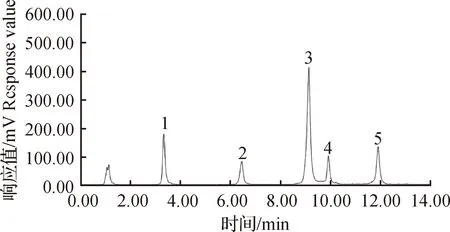
图1 5种磷脂混合标准溶液的液相色谱图(1-PE;2-PI;3-PC;4-SM;5-LPC)Fig.1 Liquid chromatogram of 5 kinds of phospholipid mixed standard solution(1-PE;2-PI;3-PC;4-SM;5-LPC)
1.4 试样测定与数据处理
取试样溶液注入液相色谱仪中,按相同色谱条件进行测定,记录色谱峰的保留时间和峰面积,外标法定量。试样溶液中各磷脂的响应值应在标准曲线范围内,超出范围的试样溶液可适当稀释后再进行测定。

表3 磷脂标准曲线及R2值Tab.3 Standard curve and R2 value of phospholipids
2 结果与讨论
2.1 不同来源标准品对结果影响
磷脂按照来源,可分为动物来源、植物来源和微生物来源,动物性来源的磷脂主要来自蛋黄、脑部组织、肝脏及水产动物等,水产动物尤其是海洋动物含有丰富的二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)。磷脂标准品分为植物来源(大豆)和动物来源(PI为牛肝脏来源,PC、PE、LPC、SM为鸡蛋黄来源)2种不同生物来源,如图2所示,不同来源标准品的响应值(峰面积)不同,经对比分析,同浓度的大豆来源磷脂标准品色谱峰面积大于动物来源标准品(比值在1.11~1.36之间),影响样品定量结果。由于动物来源磷脂中脂肪酸碳链长度和不饱和脂肪酸种类及占比与水产品中磷脂更接近,因此宜选用动物性来源标准品。
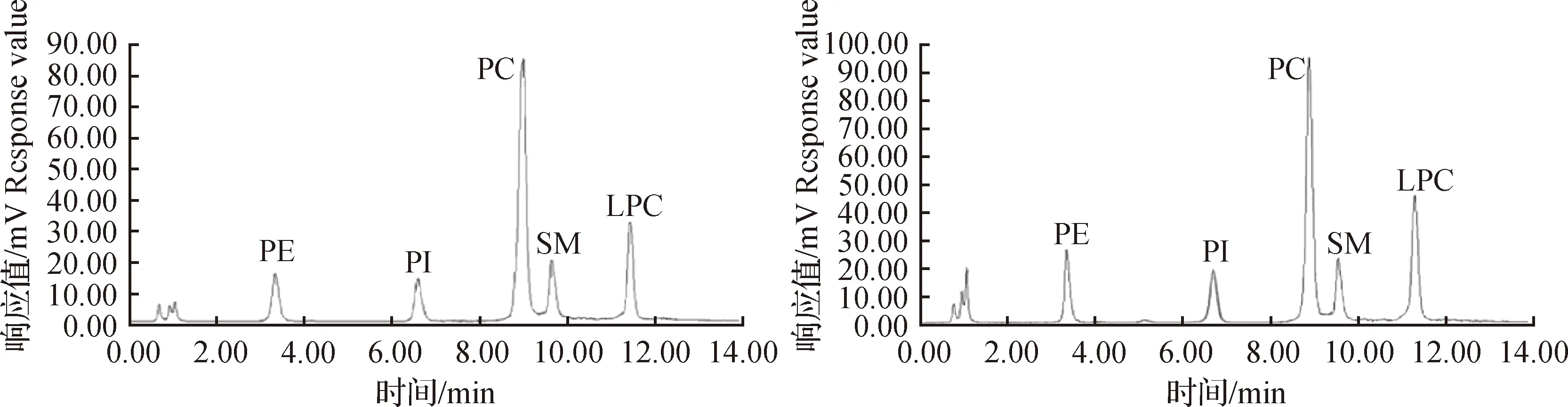
图2 5种磷脂混合标准溶液的液相色谱图(左图:大豆来源;右图:动物来源)Fig.2 Liquid chromatogram of 5 kinds of phospholipid mixed standard solution (Left: soybean source; Right: animal source)
2.2 提取、净化条件优化
采用A:氯仿-甲醇(2∶1,V/V)、B:氯仿-甲醇(1∶2,V/V)、C:二氯甲烷-甲醇(2∶1,V/V)、D:95%乙醇、E:乙醇-丙酮(1∶1,V/V)、F:正己烷、G:正己烷-乙酸乙酯(7∶3,V/V)7种有机溶剂或混合溶液提取南极磷虾粉中的磷虾油,比较不同提取溶剂对南极磷虾油得率及磷脂含量的影响。由图3可知,采用95%乙醇溶液和氯仿-甲醇(2∶1,V/V)提取得到的南极磷虾油得率最高,正己烷提取的南极磷虾油得率最低,而在正己烷中加入极性相对较强的乙酸乙酯,磷虾油得率有明显提高。

图3 有机溶剂提取南极磷虾油得率Fig.3 The yield of Antarctic krill oil extracted by organic solvent
进一步分析不同溶剂提取的南极磷虾粉中磷脂,如表4所示,通过乙醇提取得到的磷脂在色谱图中有干扰峰;不同溶剂提取得到南极磷虾油中均含有PC和LPC,其中95%乙醇和氯仿-甲醇(2∶1,V/V)溶液提取得到的PC、LPC和PE含量相近且最高;正己烷提取得到的磷虾油中PC和LPC含量最少。综合考虑,本方法采用氯仿-甲醇(2∶1,V/V)进行磷脂的提取。
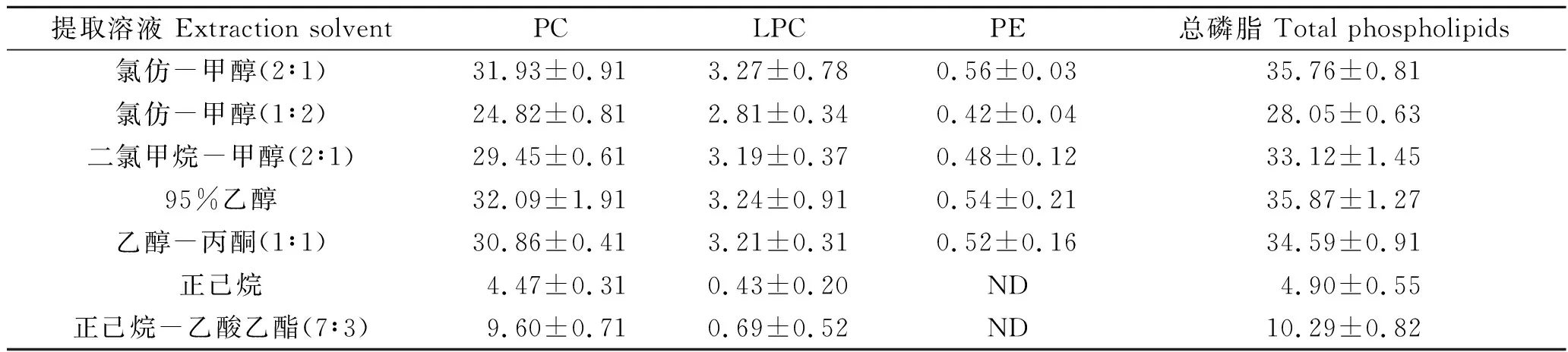
表4 不同溶剂提取的南极磷虾粉中磷脂含量Tab.4 Phospholipid content in Antarctic krill meal extracted with different solvents (mg·g-1)
根据前期磷虾油中磷脂研究及文献报道[23-25],继续选用氨基固相萃取柱作为净化柱。由于前期研究以氯仿-异丙醇(2∶1,V/V)、乙醚-乙酸(72∶1,V/V)、甲醇分别作为淋洗液和洗脱液对磷虾油中PE、PC、LPC 3种磷脂进行富集净化,本研究发现仅用甲醇作为洗脱液时,PI的洗脱效果较差(PI易溶于氯仿-甲醇),采用10.0 mL甲醇和10.0 mL甲醇-氯仿-2%盐酸水(100∶200∶1,V/V/V)两种溶液洗脱后再合并洗脱液的方法,对PI有较好洗脱效果。磷虾油磷脂检测结果表明,磷虾油中含量最高的是PC,其次为LPC,最后是PE,与文献报道的磷脂含量趋势一致[8]。
2.3 定量限和检出限
根据空白样品加标以信噪比(S/N≥10)确定定量限,PC定量限为0.60 mg/g,PE、PI、SM的定量限为0.20 mg/g,LPC定量限为0.40 mg/g。
2.4 加标回收率和精密度
采用处理后的牡蛎、虹鳟、磷虾粉样品作为空白基质,分别添加不同量的磷脂混合标准溶液,用本方法进行验证,具体加标量见表5。5种磷脂的加标回收率及精密度良好,加标回收率范围为77%~102%,RSD范围为0.75%~9.78%,结果表明该方法具有较好的回收率和良好的精密度。
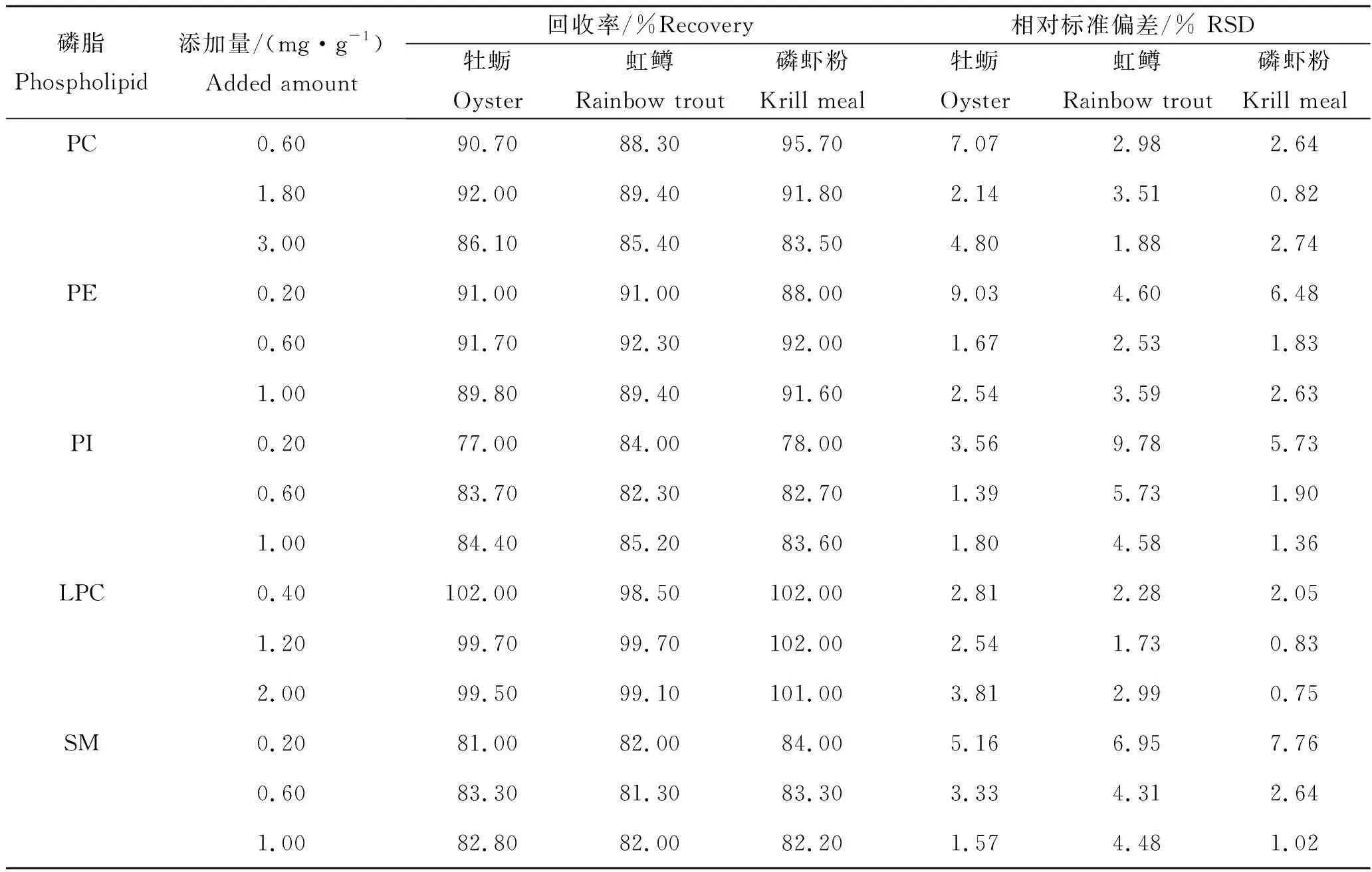
表5 不同固体基质磷脂加标回收率和精密度Tab.5 Spiked recovery and precision of phospholipids from different solid matrices
2.5 样品分析结果
对磷虾粉、牡蛎粉、虹鳟、刺参粉等不同样品检测分析结果如表6所示,磷虾粉中主要含有PE、PC、LPC 3种磷脂,其中PC含量在29.71~35.30 mg/g之间,占总磷脂含量的85.20%~90.14%,远高于其他样品,其次为LPC含量在2.55~4.12 mg/g之间,PE含量为0.99~2.01 mg/g,但PI、SM未检出;乳山牡蛎冻干粉样品中PC含量最高,在10.75~12.90 mg/g之间,占总磷脂含量的63.67%~70.08%;其次为PE含量在2.49~4.40 mg/g之间,PI和SM含量分别为1.64~2.32 mg/g和0.46~0.90 mg/g,部分样品中未检出;虹鳟鲜样中也是PC含量最高,含量范围在5.33~6.64 mg/g之间,占总磷脂含量的65.14%~72.25%,其次为PE含量在2.10~2.55 mg/g之间,PI和SM仅有部分样品检出,含量少且低于0.5 mg/g;刺参冻干粉样品中主要含有PC、PE以及PI,其中PC含量最高,为15.84~20.41 mg/g,占总磷脂含量的74.23%~79.18%,其次为PE含量在2.90~3.69 mg/g之间,PI含量为1.60~2.70 mg/g,但未检出LPC和SM。
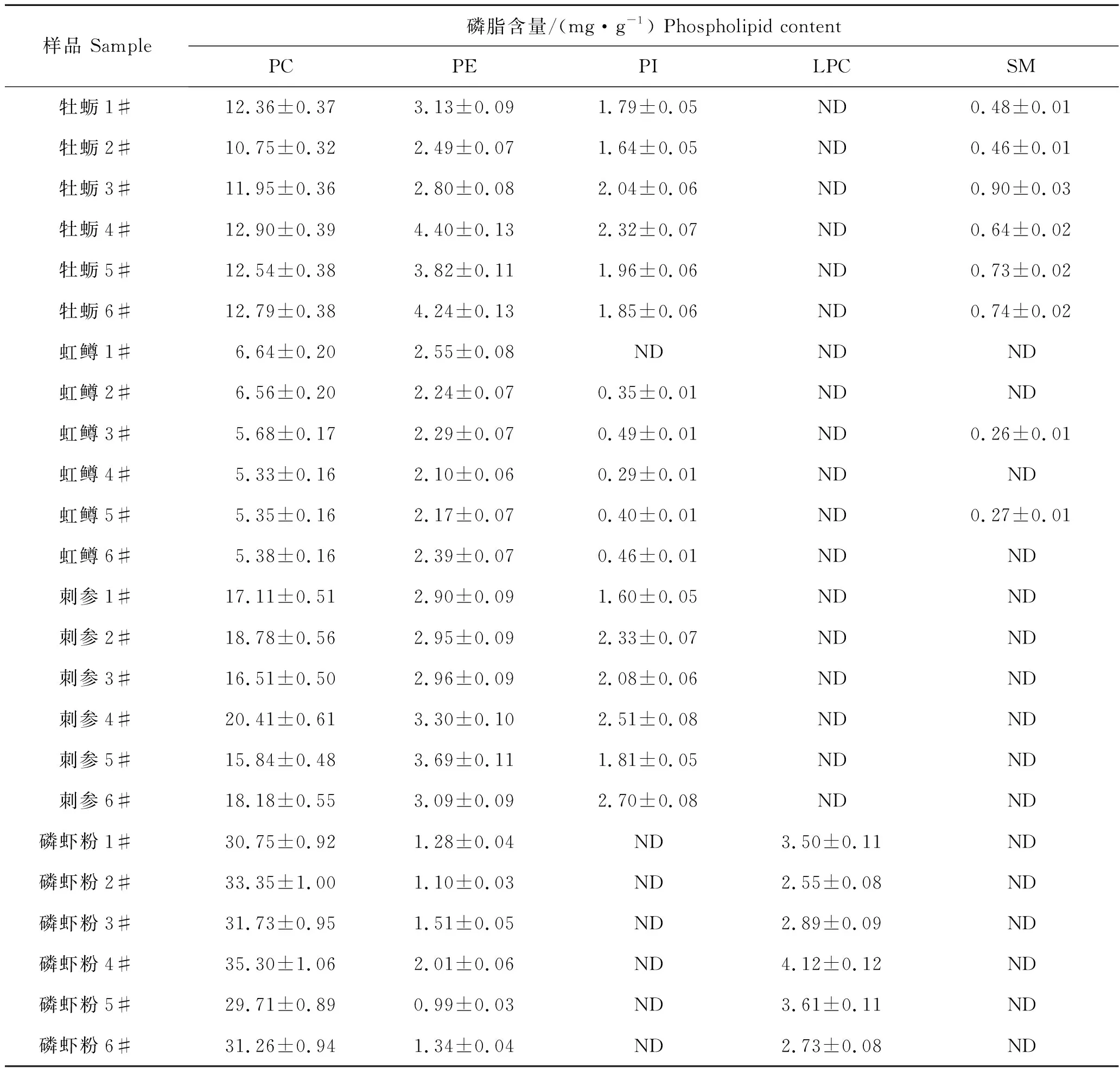
表6 不同水产品样品中磷脂含量Tab.6 Phospholipid content in different aquatic product samples
此外,对海胆酱、蟹黄、鲟鱼子以及海参性腺等水产品生殖腺组织中磷脂含量分析,含量如表7所示。海胆黄中主要含有PE、PC、LPC、SM 4种磷脂,其中PC含量最高;大闸蟹蟹黄中含有PC、PE和SM 3种磷脂,其磷脂总量和海胆黄相近;鲟鱼子酱中只检出PC,且含量为4种性腺样品中最高;海参性腺样品主要含有PE和PC 2种磷脂,但含量较少,均低于1.00 mg/g。
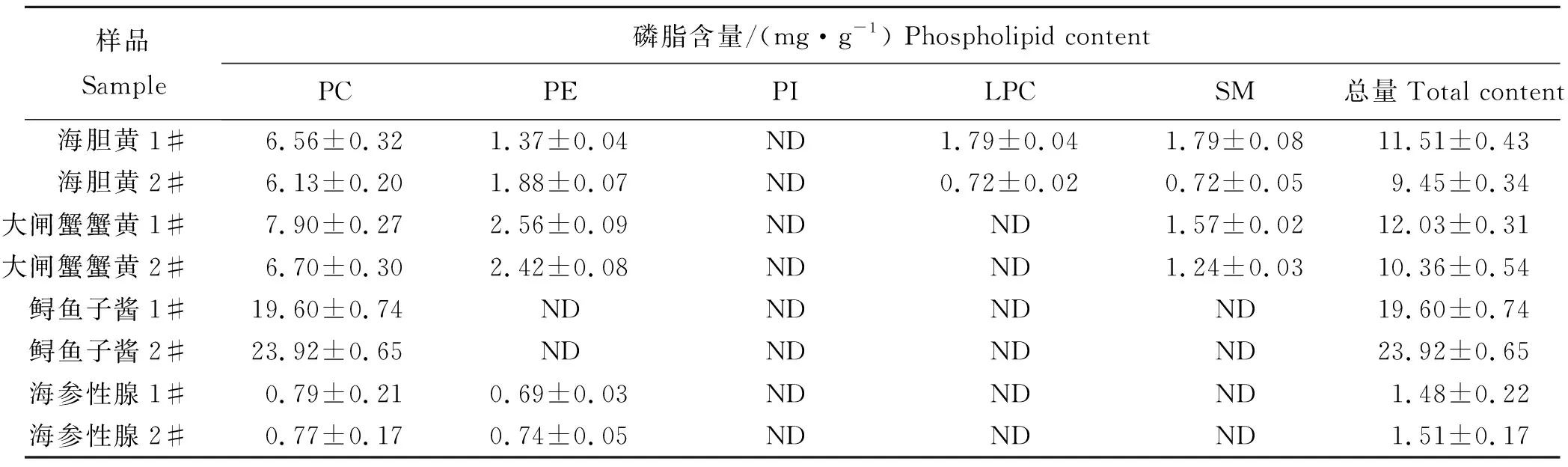
表7 不同水产品性腺中磷脂含量Tab.7 Phospholipid content in gonads of different aquatic products
3 结论
磷脂的分析检测由于仪器、样品来源、计算原理、方法不一致等给结果对比带来困难,因此,建立一种统一可用的检测方法是十分必要的。本研究建立了HPLC-ELSD测定水产品中5种磷脂的定性和定量分析方法,并对方法的回收率及精密度进行了验证。样品分析结果表明,牡蛎、虹鳟、刺参、磷虾粉等不同水产品中磷脂含量丰富,但组成和含量存在差异,其中含量最高的磷脂均为磷脂酰胆碱,其次为磷脂酰乙醇胺,其他3种磷脂即溶血磷脂酰胆碱、磷脂酰肌醇和鞘磷脂仅在部分样品中检出,且含量较少。

